Panbronquiolitis difusa
| Panbronquiolitis difusa | |
|---|---|
 | |
| Imágenes de tomografía computarizada de alta resolución del tórax inferior en un niño de 16 años con panbronquiolitis difusa | |
| Especialidad | Neumología |
La panbronquiolitis difusa ( BPD ) es una enfermedad pulmonar inflamatoria de causa desconocida. Es una forma grave y progresiva de bronquiolitis , una afección inflamatoria de los bronquiolos (pequeños conductos de aire de los pulmones). El término difusa significa que las lesiones aparecen en ambos pulmones, mientras que la panbronquiolitis se refiere a la inflamación que se encuentra en todas las capas de los bronquiolos respiratorios (los que participan en el intercambio de gases ). La panbronquiolitis difusa causa inflamación grave y lesiones similares a nódulos en los bronquiolos terminales , sinusitis crónica y tos intensa con gran producción de esputo .
Se cree que la enfermedad se produce cuando existe susceptibilidad o falta de resistencia del sistema inmunitario a las bacterias o virus que causan la DPB , causada por varios genes que se encuentran predominantemente en personas de ascendencia del este asiático . La incidencia más alta se da entre los japoneses , seguidos de los coreanos . La DPB se presenta con mayor frecuencia en varones y suele comenzar alrededor de los 40 años. Se reconoció como una nueva enfermedad distinta a principios de la década de 1960 y se denominó formalmente panbronquiolitis difusa en 1969.
Si no se trata, la DPB progresa a bronquiectasia , una afección pulmonar irreversible que implica el agrandamiento de los bronquiolos y la acumulación de moco en los conductos bronquiolares. El tratamiento diario de la DPB con antibióticos macrólidos como la eritromicina alivia los síntomas y aumenta el tiempo de supervivencia, pero actualmente no se conoce la cura de la enfermedad. El resultado final de la DPB puede ser insuficiencia respiratoria y problemas cardíacos.
Clasificación
El término "bronquiolitis" generalmente se refiere a la inflamación de los bronquiolos. [1] La DPB se clasifica como una forma de "bronquiolitis primaria", lo que significa que la causa subyacente de la bronquiolitis se origina en los bronquiolos o se limita a ellos. [2] [3] Junto con la DPB, las formas adicionales de bronquiolitis primaria incluyen la bronquiolitis obliterante , la bronquiolitis folicular, la bronquiolitis respiratoria , la enfermedad de las vías respiratorias por polvo mineral y varias otras. [2] A diferencia de la DPB, la bronquiolitis que no se considera "primaria" estaría asociada con enfermedades de las vías respiratorias más grandes, como la bronquitis crónica . [2] [3]
Signos y síntomas
Los síntomas de la DPB incluyen sinusitis crónica ( senos paranasales inflamados ), sibilancias, crepitaciones ( sonidos respiratorios producidos por obstrucciones como flema y secreciones en los pulmones), disnea (dificultad para respirar) y tos intensa que produce grandes cantidades de esputo (flema expectorada). Puede haber pus en el esputo y las personas afectadas pueden tener fiebre. Los signos típicos de progresión de la DPB incluyen dilatación (agrandamiento) de los conductos bronquiolares e hipoxemia (niveles bajos de oxígeno en la sangre). Si la DPB no se trata, se producirá bronquiectasia; se caracteriza por dilatación y engrosamiento de las paredes de los bronquiolos, daño inflamatorio a los bronquiolos respiratorios y terminales y acumulación de moco en los pulmones. [4] [5] La DPB se asocia con insuficiencia respiratoria progresiva , hipercapnia (aumento de los niveles de dióxido de carbono en la sangre) y, eventualmente, puede conducir a hipertensión pulmonar (presión arterial alta en la vena y arteria pulmonar ) y cor pulmonale (dilatación del ventrículo derecho del corazón o "insuficiencia cardíaca derecha"). [6] [7]
Causa

La DPB es idiopática , lo que significa que se desconoce la causa fisiológica , ambiental o patogénica exacta de la enfermedad. Sin embargo, se sospecha que varios factores intervienen en su patogénesis (la forma en que se manifiesta la enfermedad). [4]
El complejo mayor de histocompatibilidad (CMH) es una gran región genómica que se encuentra en la mayoría de los vertebrados y que está asociada con el sistema inmunológico. Se encuentra en el cromosoma 6 en los humanos. Un subconjunto del MHC en los humanos es el antígeno leucocitario humano (HLA), que controla el sistema de presentación de antígenos , como parte de la inmunidad adaptativa contra patógenos como bacterias y virus . Cuando las células humanas son infectadas por un patógeno, algunas de ellas pueden presentar partes de las proteínas del patógeno en sus superficies; esto se llama "presentación de antígenos". Las células infectadas luego se convierten en objetivos para los tipos de células T citotóxicas , que matan a las células infectadas para que puedan eliminarse del cuerpo. [8]
La predisposición genética para la susceptibilidad a la DPB se ha localizado en dos haplotipos HLA (una diferencia de secuencia de nucleótidos o genes entre cromosomas pareados , que es más probable que ocurra entre una etnia o rasgo común) común a las personas de ascendencia del este asiático. HLA-B54 está asociado con la DPB en los japoneses, mientras que HLA-A11 está asociado con la enfermedad en los coreanos. [9] Se cree que varios genes dentro de esta región de HLA de clase I son responsables de la DPB, al permitir una mayor susceptibilidad a la enfermedad. [7] [10] El trasfondo genético común y las similitudes en el perfil HLA de los individuos japoneses y coreanos afectados se consideraron en la búsqueda de un gen DPB. [10] Se sugirió que una mutación de un gen sospechoso de susceptibilidad a la enfermedad ubicado en algún lugar entre HLA-B [11] y HLA-A [12] había ocurrido en un cromosoma ancestral que portaba tanto HLA-B54 como HLA-A11. Además, es posible que una serie de eventos de recombinación genética alrededor del locus de la enfermedad (ubicación en un cromosoma) pudieran haber dado como resultado que la enfermedad se asociara con HLA-B54 en los japoneses y HLA-A11 en los coreanos. Después de un estudio más profundo, se concluyó que un gen de susceptibilidad a DPB se encuentra cerca del locus HLA-B en el cromosoma 6p21.3. Dentro de esta área, la búsqueda de una causa genética de la enfermedad ha continuado. [9] [10]
Debido a que muchos genes pertenecientes al HLA permanecen sin identificar, se ha utilizado la clonación posicional (un método utilizado para identificar un gen específico, cuando solo se conoce su ubicación en un cromosoma) para determinar que un gen similar a la mucina está asociado con DPB. Además, se han investigado enfermedades causadas por genes HLA identificados en la región de susceptibilidad a DPB. Una de ellas, el síndrome del linfocito desnudo I (BLS I), exhibe una serie de similitudes con DPB en los afectados, incluyendo sinusitis crónica, inflamación y nódulos bronquiolares y la presencia de H. influenzae . También como DPB, BLS I responde favorablemente a la terapia con eritromicina mostrando una resolución de los síntomas. Las similitudes entre estas dos enfermedades, el éxito correspondiente con el mismo modo de tratamiento y el hecho de que el gen responsable de BLS I se encuentra dentro del área causante de DPB de HLA limita el establecimiento de un gen responsable de DPB. [9] No se cree que factores ambientales como la inhalación de humos tóxicos y el tabaquismo desempeñen un papel en la DPB, y no se han descartado causas ambientales desconocidas y otras causas no genéticas, como bacterias o virus no identificados. [4] [6] [7]
La fibrosis quística (FQ), una enfermedad pulmonar multisistémica progresiva, se ha tenido en cuenta en la búsqueda de una causa genética de la DPB por varias razones. La FQ, al igual que la DPB, causa inflamación pulmonar grave, abundante producción de moco, infección y muestra un predominio genético entre los caucásicos de un grupo geográfico en comparación con la rareza de otros; mientras que la DPB predomina entre los asiáticos orientales, la FQ afecta principalmente a individuos de ascendencia europea. Si bien no se ha implicado a ningún gen como causa de la DPB, la mutación en un gen específico, que es mucho más probable que ocurra en los europeos, causa la FQ. Esta mutación en el gen que causa la FQ no es un factor en la DPB, pero se sabe que un polimorfismo (variación) único en este gen ocurre en muchos asiáticos que no necesariamente están afectados por ninguna de las dos enfermedades. Se está investigando si este gen en cualquier estado de mutación podría contribuir a la DPB. [4] [9]
Fisiopatología
La inflamación es una parte normal de la respuesta inmunitaria humana, por la cual los leucocitos (glóbulos blancos), incluidos los neutrófilos (glóbulos blancos que se especializan en causar inflamación), se reúnen y las quimiocinas (proteínas liberadas de ciertas células, que activan o provocan una respuesta de otras células) se acumulan en cualquier lugar del cuerpo donde se produzcan infecciones bacterianas o virales. La inflamación interfiere con la actividad de las bacterias y los virus, y sirve para eliminarlos del cuerpo. En la DPB, bacterias como Haemophilus influenzae y Pseudomonas aeruginosa pueden causar la proliferación de células inflamatorias en los tejidos bronquiolares. Sin embargo, cuando ninguna de las bacterias está presente en la DPB, la inflamación continúa por una razón aún desconocida. [4] [5] En cualquier circunstancia, la inflamación en la DPB puede ser tan grave que se forman nódulos que contienen células inflamatorias en las paredes de los bronquiolos. [4] [13] La presencia de inflamación e infección en las vías respiratorias también da como resultado la producción de exceso de moco, que debe toserse como esputo. [4] [6] La combinación de inflamación, desarrollo de nódulos, infección, moco y tos frecuente contribuye a las dificultades respiratorias en la DPB. [4] [5]
El hecho de que la inflamación en la DPB persista con o sin la presencia de P. aeruginosa y H. influenzae proporciona un medio para determinar varios mecanismos de patogénesis de la DPB. [5] Los leucotrienos son eicosanoides , moléculas de señalización hechas de ácidos grasos esenciales , que desempeñan un papel en muchas enfermedades pulmonares al causar la proliferación de células inflamatorias y la producción excesiva de moco en las vías respiratorias. [14] En la DPB y otras enfermedades pulmonares, el mediador predominante de la inflamación relacionada con los neutrófilos es el leucotrieno B4 , que se especializa en la proliferación de neutrófilos a través de la quimiotaxis (el movimiento de algunos tipos de células hacia o desde ciertas moléculas). [4] [9]
La inflamación en la DPB también es causada por la quimiocina MIP-1alfa y su participación en las células T CD8 + . Las beta defensinas , una familia de péptidos antimicrobianos que se encuentran en el tracto respiratorio, son responsables de una mayor inflamación en la DPB cuando está presente un patógeno como P. aeruginosa . Si está presente con DPB, el virus linfotrópico T humano, tipo I , un retrovirus , modifica la patogénesis de la DPB al infectar las células T auxiliares y alterar su eficacia para reconocer la presencia de patógenos conocidos o desconocidos involucrados con la DPB. [4] [9]
Diagnóstico

El diagnóstico de DPB requiere el análisis de los pulmones y los tejidos bronquiolares, que puede requerir una biopsia pulmonar o la tomografía computarizada de alta resolución (TCAR) más preferida de los pulmones. [7] Los criterios de diagnóstico incluyen inflamación grave en todas las capas de los bronquiolos respiratorios y lesiones en el tejido pulmonar que aparecen como nódulos dentro de los bronquiolos terminales y respiratorios en ambos pulmones. [4] Los nódulos en DPB aparecen como bultos opacos cuando se observan en radiografías del pulmón y pueden causar obstrucción de las vías respiratorias , que se evalúa mediante una prueba de función pulmonar o PFT. [6] Las radiografías de pulmón también pueden revelar dilatación de los conductos bronquiolares, otro signo de DPB. Las tomografías computarizadas de alta resolución a menudo muestran bloqueos de algunos conductos bronquiolares con moco, lo que se conoce como patrón de "árbol en brote" . [7] La hipoxemia, otro signo de dificultad para respirar, se revela midiendo el contenido de oxígeno y dióxido de carbono de la sangre, utilizando un análisis de sangre llamado gas en sangre arterial . Otros hallazgos observados con DPB incluyen la proliferación de linfocitos ( glóbulos blancos que combaten las infecciones), neutrófilos e histiocitos espumosos ( macrófagos tisulares ) en el revestimiento pulmonar . También se detectan bacterias como H. influenzae y P. aeruginosa , y esta última se vuelve más prominente a medida que progresa la enfermedad. [4] [5] El contenido de glóbulos blancos, bacterias y otras células de la sangre se puede medir tomando un hemograma completo (CSC). Se pueden observar niveles elevados de IgG e IgA (clases de inmunoglobulinas ), así como la presencia de factor reumatoide (un indicador de autoinmunidad ). También puede ocurrir hemaglutinación , una aglutinación de glóbulos rojos en respuesta a la presencia de anticuerpos en la sangre. También se pueden detectar neutrófilos, beta-defensinas, leucotrienos y quimiocinas en el líquido de lavado broncoalveolar inyectado y luego extraído de las vías respiratorias bronquiolares de individuos con DPB, para su evaluación. [4] [9]
Diagnóstico diferencial
En el diagnóstico diferencial (hallazgo del diagnóstico correcto entre enfermedades que tienen características superpuestas) de algunas enfermedades pulmonares obstructivas, a menudo se considera la DPB. Varios síntomas de DPB se parecen a los que se encuentran en otras enfermedades pulmonares obstructivas como el asma , la bronquitis crónica y el enfisema . Las sibilancias , la tos con producción de esputo y la falta de aire son síntomas comunes en dichas enfermedades, y se encuentra deterioro funcional respiratorio obstructivo en las pruebas de función pulmonar . [6] La fibrosis quística, como la DPB, causa inflamación pulmonar grave, producción excesiva de moco e infección; pero la DPB no causa alteraciones del páncreas ni de los electrolitos , como lo hace la fibrosis quística, por lo que las dos enfermedades son diferentes y probablemente no están relacionadas. [4] [9] La DPB se distingue por la presencia de lesiones que aparecen en las radiografías como nódulos en los bronquiolos de ambos pulmones; inflamación en todas las capas de tejido de los bronquiolos respiratorios; y su mayor prevalencia entre individuos con linaje del este asiático. [4]
La bronquiolitis obliterante y la bronquiolitis primaria son dos formas de bronquiolitis primaria. [2] Las características superpuestas específicas de ambas enfermedades incluyen tos fuerte con grandes cantidades de esputo a menudo lleno de pus; nódulos visibles en radiografías de pulmón en los bronquios inferiores y el área bronquiolar; y sinusitis crónica. En la bronquiolitis obliterante, los nódulos están más restringidos a los bronquiolos respiratorios, mientras que en la OB se encuentran a menudo en los bronquiolos membranosos (la sección inicial no cartilaginosa del bronquiolo, que se divide del bronquio terciario ) hasta el bronquio secundario . La OB es una enfermedad bronquiolar con prevalencia mundial, mientras que la bronquiolitis obliterante tiene una prevalencia más localizada, predominantemente en Japón. [2] [6] Antes del reconocimiento clínico de la DPB en los últimos años, a menudo se diagnosticaba erróneamente como bronquiectasia , EPOC , FPI , tisis miliar , sarcoidosis o carcinoma de células alveolares . [15]
Tratamiento
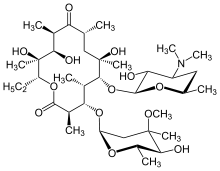
Los antibióticos macrólidos , como la eritromicina , son un tratamiento eficaz para la DPB cuando se toman regularmente durante un período prolongado de tiempo. [16] [17] [18] La claritromicina o la roxitromicina también se utilizan comúnmente. [19] Los resultados exitosos de los macrólidos en la DPB y enfermedades pulmonares similares se deben al manejo de ciertos síntomas a través de la inmunomodulación (ajuste de la respuesta inmunitaria), [17] que se puede lograr tomando los antibióticos en dosis bajas . El tratamiento consiste en la administración oral diaria de eritromicina [7] durante dos a tres años, un período prolongado que ha demostrado mejorar drásticamente los efectos de la DPB. Esto es evidente cuando un individuo sometido a tratamiento para la DPB, entre varios criterios de remisión relacionados con la enfermedad, tiene un recuento normal de neutrófilos detectado en el líquido BAL y las lecturas de gases en sangre (una prueba de sangre arterial que mide la cantidad de oxígeno y dióxido de carbono en la sangre) muestran que el oxígeno libre en la sangre está dentro del rango normal. [16] [17] [20] Se ha sugerido que en estos casos se permita una interrupción temporal de la terapia con eritromicina para reducir la formación de P. aeruginosa resistente a macrólidos . [16] Sin embargo, los síntomas de DPB generalmente regresan y sería necesario reanudar el tratamiento. Aunque es muy eficaz, la eritromicina puede no resultar exitosa en todos los individuos con la enfermedad, en particular si hay P. aeruginosa resistente a macrólidos o si la DPB no tratada previamente ha progresado hasta el punto de producir insuficiencia respiratoria. [17] [20]
Con la terapia con eritromicina en DPB, se logra una gran reducción en la inflamación y el daño bronquiolar a través de la supresión no solo de la proliferación de neutrófilos , sino también de la actividad de los linfocitos y las secreciones obstructivas de moco y agua en las vías respiratorias. [16] Los efectos antibióticos de los macrólidos no están involucrados en sus efectos beneficiosos para reducir la inflamación en DPB. [20] Esto es evidente porque la dosis del tratamiento es demasiado baja para combatir la infección, y en los casos de DPB con la aparición de P. aeruginosa resistente a los macrólidos , la terapia con eritromicina aún reduce la inflamación. [16]
En la supresión de la inflamación por la eritromicina y otros macrólidos intervienen diversos factores. Estos últimos son especialmente eficaces para inhibir la proliferación de neutrófilos, al disminuir la capacidad de la interleucina 8 y el leucotrieno B4 para atraerlos. [21] Los macrólidos también reducen la eficacia de las moléculas de adhesión que permiten que los neutrófilos se adhieran a los revestimientos de los tejidos bronquiolares. La producción de moco en las vías respiratorias es una de las principales causas de la morbilidad y la mortalidad de la DPB y otras enfermedades respiratorias. La reducción significativa de la inflamación en la DPB atribuida a la terapia con eritromicina también ayuda a inhibir la producción excesiva de moco. [21]
Pronóstico
La DPB no tratada provoca bronquiectasias, insuficiencia respiratoria y muerte. Un informe de una revista de 1983 indicó que la DPB no tratada tenía una tasa de supervivencia a cinco años del 62,1%, mientras que la tasa de supervivencia a 10 años era del 33,2%. [6] Con el tratamiento con eritromicina, las personas con DPB ahora tienen una esperanza de vida mucho más larga debido a un mejor manejo de los síntomas, retraso de la progresión y prevención de infecciones asociadas como P. aeruginosa . [20] La tasa de supervivencia a 10 años para la DPB tratada es de alrededor del 90%. [4] En los casos de DPB en los que el tratamiento ha dado como resultado una mejoría significativa, que a veces ocurre después de unos dos años, se ha permitido que el tratamiento finalice durante un tiempo. Sin embargo, las personas a las que se les permite interrumpir el tratamiento durante este tiempo son monitoreadas de cerca. Como se ha demostrado que la DPB recurre, la terapia con eritromicina debe reanudarse rápidamente una vez que los síntomas de la enfermedad comienzan a reaparecer. A pesar del pronóstico mejorado cuando se trata, la DPB actualmente no tiene cura conocida. [4] [9]
Epidemiología
La prevalencia más alta de la panbronquiolitis difusa se da entre los japoneses, con 11 casos por cada 100.000 habitantes. [4] También se han descrito casos de personas coreanas, [22] chinas [23] y tailandesas [24] con esta enfermedad. Se ha sugerido una predisposición genética entre los asiáticos orientales. [9] La enfermedad es más común en los varones, [25] con una proporción de varones a mujeres de 1,4 a 2:1 (o alrededor de 5 hombres por cada 3 mujeres). [4] El inicio promedio de la enfermedad es alrededor de los 40 años, y dos tercios de los afectados son no fumadores, aunque no se cree que el tabaquismo sea una causa. [7] La presencia de HLA-Bw54 aumenta el riesgo de panbronquiolitis difusa 13,3 veces. [26]
En Europa y las Américas, se ha informado de un número relativamente pequeño de casos de DPB en inmigrantes y residentes asiáticos, así como en individuos de ascendencia no asiática. [27] [28] [29] En Occidente se han producido diagnósticos erróneos debido a un menor reconocimiento de la enfermedad que en los países asiáticos. En relación con el gran número de asiáticos que viven en Occidente, el pequeño número de ellos que se cree que están afectados por DPB sugiere que factores no genéticos pueden desempeñar algún papel en su causa. Esta rareza observada en los asiáticos occidentales también puede estar asociada en parte con el diagnóstico erróneo. [7] [30]
Historia
A principios de los años 1960, los médicos japoneses empezaron a observar y describir una enfermedad pulmonar crónica relativamente nueva. En 1969, [31] se introdujo el nombre de "panbronquiolitis difusa" para distinguirla de la bronquitis crónica, el enfisema, la alveolitis y otras enfermedades pulmonares obstructivas con inflamación. Entre 1978 y 1980, los resultados de una encuesta nacional iniciada por el Ministerio de Salud y Bienestar Social de Japón revelaron más de 1.000 casos probables de panbronquiolitis difusa, de los cuales 82 fueron confirmados histológicamente. En los años 1980, se la reconoció internacionalmente como una enfermedad distinta de los pulmones. [4] [6]
Antes de la década de 1980, el pronóstico o resultado esperado de la DPB era malo, especialmente en casos de sobreinfección (la aparición de una nueva infección viral o bacteriana, además de la infección en curso) por P. aeruginosa . [13] La DPB continuó teniendo una tasa de mortalidad muy alta antes de que el tratamiento antibiótico generalizado y la oxigenoterapia comenzaran a usarse de manera rutinaria en el esfuerzo por controlar los síntomas. Alrededor de 1985, cuando el tratamiento a largo plazo con el antibiótico eritromicina se convirtió en el estándar para el manejo de la DPB, el pronóstico mejoró significativamente. [20] En 1990, se afirmó inicialmente la asociación de la DPB con el HLA. [9]
Referencias
- ^ Visscher DW, Myers JL (2006). "Bronquiolitis: la perspectiva del patólogo". Actas de la American Thoracic Society . 3 (1): 41–7. doi :10.1513/pats.200512-124JH. PMID 16493150. Archivado desde el original (Texto completo libre) el 16 de abril de 2010. Consultado el 16 de agosto de 2015 .
- ^ abcde Ryu JH, Myers JL, Swensen SJ (diciembre de 2003). «Bronchiolar disorder» (Trastornos bronquiolares). American Journal of Respiratory and Critical Care Medicine . 168 (11): 1277–92. doi :10.1164/rccm.200301-053SO. PMID 14644923. Archivado desde el original (Texto completo libre) el 2 de diciembre de 2009. Consultado el 16 de agosto de 2015 .
- ^ ab Ryu JH (marzo de 2006). "Clasificación y abordaje de las enfermedades bronquiolares". Current Opinion in Pulmonary Medicine . 12 (2): 145–51. doi :10.1097/01.mcp.0000208455.80725.2a. PMID 16456385. S2CID 23668839.
- ^ abcdefghijklmnopqrst Poletti V, Casoni G, Chilosi M, Zompatori M (octubre de 2006). "Panbronquiolitis difusa". La revista respiratoria europea . 28 (4): 862–71. doi : 10.1183/09031936.06.00131805 . PMID 17012632.
- ^ abcde Yanagihara K, Kadoto J, Kohno S (2001). "Panbronquiolitis difusa: fisiopatología y mecanismos de tratamiento". Revista internacional de agentes antimicrobianos . 18 (Supl 1): S83-7. doi :10.1016/s0924-8579(01)00403-4. PMID 11574201.
- ^ abcdefgh Homma H, Yamanaka A, Tanimoto S, Tamura M, Chijimatsu Y, Kira S, Izumi T (enero de 1983). "Panbronquiolitis difusa. Una enfermedad de la zona de transición del pulmón". Pecho . 83 (1): 63–9. doi : 10.1378/chest.83.1.63. PMID 6848335.
- ^ abcdefgh Anthony M, Singham S, Soans B, Tyler G (octubre de 2009). "Panbronquiolitis difusa: no solo una enfermedad asiática: serie de casos australianos y revisión de la literatura". Revista de imágenes e intervención biomédicas . 5 (4): e19. doi :10.2349/biij.5.4.e19. PMC 3097723 . PMID 21610988.
- ^ Morris AG, Hewitt C, Young S (1994). El complejo mayor de histocompatibilidad: sus genes y sus funciones en la presentación de antígenos. Vol. 15. Pergamon.
- ^ abcdefghijk Keicho N, Hijikata M (mayo de 2011). "Predisposición genética a la panbronquiolitis difusa". Respirología . 16 (4): 581–8. doi :10.1111/j.1440-1843.2011.01946.x. PMID 21303426. S2CID 13600381.
- ^ abc Online Herencia mendeliana en el hombre (OMIM): Panbronquiolitis difusa - 604809 Consultado el 11 de noviembre de 2011.
- ^ Herencia mendeliana en línea en el hombre (OMIM): antígeno leucocitario humano B - 142830 Consultado el 21 de septiembre de 2011.
- ^ Herencia mendeliana en línea en el hombre (OMIM): antígeno leucocitario humano A - 142800 Consultado el 21 de septiembre de 2011.
- ^ ab Azuma A, Kudoh S (mayo de 2006). "Panbronquiolitis difusa en Asia oriental". Respirology . 11 (3): 249–61. doi :10.1111/j.1440-1843.2006.00845.x. PMID 16635082. S2CID 24559334.
- ^ Busse WW (junio de 1998). "Leucotrienos e inflamación". American Journal of Respiratory and Critical Care Medicine . 157 (6 Pt 1): S210-3. doi :10.1164/ajrccm.157.6.mar-1. PMID 9620941. Archivado desde el original (Texto completo libre) el 10 de mayo de 2007. Consultado el 16 de agosto de 2015 .
- ^ Li H, Zhou Y, Fan F, Zhang Y, Li X, Yu H, et al. (agosto de 2011). "Efecto de la azitromicina en pacientes con panbronquiolitis difusa: estudio retrospectivo de 51 casos". Medicina interna . 50 (16): 1663–9. doi : 10.2169/internalmedicine.50.4727 . PMID 21841323.
- ^ abcde Kanoh S, Rubin BK (julio de 2010). "Mecanismos de acción y aplicación clínica de los macrólidos como medicamentos inmunomoduladores". Clinical Microbiology Reviews (texto completo gratuito). 23 (3): 590–615. doi :10.1128/CMR.00078-09. PMC 2901655 . PMID 20610825.
- ^ abcd López-Boado YS, Rubin BK (junio de 2008). "Macrólidos como medicamentos inmunomoduladores para la terapia de enfermedades pulmonares crónicas". Current Opinion in Pharmacology . 8 (3): 286–91. doi :10.1016/j.coph.2008.01.010. PMID 18339582.
- ^ Lin X, Lu J, Yang M, Dong BR, Wu HM (enero de 2015). "Macrólidos para la panbronquiolitis difusa". Base de Datos Cochrane de Revisiones Sistemáticas . 1 (1): CD007716. doi :10.1002/14651858.CD007716.pub4. PMC 6464977 . PMID 25618845.
- ^ Keicho N, Kudoh S (2002). "Panbronquiolitis difusa: papel de los macrólidos en la terapia". Revista estadounidense de medicina respiratoria . 1 (2): 119–31. doi :10.1007/BF03256601. PMID 14720066. S2CID 39880028.
- ^ abcde Schultz MJ (julio de 2004). "Actividades de los macrólidos más allá de sus efectos antimicrobianos: macrólidos en la panbronquiolitis difusa y la fibrosis quística" (Texto completo gratuito) . The Journal of Antimicrobial Chemotherapy . 54 (1): 21–8. doi : 10.1093/jac/dkh309 . PMID 15190022.
- ^ ab Tamaoki J, Kadota J, Takizawa H (noviembre de 2004). "Implicaciones clínicas de los efectos inmunomoduladores de los macrólidos". The American Journal of Medicine . 117 Suppl 9A (9): 5S–11S. doi :10.1016/j.amjmed.2004.07.023. PMID 15586558.
- ^ Kim YW, Han SK, Shim YS, Kim KY, Han YC, Seo JW, Im JG (mayo de 1992). "El primer informe de panbronquiolitis difusa en Corea: cinco informes de casos". Medicina interna . 31 (5): 695–701. doi : 10.2169/internalmedicine.31.695 . PMID 1504438.
- ^ Chen Y, Kang J, Li S (enero de 2005). "Panbronquiolitis difusa en China". Respirology . 10 (1): 70–5. doi :10.1111/j.1440-1843.2005.00622.x. PMID 15691241. S2CID 37365518.
- ^ Chantarotorn S, Palwatwichai A, Vattanathum A, Tantamacharik D (agosto de 1999). "Panbronquiolitis difusa, los primeros informes de casos en Tailandia". Revista de la Asociación Médica de Tailandia = Chotmaihet Thangphaet . 82 (8): 833–8. PMID 10511794.
- ^ Høiby N (junio de 1994). "Panbronquiolitis difusa y fibrosis quística: Oriente se encuentra con Occidente". Thorax . 49 (6): 531–2. doi :10.1136/thx.49.6.531. PMC 474936 . PMID 8016786.
- ^ Lazarus SC (2005). Murray and Nadel's Textbook of Respiratory Medicine (4.ª ed.). WB Saunders. pág. 1300. ISBN 978-0-7216-0327-8.
- ^ Fitzgerald JE, King TE, Lynch DA, Tuder RM, Schwarz MI (agosto de 1996). "Panbronquiolitis difusa en los Estados Unidos". Revista estadounidense de medicina respiratoria y de cuidados críticos . 154 (2 puntos 1): 497–503. doi :10.1164/ajrccm.154.2.8756828. PMID 8756828.
- ^ Martinez JA, Guimarães SM, Ferreira RG, Pereira CA (marzo de 2000). "Panbronquiolitis difusa en América Latina". La Revista Estadounidense de Ciencias Médicas . 319 (3): 183–5. doi :10.1097/00000441-200003000-00008. PMID 10746829.
- ^ Sandrini A, Balter MS, Chapman KR (2003). "Panbronquiolitis difusa en un hombre caucásico en Canadá". Revista Respiratoria Canadiense . 10 (8): 449–51. doi : 10.1155/2003/786531 . hdl : 1807/82124 . PMID 14679410.
- ^ Brugiere O, Milleron B, Antoine M, Carette MF, Philippe C, Mayaud C (octubre de 1996). "Panbronquiolitis difusa en un inmigrante asiático". Thorax . 51 (10): 1065–7. doi :10.1136/thx.51.10.1065. PMC 472677 . PMID 8977613.
- ^ Yamanaka A, Saiki S, Tamura S, Saito K (marzo de 1969). "[Problemas en enfermedades bronquiales obstructivas crónicas, con especial referencia a la panbronquiolitis difusa]". Naika. Medicina interna (en japonés). 23 (3): 442–51. PMID 5783341.