Nucleósido trifosfato
Un trifosfato de nucleósido es un nucleósido que contiene una base nitrogenada unida a un azúcar de 5 carbonos ( ribosa o desoxirribosa ), con tres grupos fosfato unidos al azúcar. [1] Son los precursores moleculares tanto del ADN como del ARN , que son cadenas de nucleótidos creadas a través de los procesos de replicación y transcripción del ADN . [2] Los trifosfatos de nucleósidos también sirven como fuente de energía para las reacciones celulares [3] y están involucrados en las vías de señalización. [4]
Los trifosfatos de nucleósidos no pueden atravesar fácilmente la membrana celular, por lo que normalmente se sintetizan dentro de la célula. [5] Las vías de síntesis difieren según el trifosfato de nucleósido específico que se esté produciendo, pero dadas las muchas funciones importantes de los trifosfatos de nucleósidos, la síntesis está estrechamente regulada en todos los casos. [6] Los análogos de nucleósidos también se pueden utilizar para tratar infecciones virales. [7] Por ejemplo, la azidotimidina (AZT) es un análogo de nucleósido utilizado para prevenir y tratar el VIH/SIDA . [8]
Nombramiento
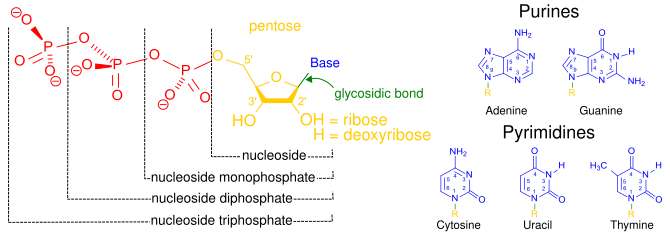
El término nucleósido se refiere a una base nitrogenada unida a un azúcar de 5 carbonos ( ribosa o desoxirribosa ). [1] Los nucleótidos son nucleósidos unidos covalentemente a uno o más grupos fosfato . [9] Para proporcionar información sobre la cantidad de fosfatos, los nucleótidos pueden denominarse nucleósidos (mono, di o tri)fosfatos. [10] Por lo tanto, los nucleósidos trifosfatos son un tipo de nucleótido. [10]
Los nucleótidos se abrevian comúnmente con 3 letras (4 o 5 en el caso de desoxi- o didesoxi-nucleótidos). La primera letra indica la identidad de la base nitrogenada (p. ej., A para adenina , G para guanina ), la segunda letra indica el número de fosfatos (mono, di, tri) y la tercera letra es P, que representa el fosfato. [ 11] Los trifosfatos de nucleósidos que contienen ribosa como azúcar se abrevian convencionalmente como NTP, mientras que los trifosfatos de nucleósidos que contienen desoxirribosa como azúcar se abrevian como dNTP. Por ejemplo, dATP significa desoxirribosa adenosina trifosfato. Los NTP son los componentes básicos del ARN y los dNTP son los componentes básicos del ADN . [12]
Los carbonos del azúcar en un nucleósido trifosfato se numeran alrededor del anillo de carbono comenzando desde el carbonilo original del azúcar. Convencionalmente, los números de carbono en un azúcar van seguidos del símbolo de prima (') para distinguirlos de los carbonos de la base nitrogenada. La base nitrogenada está unida al carbono 1' a través de un enlace glucosídico , y los grupos fosfato están unidos covalentemente al carbono 5'. [13] El primer grupo fosfato unido al azúcar se denomina α-fosfato, el segundo es β-fosfato y el tercero es γ-fosfato; estos están unidos entre sí por dos enlaces fosfoanhídrido . [14]
Síntesis de ADN y ARN

Los procesos celulares de replicación y transcripción del ADN implican la síntesis de ADN y ARN, respectivamente. La síntesis de ADN utiliza dNTP como sustratos, mientras que la síntesis de ARN utiliza rNTP como sustratos. [2] Los NTP no se pueden convertir directamente en dNTP. El ADN contiene cuatro bases nitrogenadas diferentes: adenina , guanina , citosina y timina . El ARN también contiene adenina, guanina y citosina, pero reemplaza la timina por uracilo . [15] Por lo tanto, la síntesis de ADN requiere dATP, dGTP, dCTP y dTTP como sustratos, mientras que la síntesis de ARN requiere ATP, GTP, CTP y UTP.
La síntesis de ácidos nucleicos es catalizada por la ADN polimerasa o la ARN polimerasa para la síntesis de ADN y ARN respectivamente. [16] Estas enzimas unen covalentemente el grupo -OH libre en el carbono 3' de una cadena creciente de nucleótidos al α-fosfato en el carbono 5' del siguiente (d)NTP, liberando los grupos β- y γ-fosfato como pirofosfato (PP i ). [17] Esto da como resultado un enlace fosfodiéster entre los dos (d)NTP. La liberación de PP i proporciona la energía necesaria para que se produzca la reacción. [17] Es importante señalar que la síntesis de ácidos nucleicos se produce exclusivamente en la dirección 5' a 3' .
Metabolismo del trifosfato de nucleósido
Dada su importancia en la célula, la síntesis y degradación de los trifosfatos de nucleósidos está bajo un estricto control. [6] Esta sección se centra en el metabolismo de los trifosfatos de nucleósidos en humanos, pero el proceso está bastante conservado entre las especies. [18] Los trifosfatos de nucleósidos no se pueden absorber bien, por lo que todos los trifosfatos de nucleósidos se producen típicamente de novo . [19] La síntesis de ATP y GTP ( purinas ) difiere de la síntesis de CTP, TTP y UTP ( pirimidinas ). Tanto la síntesis de purinas como la de pirimidinas utilizan pirofosfato de fosforribosil (PRPP) como molécula de partida. [20]
La conversión de NTP a dNTP solo se puede realizar en forma de difosfato. Normalmente, a un NTP se le quita un fosfato para convertirlo en NDP, luego se convierte en dNDP mediante una enzima llamada ribonucleótido reductasa y luego se le vuelve a agregar un fosfato para formar un dNTP. [21]
Síntesis de purinas
Una base nitrogenada llamada hipoxantina se ensambla directamente sobre el PRPP. [22] Esto da como resultado un nucleótido llamado monofosfato de inosina (IMP). El IMP luego se convierte en un precursor de AMP o GMP. Una vez que se forman AMP o GMP, pueden ser fosforilados por ATP a sus formas difosfato y trifosfato. [23]
La síntesis de purina está regulada por la inhibición alostérica de la formación de IMP por los nucleótidos de adenina o guanina. [24] El AMP y el GMP también inhiben competitivamente la formación de sus precursores a partir de IMP. [25]
Síntesis de pirimidina
Una base nitrogenada llamada orotato se sintetiza independientemente del PRPP. [25] Una vez que se produce el orotato, se une covalentemente al PRPP. Esto da como resultado un nucleótido llamado orotato monofosfato (OMP). [26] El OMP se convierte en UMP, que luego puede ser fosforilado por ATP a UDP y UTP. El UTP luego puede convertirse en CTP mediante una reacción de desaminación . [27] El TTP no es un sustrato para la síntesis de ácidos nucleicos, por lo que no se sintetiza en la célula. En cambio, el dTTP se produce indirectamente a partir de dUDP o dCDP después de la conversión a sus respectivas formas de desoxirribosa. [20]
La síntesis de pirimidina está regulada por la inhibición alostérica de la síntesis de orotato por UDP y UTP. El PRPP y el ATP también son activadores alostéricos de la síntesis de orotato. [28]
Ribonucleótido reductasa
La ribonucleótido reductasa (RNR) es la enzima responsable de convertir los NTP en dNTP. Dado que los dNTP se utilizan en la replicación del ADN, la actividad de la RNR está estrechamente regulada. [6] Es importante señalar que la RNR solo puede procesar NDP, por lo que los NTP primero se desfosforilan a NDP antes de la conversión a dNDP. [29] Los dNDP luego suelen volver a fosforilarse. La RNR tiene 2 subunidades y 3 sitios: el sitio catalítico, el sitio de actividad (A) y el sitio de especificidad (S). [29] El sitio catalítico es donde tiene lugar la reacción de NDP a dNDP, el sitio de actividad determina si la enzima está activa o no y el sitio de especificidad determina qué reacción tiene lugar en el sitio catalítico.
El sitio de actividad puede unirse a ATP o dATP. [30] Cuando está unido a ATP, RNR está activo. Cuando ATP o dATP está unido al sitio S, RNR catalizará la síntesis de dCDP y dUDP a partir de CDP y UDP. dCDP y dUDP pueden continuar para producir dTTP indirectamente. dTTP unido al sitio S catalizará la síntesis de dGDP a partir de GDP, y la unión de dGDP al sitio S promoverá la síntesis de dADP a partir de ADP. [31] Luego, dADP se fosforila para dar dATP, que puede unirse al sitio A y desactivar RNR. [30]
Otras funciones celulares
El ATP como fuente de energía celular

El ATP es la principal moneda energética de la célula. [32] A pesar de sintetizarse a través de la vía metabólica descrita anteriormente, se sintetiza principalmente durante la respiración celular [33] y la fotosíntesis [34] por la ATP sintasa . La ATP sintasa acopla la síntesis de ATP a partir de ADP y fosfato con un gradiente electroquímico generado por el bombeo de protones a través de la membrana mitocondrial interna (respiración celular) o la membrana tilacoide (fotosíntesis). [35] Este gradiente electroquímico es necesario porque la formación de ATP es energéticamente desfavorable .
La hidrólisis de ATP a ADP y P i procede de la siguiente manera: [36]
Esta reacción es favorable desde el punto de vista energético y libera 30,5 kJ/mol de energía. [3] En la célula, esta reacción suele ir acompañada de reacciones desfavorables para proporcionarles la energía necesaria para que se lleven a cabo. [37] El GTP se utiliza ocasionalmente para el acoplamiento energético de una manera similar. [38]

Transducción de señales de GTP
El GTP es esencial para la transducción de señales , especialmente con las proteínas G. Las proteínas G están acopladas a un receptor unido a la membrana celular. [4] Todo este complejo se llama receptor acoplado a proteína G (GPCR). Las proteínas G pueden unirse a GDP o GTP. Cuando se unen a GDP, las proteínas G están inactivas. Cuando un ligando se une a un GPCR, se desencadena un cambio alostérico en la proteína G, lo que hace que el GDP se vaya y sea reemplazado por GTP. [39] El GTP activa la subunidad alfa de la proteína G, lo que hace que se disocie de la proteína G y actúe como un efector descendente. [39]
Análogos de nucleósidos
Los análogos de nucleósidos se pueden utilizar para tratar infecciones virales . [40] Los análogos de nucleósidos son nucleósidos que son estructuralmente similares (análogos) a los nucleósidos utilizados en la síntesis de ADN y ARN. [41] Una vez que estos análogos de nucleósidos entran en una célula, pueden ser fosforilados por una enzima viral. Los nucleótidos resultantes son lo suficientemente similares a los nucleótidos utilizados en la síntesis de ADN o ARN para ser incorporados en cadenas de ADN o ARN en crecimiento, pero no tienen un grupo 3' OH disponible para unir el siguiente nucleótido, lo que causa la terminación de la cadena . [42] Esto se puede explotar para usos terapéuticos en infecciones virales porque la ADN polimerasa viral reconoce ciertos análogos de nucleótidos más fácilmente que la ADN polimerasa eucariota. [40] Por ejemplo, la azidotimidina se utiliza en el tratamiento del VIH/SIDA . [8] Algunos análogos de nucleósidos menos selectivos pueden utilizarse como agentes de quimioterapia para tratar el cáncer, [43] como la citosina arabinosa (ara-C) en el tratamiento de ciertas formas de leucemia . [7]
La resistencia a los análogos de nucleósidos es común y con frecuencia se debe a una mutación en la enzima que fosforila el nucleósido después de su entrada en la célula. [7] Esto es común en los análogos de nucleósidos utilizados para tratar el VIH/SIDA. [44]
Véase también
Referencias
- ^ ab "Nucleótidos y bases - Generación genética". Generación genética . Consultado el 11 de noviembre de 2017 .
- ^ ab Chargaff E (2 de diciembre de 2012). Los ácidos nucleicos. Elsevier. ISBN 9780323144773.
- ^ ab "Descripción general de la hidrólisis del ATP". Khan Academy . Archivado desde el original el 1 de diciembre de 2017. Consultado el 11 de noviembre de 2017 .
- ^ ab "GPCR". Scitable . 2014.
- ^ "Comer ADN: nucleótidos dietéticos en la nutrición". El llamado de la guía de miel . 2014-04-09 . Consultado el 11 de noviembre de 2017 .
- ^ abc Wyngaarden JB (1976). "Regulación de la biosíntesis y recambio de purinas". Avances en la regulación enzimática . 14 : 25–42. doi :10.1016/0065-2571(76)90006-6. PMID 184697.
- ^ abc Galmarini CM, Mackey JR, Dumontet C (2001). "Análogos de nucleósidos: mecanismos de resistencia a fármacos y estrategias de reversión". Leucemia . 15 (6): 875–90. doi :10.1038/sj.leu.2402114. PMID 11417472. S2CID 760764.
- ^ ab "Monografía de zidovudina para profesionales - Drugs.com". Drugs.com . Consultado el 30 de noviembre de 2017 .
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Estructura de los ácidos nucleicos.
- ^ ab Secrist JA (mayo de 2001). "Nomenclatura de nucleótidos y nucleósidos" (PDF) . Protocolos actuales en química de ácidos nucleicos . Apéndice 1: A.1D.1–A.1D.3. doi :10.1002/0471142700.nca01ds00. hdl : 2027.42/143595 . PMID: 18428808. S2CID : 205152902.
- ^ "Nomenclatura de nucleósidos". www.biochem.uthscsa.edu . Consultado el 11 de noviembre de 2017 .
- ^ "Del ADN al ARN y a las proteínas, ¿cómo funciona?". Science Explained . Consultado el 11 de noviembre de 2017 .
- ^ "Convención de numeración de nucleótidos". www.biosyn.com . Consultado el 11 de noviembre de 2017 .
- ^ "SparkNotes: Replicación y reparación del ADN: la química de la adición de sustratos de replicación del ADN". www.sparknotes.com . Consultado el 11 de noviembre de 2017 .
- ^ "¿Conoce las diferencias entre el ADN y el ARN?". ThoughtCo . Consultado el 11 de noviembre de 2017 .
- ^ "Diferencia entre la ADN polimerasa y la ARN polimerasa". 24 de diciembre de 2011. Consultado el 11 de noviembre de 2017 .
- ^ ab Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). Síntesis de ácidos nucleicos.
- ^ Samant S, Lee H, Ghassemi M, Chen J, Cook JL, Mankin AS, Neyfakh AA (febrero de 2008). "La biosíntesis de nucleótidos es fundamental para el crecimiento de bacterias en la sangre humana". PLOS Pathogens . 4 (2): e37. doi : 10.1371/journal.ppat.0040037 . PMC 2242838 . PMID 18282099.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Biosíntesis de nucleótidos.
- ^ ab "Metabolismo de nucleótidos: síntesis de ácidos nucleicos". themedicalbiochemistrypage.org . Consultado el 15 de noviembre de 2017 .
- ^ Stubbe J (1990). "Ribonucleótidos reductasas: sorprendentes y confusas" (PDF) . The Journal of Biological Chemistry . 265 (10): 5329–32. doi : 10.1016/S0021-9258(19)39357-3 . PMID 2180924.
- ^ Berg J, Tymoczko JL, Stryer L (2002). Las bases de purina pueden sintetizarse de novo o reciclarse mediante vías de recuperación.
- ^ "Síntesis de purina: síntesis de ribonucleótidos de purina". BiochemDen.com . 16 de marzo de 2016. Consultado el 15 de noviembre de 2017 .
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Los pasos clave en la biosíntesis de nucleótidos están regulados por inhibición por retroalimentación.
- ^ ab Nierlich DP, Magasanik B (1965). "Regulación de la síntesis de ribonucleótidos de purina por inhibición del producto final. El efecto de los ribonucleótidos de adenina y guanina en la 5'-fosforribosil-pirofosfato amidotransferasa de Aerobacter aerogenes". The Journal of Biological Chemistry . 240 : 358–65. doi : 10.1016/S0021-9258(18)97657-X . PMID 14253438.
- ^ Moffatt BA, Ashihara H (abril de 2002). "Síntesis y metabolismo de nucleótidos de purina y pirimidina". The Arabidopsis Book . 1 : e0018. doi :10.1199/tab.0018. PMC 3243375 . PMID 22303196.
- ^ "Metabolismo de la pirimidina". www.cliffsnotes.com . Consultado el 15 de noviembre de 2017 .
- ^ Lane AN, Fan TW (febrero de 2015). "Regulación del metabolismo y la biosíntesis de nucleótidos en mamíferos". Nucleic Acids Research . 43 (4): 2466–85. doi :10.1093/nar/gkv047. PMC 4344498 . PMID 25628363.
- ^ ab Kolberg M, Strand KR, Graff P, Andersson KK (junio de 2004). "Estructura, función y mecanismo de las ribonucleótidos reductasas". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1699 (1–2): 1–34. doi :10.1016/j.bbapap.2004.02.007. PMID 15158709.
- ^ ab Ahmad MF, Dealwis CG (2013). "La base estructural de la regulación alostérica de la ribonucleótido reductasa". Oligomerización en la salud y la enfermedad . Progreso en biología molecular y ciencia traslacional. Vol. 117. págs. 389–410. doi :10.1016/B978-0-12-386931-9.00014-3. ISBN 9780123869319. PMC 4059395 . PMID 23663976.
- ^ Fairman JW, Wijerathna SR, Ahmad MF, Xu H, Nakano R, Jha S, Prendergast J, Welin RM, Flodin S, Roos A, Nordlund P, Li Z, Walz T, Dealwis CG (marzo de 2011). "Base estructural para la regulación alostérica de la ribonucleótido reductasa humana mediante oligomerización inducida por nucleótidos". Nature Structural & Molecular Biology . 18 (3): 316–22. doi :10.1038/nsmb.2007. PMC 3101628 . PMID 21336276.
- ^ "ATP". Citable .
- ^ "Mitocondrias, energía celular, ATP sintasa". Scitable .
- ^ "Síntesis de ATP". Plantas en acción . Consultado el 12 de noviembre de 2017 .
- ^ Jonckheere AI, Smeitink JA, Rodenburg RJ (marzo de 2012). "ATP sintetasa mitocondrial: arquitectura, función y patología". Journal of Inherited Metabolic Disease . 35 (2): 211–25. doi :10.1007/s10545-011-9382-9. PMC 3278611 . PMID 21874297.
- ^ Dittrich M, Hayashi S, Schulten K (octubre de 2003). "Sobre el mecanismo de hidrólisis de ATP en la F1-ATPasa". Biophysical Journal . 85 (4): 2253–66. Bibcode :2003BpJ....85.2253D. doi :10.1016/S0006-3495(03)74650-5. PMC 1303451 . PMID 14507690.
- ^ "ATP: Trifosfato de adenosina | Biología sin límites". courses.lumenlearning.com-US . Consultado el 12 de noviembre de 2017 .
- ^ Carvalho AT, Szeler K, Vavitsas K, Åqvist J, Kamerlin SC (septiembre de 2015). "Modelado de los mecanismos de hidrólisis biológica de GTP". Archivos de bioquímica y biofísica . Número especial sobre modelado computacional de sistemas biológicos. 582 (Suplemento C): 80–90. doi : 10.1016/j.abb.2015.02.027 . PMID 25731854.
- ^ ab "Receptor acoplado a proteína G (GPCR) | bioquímica". Enciclopedia Británica . Consultado el 12 de noviembre de 2017 .
- ^ ab "Análogos de nucleósidos". Moléculas . Consultado el 13 de noviembre de 2017 .
- ^ Jordheim LP, Durantel D, Zoulim F, Dumontet C (junio de 2013). "Avances en el desarrollo de análogos de nucleósidos y nucleótidos para el cáncer y las enfermedades virales". Nature Reviews. Drug Discovery . 12 (6): 447–64. doi :10.1038/nrd4010. PMID 23722347. S2CID 39842610.
- ^ Ewald B, Sampath D, Plunkett W (octubre de 2008). "Análogos de nucleósidos: mecanismos moleculares que indican la muerte celular". Oncogene . 27 (50): 6522–37. doi :10.1038/onc.2008.316. PMID 18955977. S2CID 23817516.
- ^ Galmarini CM, Mackey JR, Dumontet C (julio de 2002). "Análogos de nucleósidos y nucleobases en el tratamiento del cáncer". The Lancet. Oncología . 3 (7): 415–24. doi :10.1016/s1470-2045(02)00788-x. PMID 12142171.
- ^ Menéndez-Arias L (junio de 2008). "Mecanismos de resistencia a inhibidores análogos de nucleósidos de la transcriptasa inversa del VIH-1". Virus Research . 134 (1–2): 124–46. doi :10.1016/j.virusres.2007.12.015. PMID 18272247.
