MT-ATP6
| ATP6 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | ATP6 , ATPasa6, subunidad Fo 6 de la sintetasa MTATP | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 516060; MGI : 99927; HomoloGene : 5012; Tarjetas genéticas : ATP6; OMA :ATP6 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
El MT-ATP6 (o ATP6 ) es un gen mitocondrial con el nombre completo 'subunidad de membrana 6 de la ATP sintasa codificada mitocondrialmente' que codifica la subunidad 6 F o de la ATP sintasa (o subunidad/cadena A) .Esta subunidad pertenece al complejo F o de la gran ATP sintasa transmembrana de tipo F. [5] Esta enzima, que también se conoce como complejo V, es responsable del paso final de la fosforilación oxidativa en la cadena de transporte de electrones . Específicamente, un segmento de la ATP sintasa permite que los iones con carga positiva , llamados protones , fluyan a través de una membrana especializada dentro de las mitocondrias. Otro segmento de la enzima utiliza la energía creada por este flujo de protones para convertir una molécula llamada adenosina difosfato (ADP) en ATP .Se han encontrado mutaciones en el gen MT-ATP6 en aproximadamente el 10 al 20 por ciento de las personas con síndrome de Leigh . [6]
Estructura

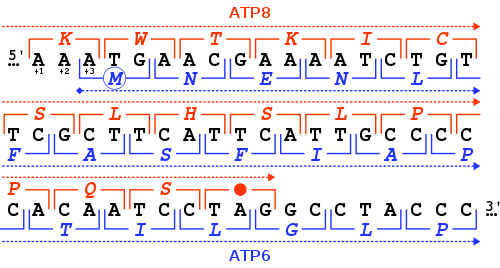
El gen MT-ATP6 proporciona información para la fabricación de una proteína que es esencial para el funcionamiento normal de las mitocondrias. El gen humano MT-ATP6 , ubicado en el ADN mitocondrial , tiene una longitud de 681 pares de bases . [7] Una característica inusual de MT-ATP6 es la superposición de 46 nucleótidos de sus primeros codones con el final del gen MT-ATP8 . Con respecto al marco de lectura MT-ATP6 (+3), el gen MT-ATP8 termina en el marco de lectura +1 con un codón de terminación TAG .
La proteína MT-ATP6 pesa 24,8 kDa y está compuesta por 226 aminoácidos . [8] [9] La proteína es una subunidad de la F 1 F o ATPasa, también conocida como Complejo V , que consta de 14 subunidades codificadas nuclearmente y 2 subunidades codificadas mitocondriales. Como subunidad A, MT-ATP6 está contenida dentro de la porción transmembrana no catalítica F o del complejo. [7]
La nomenclatura de la enzima tiene una larga historia. La fracción F 1 deriva su nombre del término "Fracción 1" y F o (escrito como una letra subíndice "o", no "cero") deriva su nombre de ser la fracción de unión para la oligomicina , un tipo de antibiótico de origen natural que es capaz de inhibir la unidad F o de la ATP sintasa. [10] [11] La región F o de la ATP sintasa es un poro de protones que está incrustado en la membrana mitocondrial. Consiste en tres subunidades principales A, B y C, y (en humanos) seis subunidades adicionales, d , e , f , g , F6 y 8 (o A6L). La estructura 3D del homólogo de E. coli de esta subunidad se modeló con base en datos de microscopía electrónica (cadena M de PDB : 1c17 ). Forma un haz 4-α transmembrana.
Función
Esta subunidad es un componente clave del canal de protones y puede desempeñar un papel directo en la translocación de protones a través de la membrana. La catálisis en el complejo F 1 depende de la rotación del tallo central y del anillo c de F o , que a su vez es impulsada por el flujo de protones a través de la membrana mediante la interfaz entre el anillo c de F0 y la subunidad A. El tallo periférico une la subunidad A con la superficie externa del dominio F 1 y se cree que actúa como un estator para contrarrestar la tendencia de la subunidad A y la porción catalítica alfa 3 beta 3 de F 1 a rotar con el elemento rotatorio central. [12]
Importancia clínica
Las mutaciones en el gen MT-ATP6 y otros genes que afectan la fosforilación oxidativa en las mitocondrias se han asociado con una variedad de trastornos neurodegenerativos y cardiovasculares , incluyendo la deficiencia del complejo mitocondrial V, la neuropatía óptica hereditaria de Leber (LHON), la encefalomiopatía mitocondrial con episodios similares a accidentes cerebrovasculares ( MELAS ), el síndrome de Leigh y el síndrome NARP . La mayoría de las células del cuerpo contienen miles de mitocondrias, cada una con una o más copias de ADN mitocondrial . La gravedad de algunos trastornos mitocondriales está asociada con el porcentaje de mitocondrias en cada célula que tiene un cambio genético particular. Las personas con síndrome de Leigh debido a una mutación del gen MT-ATP6 tienden a tener un porcentaje muy alto de mitocondrias con la mutación (de más del 90 por ciento al 95 por ciento). Las características menos graves de NARP resultan de un menor porcentaje de mitocondrias con la mutación, típicamente del 70 al 90 por ciento. Dado que estas dos afecciones son resultado de los mismos cambios genéticos y pueden presentarse en diferentes miembros de una misma familia, los investigadores creen que pueden representar un espectro de características superpuestas en lugar de dos síndromes distintos. [6]
Deficiencia del complejo mitocondrial V
La deficiencia del complejo V mitocondrial es una escasez (deficiencia) o pérdida de función en el complejo V de la cadena de transporte de electrones que puede causar una amplia variedad de signos y síntomas que afectan a muchos órganos y sistemas del cuerpo, particularmente el sistema nervioso y el corazón . El trastorno puede poner en peligro la vida en la infancia o la niñez temprana. Las personas afectadas pueden tener problemas de alimentación, crecimiento lento, bajo tono muscular ( hipotonía ), fatiga extrema ( letargo ) y retraso en el desarrollo . Tienden a desarrollar niveles elevados de ácido láctico en la sangre ( acidosis láctica ), que puede causar náuseas, vómitos, debilidad y respiración rápida. Los individuos afectados también pueden presentar niveles elevados de amoníaco en la sangre ( hiperamonemia ) y, en algunos casos, dar lugar a una función cerebral anormal ( encefalopatía ) y daño a otros órganos. [13] Se ha observado ataxia , microcefalia , retraso en el desarrollo y discapacidad intelectual en pacientes con una mutación de cambio de marco en MT-ATP6. Esto provoca una inserción de C en la posición 8612 que da como resultado una proteína truncada de solo 36 aminoácidos de longitud, y dos polimorfismos de un solo nucleótido T > C en las posiciones 8610 y 8614 que dan como resultado un tramo de citosina homopolimérico. [14]
Otra característica común de la deficiencia del complejo V mitocondrial es la miocardiopatía hipertrófica . Esta afección se caracteriza por el engrosamiento ( hipertrofia ) del músculo cardíaco que puede provocar insuficiencia cardíaca . [13] La mutación m.8528T>C se produce en la región superpuesta de los genes MT-ATP6 y MT-ATP8 y se ha descrito en múltiples pacientes con miocardiopatía infantil. Esta mutación cambia el codón de iniciación en MT-ATP6 a treonina , así como un cambio de triptófano a arginina en la posición 55 de MT-ATP8 . [15] [16] Los individuos con deficiencia del complejo V mitocondrial también pueden tener un patrón característico de rasgos faciales, que incluyen una frente alta, cejas curvadas, esquinas externas de los ojos que apuntan hacia abajo ( fisuras palpebrales inclinadas hacia abajo ), un puente nasal prominente, orejas de implantación baja, labios finos y un mentón pequeño ( micrognatia ). [13]
Síndrome de Leigh
Se sabe que las variantes patógenas del gen mitocondrial MT-ATP6 causan el síndrome de Leigh asociado al ADNmt , un trastorno cerebral progresivo que suele aparecer en la infancia o la niñez temprana. Los niños afectados pueden experimentar retraso en el desarrollo , debilidad muscular, problemas de movimiento o dificultad para respirar. [6] Otras variantes que se sabe que causan el síndrome de Leigh asociado al ADNmt incluyen MT-TL1 , MT-TK , MT-TW , MT-TV , MT-ND1 , MT -ND2 , MT -ND3 , MT-ND4 , MT-ND5 , MT-ND6 y MT-CO3 . Las anomalías en la generación de energía mitocondrial dan lugar a trastornos neurodegenerativos como el síndrome de Leigh , que se caracteriza por la aparición de síntomas entre los 12 meses y los tres años de edad. Los síntomas se presentan con frecuencia después de una infección viral e incluyen trastornos del movimiento y neuropatía periférica , así como hipotonía , espasticidad y ataxia cerebelosa . Aproximadamente la mitad de los pacientes afectados mueren de insuficiencia respiratoria o cardíaca a la edad de tres años. El síndrome de Leigh es un trastorno heredado de la madre y su diagnóstico se establece a través de pruebas genéticas de los genes mitocondriales antes mencionados, incluido el MT-ATP6. [17] Las mutaciones del gen MT-ATP6 asociadas con el síndrome de Leigh cambian un bloque de construcción de ADN ( nucleótido ) en el gen MT-ATP6. El cambio genético más común reemplaza el nucleótido timina con guanina en la posición 8993 (escrito como T8993G). Las mutaciones que causan el síndrome de Leigh perjudican la función o la estabilidad del complejo ATP sintasa , inhibiendo la producción de ATP y perjudicando la fosforilación oxidativa . Aunque el mecanismo exacto no está claro, los investigadores creen que la fosforilación oxidativa deteriorada puede conducir a la muerte celular debido a la disminución de la energía disponible en la célula. Ciertos tejidos que requieren grandes cantidades de energía, como el cerebro, los músculos y el corazón, parecen especialmente sensibles a las disminuciones de la energía celular. La muerte celular en el cerebro probablemente cause los cambios característicos en el cerebro que se observan en el síndrome de Leigh, que contribuyen a los signos y síntomas de la enfermedad. La muerte celular en otros tejidos sensibles también puede contribuir a las características del síndrome de Leigh .La mutación T→C MT-ATP6 en la posición 9185 da como resultado la sustitución de una leucina altamente conservada por prolina en el codón 220 y una mutación sin sentido heteroplásmica T→C en la posición 9191 convirtió una leucina altamente conservada en una prolina en la posición 222 del polipéptido , lo que conduce a un fenotipo de tipo Leigh . La mutación T9185C resultó en un fenotipo leve y reversible , con el 97% de las muestras de músculo y sangre del paciente reflejando la mutación. La mutación T9191C presentó un fenotipo mucho más grave que resultó en la muerte del paciente a los 2 años de edad. [18]
Síndrome de NARP
Algunas de las mutaciones del gen ATP6 que causan el síndrome de Leigh también son responsables de una afección similar, pero menos grave, llamada neuropatía, ataxia y retinitis pigmentosa (NARP). [19] Se ha identificado una pequeña cantidad de mutaciones en el gen MT-ATP6 en personas con NARP. Cada una de estas mutaciones cambia un nucleótido en el gen MT-ATP6. Al igual que en el síndrome de Leigh, el cambio genético más común asociado con NARP reemplaza el nucleótido timina con guanina en la posición 8993 (escrito como T8993G). Las mutaciones que causan NARP alteran la estructura o función de la ATP sintasa , lo que reduce la capacidad de las mitocondrias para producir ATP. Aunque los efectos precisos de estas mutaciones no están claros, los investigadores continúan investigando cómo los cambios en el gen MT-ATP6 interfieren con la producción de ATP y conducen a debilidad muscular, pérdida de visión y otras características de NARP. [6]
Necrosis estriatal bilateral familiar
Una afección llamada necrosis estriatal bilateral familiar, que es similar al síndrome de Leigh, también puede ser resultado de cambios en el gen MT-ATP6. En los pocos casos informados con estas mutaciones, los niños afectados han tenido retraso en el desarrollo, problemas con el movimiento y la coordinación, tono muscular débil ( hipotonía ) y un tamaño de cabeza inusualmente pequeño ( microcefalia ). Los investigadores no han determinado por qué las mutaciones de MT-ATP6 dan lugar a esta combinación de signos y síntomas en niños con necrosis estriatal bilateral. [6]
Interacciones
Se ha demostrado que MT-ATP6 tiene 20 interacciones binarias proteína-proteína, incluidas 17 interacciones de co-complejos. MT-ATP6 parece interactuar con SP1 . [20]
Investigación
La Fundación de Investigación SENS ha publicado un artículo que detalla la expresión alotópica exitosa del ADN de reemplazo para el gen MT-ATP6 en el ADN nuclear de la célula. [21]
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000198899 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000064357 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG (abril de 1981). "Secuencia y organización del genoma mitocondrial humano". Nature . 290 (5806): 457–65. Bibcode :1981Natur.290..457A. doi :10.1038/290457a0. PMID 7219534. S2CID 4355527.
- ^ abcde "MT-ATP6". Referencia de Genetics Home . NCBI.
- ^ ab "Gen Entrez: ATP sintasa 6 codificada mitocondrialmente MT-ATP6".
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J, Duan H, Uhlen M, Yates JR, Apweiler R, Ge J, Hermjakob H, Ping P (octubre de 2013). "Integración de la biología y la medicina del proteoma cardíaco mediante una base de conocimiento especializada". Circulation Research . 113 (9): 1043–53. doi :10.1161/CIRCRESAHA.113.301151. PMC 4076475 . PMID 23965338.
- ^ "Subunidad A de la sintetasa de ATP, mitocondrial". Base de conocimiento del Atlas de proteínas de organelas cardíacas (COPaKB) .
- ^ Kagawa Y, Racker E (mayo de 1966). "Resolución parcial de las enzimas que catalizan la fosforilación oxidativa. 8. Propiedades de un factor que confiere sensibilidad a la oligomicina en la adenosina trifosfatasa mitocondrial". The Journal of Biological Chemistry . 241 (10): 2461–6. doi : 10.1016/S0021-9258(18)96640-8 . PMID 4223640.
- ^ Mccarty RE (noviembre de 1992). "LA PERSPECTIVA DE UN BIOQUÍMICO VEGETAL SOBRE LAS H+-ATPasas Y LAS ATP SINTASAS". The Journal of Experimental Biology . 172 (Pt 1): 431–441. doi :10.1242/jeb.172.1.431. PMID 9874753.
- ^ Carbajo RJ, Kellas FA, Runswick MJ, Montgomery MG, Walker JE, Neuhaus D (agosto de 2005). "Estructura del dominio de unión a F1 del estator de la F1Fo-ATPasa bovina y cómo se une a una subunidad alfa". Journal of Molecular Biology . 351 (4): 824–38. doi :10.1016/j.jmb.2005.06.012. PMID 16045926.
- ^ abc "Deficiencia del complejo mitocondrial V". Genetics Home Reference . NCBI . Consultado el 3 de agosto de 2018 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Jackson CB, Hahn D, Schröter B, Richter U, Battersby BJ, Schmitt-Mechelke T, Marttinen P, Nuoffer JM, Schaller A (junio de 2017). "Una nueva mutación mitocondrial por desplazamiento del marco de lectura de ATP6 que causa deficiencia aislada del complejo V, ataxia y encefalomiopatía". Revista Europea de Genética Médica . 60 (6): 345–351. doi :10.1016/j.ejmg.2017.04.006. hdl : 10138/237062 . PMID 28412374.
- ^ Imai A, Fujita S, Kishita Y, Kohda M, Tokuzawa Y, Hirata T, Mizuno Y, Harashima H, Nakaya A, Sakata Y, Takeda A, Mori M, Murayama K, Ohtake A, Okazaki Y (marzo de 2016). "Miocardiopatía infantil rápidamente progresiva con deficiencia del complejo V de la cadena respiratoria mitocondrial debido a la pérdida de la proteína ATPasa 6 y 8". Revista Internacional de Cardiología . 207 : 203–5. doi :10.1016/j.ijcard.2016.01.026. PMID 26803244.
- ^ Ware SM, El-Hassan N, Kahler SG, Zhang Q, Ma YW, Miller E, Wong B, Spicer RL, Craigen WJ, Kozel BA, Grange DK, Wong LJ (mayo de 2009). "Miocardiopatía infantil causada por una mutación en la región superpuesta de los genes de la ATPasa mitocondrial 6 y 8". Journal of Medical Genetics . 46 (5): 308–14. doi :10.1136/jmg.2008.063149. PMID 19188198. S2CID 25354118.
- ^ Thorburn DR, Rahman S (1993–2015). "Síndrome de Leigh asociado al ADN mitocondrial y NARP". En Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJ, Bird TD, Dolan CR, Fong CT, Smith RJ, Stephens K (eds.). GeneReviews [Internet] . Seattle (WA): Universidad de Washington, Seattle.
- ^ Moslemi AR, Darin N, Tulinius M, Oldfors A, Holme E (octubre de 2005). "Dos nuevas mutaciones en el gen MTATP6 asociadas con el síndrome de Leigh". Neuropediatría . 36 (5): 314–8. doi :10.1055/s-2005-872845. PMID 16217706.
- ^ Baracca A, Sgarbi G, Mattiazzi M, Casalena G, Pagnotta E, Valentino ML, Moggio M, Lenaz G, Carelli V, Solaini G (julio de 2007). "Fenotipos bioquímicos asociados con las mutaciones del gen mitocondrial ATP6 en nt8993". Biochimica et Biophysica Acta (BBA) - Bioenergética . 1767 (7): 913–9. doi : 10.1016/j.bbabio.2007.05.005 . PMID 17568559.
- ^ "Se encontraron 20 interacciones binarias para el término de búsqueda MT-ATP6". Base de datos de interacciones moleculares IntAct . EMBL-EBI . Consultado el 24 de agosto de 2018 .
- ^ Boominathan A, Vanhoozer S, Basisty N, Powers K, Crampton AL, Wang X, Friedricks N, Schilling B, Brand MD, O'Connor MS (noviembre de 2016). "La expresión nuclear estable de los genes ATP8 y ATP6 rescata un mutante nulo del complejo V del mtADN". Nucleic Acids Research . 44 (19): 9342–9357. doi :10.1093/nar/gkw756. PMC 5100594 . PMID 27596602.
Lectura adicional
- Holme E, Greter J, Jacobson CE, Larsson NG, Lindstedt S, Nilsson KO, Oldfors A, Tulinius M (diciembre de 1992). "Deficiencia de ATP-sintasa mitocondrial en un niño con aciduria 3-metilglutacónica". Pediatric Research . 32 (6): 731–5. doi : 10.1203/00006450-199212000-00022 . PMID 1287564.
- Torroni A, Achilli A, Macaulay V, Richards M, Bandelt HJ (junio de 2006). "Recolectando la fruta del árbol del mtADN humano". Tendencias en genética . 22 (6): 339–45. doi :10.1016/j.tig.2006.04.001. PMID 16678300.
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (diciembre de 2000). "Variación del genoma mitocondrial y el origen de los humanos modernos". Nature . 408 (6813): 708–13. Bibcode :2000Natur.408..708I. doi :10.1038/35047064. PMID 11130070. S2CID 52850476.
- Manfredi G, Fu J, Ojaimi J, Sadlock JE, Kwong JQ, Guy J, Schon EA (abril de 2002). "Rescate de una deficiencia en la síntesis de ATP mediante transferencia de MTATP6, un gen codificado por el ADN mitocondrial, al núcleo". Genética de la Naturaleza . 30 (4): 394–9. doi :10.1038/ng851. PMID 11925565. S2CID 30012532.
- Torigoe T, Izumi H, Ishiguchi H, Uramoto H, Murakami T, Ise T, Yoshida Y, Tanabe M, Nomoto M, Itoh H, Kohno K (septiembre de 2002). "Expresión mejorada del gen de la subunidad c de la H+-ATPasa vacuolar humana (ATP6L) en respuesta a agentes anticancerígenos". The Journal of Biological Chemistry . 277 (39): 36534–43. doi : 10.1074/jbc.M202605200 . PMID 12133827.
- Mishmar D, Ruiz-Pesini E, Golik P, Macaulay V, Clark AG, Hosseini S, Brandon M, Easley K, Chen E, Brown MD, Sukernik RI, Olckers A, Wallace DC (enero de 2003). "La selección natural moldeó la variación regional del mtADN en humanos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (1): 171–6. Bibcode :2003PNAS..100..171M. doi : 10.1073/pnas.0136972100 . PMC 140917 . PMID 12509511.
- Ingman M, Gyllensten U (julio de 2003). "Variación del genoma mitocondrial e historia evolutiva de los aborígenes australianos y de Nueva Guinea". Genome Research . 13 (7): 1600–6. doi :10.1101/gr.686603. PMC 403733 . PMID 12840039.
- Kong QP, Yao YG, Sun C, Bandelt HJ, Zhu CL, Zhang YP (septiembre de 2003). "Filogenia de linajes de ADN mitocondrial del este de Asia inferida a partir de secuencias completas". American Journal of Human Genetics . 73 (3): 671–6. doi :10.1086/377718. PMC 1180693 . PMID 12870132.
- Temperley RJ, Seneca SH, Tonska K, Bartnik E, Bindoff LA, Lightowlers RN, Chrzanowska-Lightowlers ZM (septiembre de 2003). "La investigación de una microdeleción patógena de ADNmt revela una vía de desintegración por deadenilación dependiente de la traducción en mitocondrias humanas". Human Molecular Genetics . 12 (18): 2341–8. doi : 10.1093/hmg/ddg238 . PMID 12915481.
- Reuter TY, Medhurst AL, Waisfisz Q, Zhi Y, Herterich S, Hoehn H, Gross HJ, Joenje H, Hoatlin ME, Mathew CG, Huber PA (octubre de 2003). "Las pruebas de doble híbrido en levadura implican la participación de las proteínas de anemia de Fanconi en la regulación de la transcripción, la señalización celular, el metabolismo oxidativo y el transporte celular". Experimental Cell Research . 289 (2): 211–21. doi :10.1016/S0014-4827(03)00261-1. PMID 14499622.
- Dubot A, Godinot C, Dumur V, Sablonnière B, Stojkovic T, Cuisset JM, Vojtiskova A, Pecina P, Jesina P, Houstek J (enero de 2004). "GUG es un codón de iniciación eficaz para traducir el gen ATP6 mitocondrial humano". Comunicaciones de investigación bioquímica y biofísica . 313 (3): 687–93. doi :10.1016/j.bbrc.2003.12.013. PMID 14697245.
- Coble MD, Just RS, O'Callaghan JE, Letmanyi IH, Peterson CT, Irwin JA, Parsons TJ (junio de 2004). "Polimorfismos de un solo nucleótido en todo el genoma del ADNmt que aumentan el poder de las pruebas forenses en caucásicos". Revista Internacional de Medicina Legal . 118 (3): 137–46. doi :10.1007/s00414-004-0427-6. PMID 14760490. S2CID 8413730.
- Carrozzo R, Rizza T, Stringaro A, Pierini R, Mormone E, Santorelli FM, Malorni W, Matarrese P (julio de 2004). "Las mutaciones relacionadas con el síndrome de Leigh heredadas por vía materna refuerzan la apoptosis mediada por mitocondrias". Journal of Neurochemistry . 90 (2): 490–501. doi : 10.1111/j.1471-4159.2004.02505.x . PMID 15228605. S2CID 33013529.
Enlaces externos
- Entrada en GeneReviews/NCBI/NIH/UW sobre el síndrome de Leigh asociado al ADN mitocondrial y NARP
- Proteína MT-ATP6+,+humana en los Encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .


