Modelo de agua

En química computacional , un modelo de agua se utiliza para simular y calcular termodinámicamente cúmulos de agua , agua líquida y soluciones acuosas con disolvente explícito. Los modelos se determinan a partir de la mecánica cuántica , la mecánica molecular , los resultados experimentales y estas combinaciones. Para imitar una naturaleza específica de las moléculas, se han desarrollado muchos tipos de modelos. En general, estos se pueden clasificar por los siguientes tres puntos; (i) el número de puntos de interacción llamados sitio , (ii) si el modelo es rígido o flexible, (iii) si el modelo incluye efectos de polarización .
Una alternativa a los modelos explícitos de agua es utilizar un modelo de solvatación implícito , también denominado modelo continuo, un ejemplo del cual sería el modelo de solvatación COSMO o el modelo continuo polarizable (PCM) o un modelo de solvatación híbrido. [1]
Modelos de agua simples
Los modelos rígidos se consideran los modelos de agua más simples y se basan en interacciones no enlazantes . En estos modelos, las interacciones enlazantes se tratan implícitamente mediante restricciones holonómicas . La interacción electrostática se modela utilizando la ley de Coulomb y las fuerzas de dispersión y repulsión utilizando el potencial de Lennard-Jones . [2] [3] El potencial para modelos como TIP3P (potencial intermolecular transferible con 3 puntos) y TIP4P está representado por
donde k C , la constante electrostática , tiene un valor de 332,1 Å·kcal/(mol· e ²) en las unidades comúnmente utilizadas en el modelado molecular [ cita requerida ] ; [4] [5] [6] q i y q j son las cargas parciales relativas a la carga del electrón; r ij es la distancia entre dos átomos o sitios cargados; y A y B son los parámetros de Lennard-Jones . Los sitios cargados pueden estar en los átomos o en sitios ficticios (como pares solitarios). En la mayoría de los modelos de agua, el término de Lennard-Jones se aplica solo a la interacción entre los átomos de oxígeno.
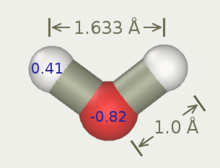
La figura siguiente muestra la forma general de los modelos de agua de 3 a 6 sitios. Los parámetros geométricos exactos (la distancia OH y el ángulo HOH) varían según el modelo.
2 sitios
Se ha demostrado que un modelo de agua de dos sitios basado en el conocido modelo SPC de tres sitios (ver a continuación) predice las propiedades dieléctricas del agua utilizando la teoría de fluidos moleculares renormalizados por sitio. [7]
3 sitios
Los modelos de tres sitios tienen tres puntos de interacción correspondientes a los tres átomos de la molécula de agua. Cada sitio tiene una carga puntual y el sitio correspondiente al átomo de oxígeno también tiene los parámetros de Lennard-Jones. Dado que los modelos de tres sitios logran una alta eficiencia computacional, se utilizan ampliamente para muchas aplicaciones de simulaciones de dinámica molecular . La mayoría de los modelos utilizan una geometría rígida que coincide con la de las moléculas de agua reales. Una excepción es el modelo SPC, que asume una forma tetraédrica ideal (ángulo HOH de 109,47°) en lugar del ángulo observado de 104,5°.
La siguiente tabla enumera los parámetros para algunos modelos de 3 sitios.
| CONSEJOS [8] | CEP [9] | CONSEJO 3P [10] | CEP/E [11] | |
|---|---|---|---|---|
| r (OH), Å | 0,9572 | 1.0 | 0,9572 | 1.0 |
| HOH, grados | 104,52 | 109,47 | 104,52 | 109,47 |
| A , 10 3 kcal Å 12 /mol | 580.0 | 629.4 | 582.0 | 629.4 |
| B , kcal Å6 / mol | 525.0 | 625,5 | 595.0 | 625,5 |
| q (O) | -0,80 | -0,82 | -0,834 | -0,8476 |
| q (H) | +0,40 | +0,41 | +0,417 | +0,4238 |
El modelo SPC/E agrega una corrección de polarización promedio a la función de energía potencial:
donde μ es el momento dipolar eléctrico de la molécula de agua efectivamente polarizada (2,35 D para el modelo SPC/E), μ 0 es el momento dipolar de una molécula de agua aislada (1,85 D del experimento) y α i es una constante de polarizabilidad isótropa , con un valor de1,608 × 10 −40 F ·m 2 . Dado que las cargas en el modelo son constantes, esta corrección solo da como resultado agregar 1,25 kcal/mol (5,22 kJ/mol) a la energía total. El modelo SPC/E da como resultado una densidad y una constante de difusión mejores que el modelo SPC.
El modelo TIP3P implementado en el campo de fuerza CHARMM es una versión ligeramente modificada del original. La diferencia radica en los parámetros de Lennard-Jones: a diferencia de TIP3P, la versión CHARMM del modelo coloca parámetros de Lennard-Jones también en los átomos de hidrógeno, además del de oxígeno. Las cargas no se modifican. [12] El modelo de tres sitios (TIP3P) tiene un mejor rendimiento en el cálculo de calores específicos. [13]
Modelo de agua SPC flexible
El modelo de agua de carga puntual simple flexible (o modelo de agua SPC flexible) es una re-parametrización del modelo de agua SPC de tres sitios. [14] [15] El modelo SPC es rígido, mientras que el modelo SPC flexible es flexible. En el modelo de Toukan y Rahman, el estiramiento O–H se hace anarmónico y, por lo tanto, el comportamiento dinámico está bien descrito. Este es uno de los modelos de agua de tres centros más precisos sin tener en cuenta la polarización . En simulaciones de dinámica molecular , proporciona la densidad y la permitividad dieléctrica correctas del agua. [16]
El SPC flexible está implementado en los programas MDynaMix y Abalone .
Otros modelos
- Ferguson (SPC flexible) [17]
- CVFF (flexible)
- MG (flexible y disociativo) [18]
- Potencial KKY (modelo flexible). [19]
- BLXL (potencial cargado de frotis). [20]
4 sitios
Los modelos de cuatro sitios tienen cuatro puntos de interacción añadiendo un átomo ficticio cerca del oxígeno a lo largo de la bisectriz del ángulo HOH de los modelos de tres sitios (etiquetado M en la figura). El átomo ficticio solo tiene una carga negativa. Este modelo mejora la distribución electrostática alrededor de la molécula de agua. El primer modelo que utilizó este enfoque fue el modelo de Bernal-Fowler publicado en 1933, [21] que también puede ser el modelo de agua más antiguo. Sin embargo, el modelo BF no reproduce bien las propiedades en masa del agua, como la densidad y el calor de vaporización , y por lo tanto solo tiene interés histórico. Esto es una consecuencia del método de parametrización; los modelos más nuevos, desarrollados después de que las computadoras modernas estuvieran disponibles, se parametrizaron ejecutando simulaciones de dinámica molecular o de Monte Carlo de Metropolis y ajustando los parámetros hasta que las propiedades en masa se reprodujeran lo suficientemente bien.
El modelo TIP4P, publicado por primera vez en 1983, se implementa ampliamente en paquetes de software de química computacional y se utiliza a menudo para la simulación de sistemas biomoleculares. Ha habido reparametrizaciones posteriores del modelo TIP4P para usos específicos: el modelo TIP4P-Ew, para su uso con métodos de suma de Ewald; el TIP4P/Ice, para la simulación de hielo de agua sólida; TIP4P/2005, una parametrización general para simular todo el diagrama de fases del agua condensada; y TIP4PQ/2005, un modelo similar pero diseñado para describir con precisión las propiedades del agua sólida y líquida cuando se incluyen efectos cuánticos en la simulación. [22]
La mayoría de los modelos de agua de cuatro sitios utilizan una distancia OH y un ángulo HOH que coinciden con los de la molécula de agua libre. Una excepción es el modelo OPC, en el que no se imponen restricciones geométricas aparte de la simetría molecular fundamental C 2v de la molécula de agua. En cambio, las cargas puntuales y sus posiciones se optimizan para describir mejor la electrostática de la molécula de agua. OPC reproduce un conjunto completo de propiedades en masa con mayor precisión que varios de los modelos de agua rígidos de n sitios comúnmente utilizados. El modelo OPC se implementa dentro del campo de fuerza AMBER .
| BF [21] | CONSEJOS2 [23] | CONSEJO4P [10] | Consejo 4P-Ew [24] | TIP4P/Hielo [25] | TIP4P/2005 [26] | OPC [27] | Consejo 4P-D [28] | |
|---|---|---|---|---|---|---|---|---|
| r (OH), Å | 0,96 | 0,9572 | 0,9572 | 0,9572 | 0,9572 | 0,9572 | 0,8724 | 0,9572 |
| HOH, grados | 105.7 | 104,52 | 104,52 | 104,52 | 104,52 | 104,52 | 103.6 | 104,52 |
| r (OM), Å | 0,15 | 0,15 | 0,15 | 0,125 | 0,1577 | 0,1546 | 0,1594 | 0,1546 |
| A , 10 3 kcal Å 12 /mol | 560.4 | 695.0 | 600.0 | 656.1 | 857,9 | 731.3 | 865.1 | 904.7 |
| B , kcal Å6 / mol | 837.0 | 600.0 | 610.0 | 653,5 | 850.5 | 736.0 | 858.1 | 900.0 |
| q (M) | -0,98 | -1,07 | -1,04 | -1.04844 | -1,1794 | -1,1128 | -1,3582 | -1,16 |
| q (H) | +0,49 | +0,535 | +0,52 | +0,52422 | +0,5897 | +0,5564 | +0,6791 | +0,58 |
Otros:
- q-TIP4P/F (flexible) [29]
- TIP4P/2005f (flexible) [30]
5 sitios
Los modelos de 5 sitios colocan la carga negativa en átomos ficticios (etiquetados como L ) que representan los pares solitarios del átomo de oxígeno, con una geometría similar a la tetraédrica. Un modelo temprano de estos tipos fue el modelo BNS de Ben-Naim y Stillinger, propuesto en 1971, [ cita requerida ] pronto reemplazado por el modelo ST2 de Stillinger y Rahman en 1974. [31] Principalmente debido a su mayor costo computacional, los modelos de cinco sitios no se desarrollaron mucho hasta 2000, cuando se publicó el modelo TIP5P de Mahoney y Jorgensen. [32] Cuando se compara con modelos anteriores, el modelo TIP5P da como resultado mejoras en la geometría para el dímero de agua , una estructura de agua más "tetraédrica" que reproduce mejor las funciones de distribución radial experimentales de la difracción de neutrones y la temperatura de densidad máxima del agua. El modelo TIP5P-E es una reparametrización de TIP5P para su uso con sumas de Ewald .
| BNS [31] | ST2 [31] | CONSEJO 5P [32] | Punta 5P-E [33] | |
|---|---|---|---|---|
| r (OH), Å | 1.0 | 1.0 | 0,9572 | 0,9572 |
| HOH, grados | 109,47 | 109,47 | 104,52 | 104,52 |
| r (OL), Å | 1.0 | 0,8 | 0,70 | 0,70 |
| Jaja, deg | 109,47 | 109,47 | 109,47 | 109,47 |
| A , 10 3 kcal Å 12 /mol | 77.4 | 238,7 | 544,5 | 554.3 |
| B , kcal Å6 / mol | 153,8 | 268,9 | 590.3 | 628.2 |
| q (L) | -0,19562 | -0,2357 | -0,241 | -0,241 |
| q (H) | +0,19562 | +0,2357 | +0,241 | +0,241 |
| R L , Å | 2.0379 | 2.0160 | ||
| R U , Å | 3.1877 | 3.1287 |
Sin embargo, hay que tener en cuenta que los modelos BNS y ST2 no utilizan la ley de Coulomb directamente para los términos electrostáticos, sino una versión modificada que se reduce a distancias cortas al multiplicarla por la función de conmutación S ( r ):
Por lo tanto, los parámetros R L y R U solo se aplican a BNS y ST2.
6 sitios
Originalmente diseñado para estudiar sistemas de agua/hielo, Nada y van der Eerden desarrollaron un modelo de 6 sitios que combina todos los sitios de los modelos de 4 y 5 sitios. [34] Dado que tenía una temperatura de fusión muy alta [35] cuando se empleaba en condiciones electrostáticas periódicas (suma de Ewald), más tarde se publicó una versión modificada [36] optimizada mediante el uso del método de Ewald para estimar la interacción de Coulomb.
Otro
- También se ha estudiado ampliamente el efecto del modelo explícito de solutos sobre el comportamiento de los solutos en simulaciones biomoleculares. Se demostró que los modelos explícitos de agua afectaron la solvatación específica y la dinámica de los péptidos desplegados, mientras que el comportamiento conformacional y la flexibilidad de los péptidos plegados permanecieron intactos. [37]
- Modelo MB. Modelo más abstracto que se asemeja al logotipo de Mercedes-Benz y que reproduce algunas características del agua en sistemas bidimensionales. No se utiliza como tal para simulaciones de sistemas "reales" (es decir, tridimensionales), pero es útil para estudios cualitativos y con fines educativos. [38]
- Modelos de grano grueso. También se han desarrollado modelos de agua de uno y dos sitios. [39] En los modelos de grano grueso, cada sitio puede representar varias moléculas de agua.
- Modelos de muchos cuerpos. Modelos de agua creados a partir de configuraciones de conjuntos de entrenamiento resueltas de manera cuántica, que luego utilizan protocolos de aprendizaje automático para extraer superficies de energía potencial. Estas superficies de energía potencial se incorporan a simulaciones de múltiples cuerpos para lograr un grado de precisión sin precedentes en el cálculo de las propiedades físicas de los sistemas de fase condensada. [40]
- Otra clasificación de muchos modelos corporales [41] se basa en la expansión de la electrostática subyacente, por ejemplo, el modelo SCME (Expansión Multipolar de Centro Único) [42].
Costo computacional
El costo computacional de una simulación de agua aumenta con el número de sitios de interacción en el modelo de agua. El tiempo de CPU es aproximadamente proporcional al número de distancias interatómicas que se deben calcular. Para el modelo de 3 sitios, se requieren 9 distancias para cada par de moléculas de agua (cada átomo de una molécula contra cada átomo de la otra molécula, o 3 × 3). Para el modelo de 4 sitios, se requieren 10 distancias (cada sitio cargado con cada sitio cargado, más la interacción O–O, o 3 × 3 + 1). Para el modelo de 5 sitios, se requieren 17 distancias (4 × 4 + 1). Finalmente, para el modelo de 6 sitios, se requieren 26 distancias (5 × 5 + 1).
Al utilizar modelos de agua rígidos en dinámica molecular, existe un costo adicional asociado con mantener la estructura restringida, utilizando algoritmos de restricción (aunque con longitudes de enlace restringidas, a menudo es posible aumentar el paso de tiempo).
Véase también
- Agua (propiedades)
- Agua (página de datos)
- Dímero de agua
- Campo de fuerza (química)
- Comparación de implementaciones de campos de fuerza
- Mecánica molecular
- Modelado molecular
- Comparación de software para modelado de mecánica molecular
- Modelos de disolventes
Referencias
- ^ Skyner RE, McDonagh JL, Groom CR, van Mourik T, Mitchell JB (marzo de 2015). "Una revisión de los métodos para el cálculo de energías libres de solución y el modelado de sistemas en solución" (PDF) . Química física Química Física . 17 (9): 6174–91. Bibcode :2015PCCP...17.6174S. doi : 10.1039/C5CP00288E . PMID 25660403.
- ^ Allen MP, Tildesley DJ (1989). Simulación por computadora de líquidos . Clarendon Press. ISBN 978-0-19-855645-9.
- ^ Kirby BJ. Mecánica de fluidos a micro y nanoescala: transporte en dispositivos microfluídicos.
- ^ Swails JM, Roitberg AE (2013). "archivo prmtop de {A}mber" (PDF) .
- ^ Swails JM (2013). Simulaciones de energía libre de sistemas biológicos complejos a pH constante (PDF) . Universidad de Florida.
- ^ Caso DA, Walker RC, Cheatham III TE, Simmerling CL, Roitberg A, Merz KM y col. (Abril de 2019). "Manual de referencia de Amber 2019 (cubre Amber18 y AmberTools19)" (PDF) .
- ^ Dyer KM, Perkyns JS, Stell G, Pettitt BM (2009). "Teoría de fluidos moleculares renormalizados por sitio: sobre la utilidad de un modelo de agua de dos sitios". Física molecular . 107 (4–6): 423–431. Código Bibliográfico :2009MolPh.107..423D. doi :10.1080/00268970902845313. PMC 2777734 . PMID 19920881.
- ^ Jorgensen, William L. (1981). "Estudios mecánicos cuánticos y estadísticos de líquidos. 10. Funciones de potencial intermolecular transferibles para agua, alcoholes y éteres. Aplicación al agua líquida". Revista de la Sociedad Química Americana . 103 (2). Sociedad Química Americana (ACS): 335–340. doi :10.1021/ja00392a016. ISSN 0002-7863.
- ^ HJC Berendsen, JPM Postma, WF van Gunsteren y J. Hermans, In Intermolecular Forces , editado por B. Pullman (Reidel, Dordrecht, 1981 ), pág. 331.
- ^ ab Jorgensen WL, Chandrasekhar J, Madura JD, Impey RW, Klein ML (1983). "Comparación de funciones potenciales simples para simular agua líquida". The Journal of Chemical Physics . 79 (2): 926–935. Código Bibliográfico :1983JChPh..79..926J. doi :10.1063/1.445869.
- ^ Berendsen HJ , Grigera JR, Straatsma TP (1987). "El término que falta en potenciales de pares efectivos". La Revista de Química Física . 91 (24): 6269–6271. doi :10.1021/j100308a038.
- ^ MacKerell AD, Bashford D, Bellott M, Dunbrack RL, Evanseck JD, Field MJ, et al. (abril de 1998). "Potencial empírico de todos los átomos para el modelado molecular y los estudios de dinámica de proteínas". The Journal of Physical Chemistry B. 102 ( 18): 3586–616. doi :10.1021/jp973084f. PMID 24889800.
- ^ Mao Y, Zhang Y (2012). "Conductividad térmica, viscosidad de corte y calor específico de modelos de agua rígida". Chemical Physics Letters . 542 : 37–41. Bibcode :2012CPL...542...37M. doi :10.1016/j.cplett.2012.05.044.
- ^ Toukan K, Rahman A (marzo de 1985). "Estudio de dinámica molecular de los movimientos atómicos en el agua". Physical Review B . 31 (5): 2643–2648. Bibcode :1985PhRvB..31.2643T. doi :10.1103/PhysRevB.31.2643. PMID 9936106.
- ^ Berendsen HJ, Grigera JR, Straatsma TP (1987). "El término que falta en potenciales de pares efectivos". Revista de Química Física . 91 (24): 6269–6271. doi :10.1021/j100308a038.
- ^ Praprotnik M, Janezic D, Mavri J (2004). "Dependencia de la temperatura del espectro vibracional del agua: un estudio de simulación de dinámica molecular". Journal of Physical Chemistry A . 108 (50): 11056–11062. Código Bibliográfico :2004JPCA..10811056P. doi :10.1021/jp046158d.
- ^ Ferguson, David M. (abril de 1995). "Parametrización y evaluación de un modelo de agua flexible". Journal of Computational Chemistry . 16 (4): 501–511. doi :10.1002/jcc.540160413. S2CID 206038409 . Consultado el 28 de julio de 2021 .
- ^ Modelo MG Archivado el 4 de marzo de 2016 en Wayback Machine .
- ^ Kumagai N, Kawamura K, Yokokawa T (1994). "Un modelo de potencial interatómico para H2O: aplicaciones a polimorfos de agua y hielo". Molecular Simulation . 12 (3–6). Informa UK Limited: 177–186. doi :10.1080/08927029408023028. ISSN 0892-7022.
- ^ Burnham CJ, Li J, Xantheas SS, Leslie M (1999). "La parametrización de un modelo de agua polarizable de todos los átomos de tipo Thole a partir de los primeros principios y su aplicación al estudio de los cúmulos de agua (n = 2-21) y el espectro de fonones del hielo Ih". The Journal of Chemical Physics . 110 (9): 4566–4581. Código Bibliográfico :1999JChPh.110.4566B. doi :10.1063/1.478797.
- ^ ab Bernal JD, Fowler RH (1933). "Una teoría del agua y la solución iónica, con especial referencia a los iones hidrógeno e hidroxilo". The Journal of Chemical Physics . 1 (8): 515. Bibcode :1933JChPh...1..515B. doi :10.1063/1.1749327.
- ^ McBride, C.; Vega, C.; Noya, EG; Ramirez, R.; Sese', LM (2009). "Contribuciones cuánticas en las fases del hielo: el camino hacia un nuevo modelo empírico para el agua—TIP4PQ/2005". J. Chem. Phys . 131 (2): 024506. arXiv : 0906.3967 . Bibcode :2009JChPh.131b4506M. doi :10.1063/1.3175694. PMID 19604003. S2CID 15505037.
- ^ Jorgensen (1982). "TIPS revisados para simulaciones de agua líquida y soluciones acuosas". The Journal of Chemical Physics . 77 (8): 4156–4163. Bibcode :1982JChPh..77.4156J. doi : 10.1063/1.444325 .
- ^ Horn HW, Swope WC, Pitera JW, Madura JD, Dick TJ, Hura GL, Head-Gordon T (mayo de 2004). "Desarrollo de un modelo de agua de cuatro sitios mejorado para simulaciones biomoleculares: TIP4P-Ew". The Journal of Chemical Physics . 120 (20): 9665–78. Bibcode :2004JChPh.120.9665H. doi :10.1063/1.1683075. PMID 15267980. S2CID 39545298.
- ^ Abascal JL, Sanz E, García Fernández R, Vega C (junio de 2005). "Un modelo potencial para el estudio de hielos y agua amorfa: TIP4P/Ice". The Journal of Chemical Physics . 122 (23): 234511. Bibcode :2005JChPh.122w4511A. doi :10.1063/1.1931662. PMID 16008466. S2CID 8382245.
- ^ Abascal JL, Vega C (diciembre de 2005). "Un modelo de propósito general para las fases condensadas del agua: TIP4P/2005". The Journal of Chemical Physics . 123 (23): 234505. Bibcode :2005JChPh.123w4505A. doi :10.1063/1.2121687. PMID 16392929. S2CID 9757894.
- ^ Izadi S, Anandakrishnan R, Onufriev AV (noviembre de 2014). "Construcción de modelos de agua: un enfoque diferente". The Journal of Physical Chemistry Letters . 5 (21): 3863–3871. arXiv : 1408.1679 . Bibcode :2014arXiv1408.1679I. doi :10.1021/jz501780a. PMC 4226301 . PMID 25400877.
- ^ Piana S, Donchev AG, Robustelli P, Shaw DE (abril de 2015). "Las interacciones de dispersión de agua influyen fuertemente en las propiedades estructurales simuladas de estados proteicos desordenados". The Journal of Physical Chemistry B . 119 (16): 5113–23. doi : 10.1021/jp508971m . PMID 25764013.
- ^ Habershon, S.; Markland, TE; Manolopoulos, DE (2009). "Efectos cuánticos en competencia en la dinámica de un modelo de agua flexible". J. Chem. Phys . 131 (2): 024501. arXiv : 1011.1047 . Bibcode :2009JChPh.131b4501H. doi :10.1063/1.3167790. PMID 19603998. S2CID 9095938.
- ^ Gonzalez, MA; Abascal, JJF (2011). "Un modelo flexible para el agua basado en TIP4P/2005". J. Chem. Phys . 135 (22): 224516. Bibcode :2011JChPh.135v4516G. doi :10.1063/1.3663219. PMID 22168712.
- ^ abc Stillinger FH, Rahman A (1974). "Simulación mejorada de agua líquida mediante dinámica molecular". The Journal of Chemical Physics . 60 (4): 1545–1557. Bibcode :1974JChPh..60.1545S. doi :10.1063/1.1681229. S2CID 96035805.
- ^ ab Mahoney MW, Jorgensen WL (2000). "Un modelo de cinco sitios para agua líquida y la reproducción de la anomalía de densidad mediante funciones de potencial rígidas y no polarizables". The Journal of Chemical Physics . 112 (20): 8910–8922. Bibcode :2000JChPh.112.8910M. doi :10.1063/1.481505. S2CID 16367148.
- ^ Rick SW (abril de 2004). "Una reoptimización del potencial hídrico de cinco sitios (TIP5P) para su uso con sumas de Ewald". The Journal of Chemical Physics . 120 (13): 6085–93. Bibcode :2004JChPh.120.6085R. doi :10.1063/1.1652434. PMID 15267492.
- ^ Nada, H. (2003). "Un modelo de potencial intermolecular para la simulación de hielo y agua cerca del punto de fusión: un modelo de seis sitios de H 2 O". The Journal of Chemical Physics . 118 (16): 7401. Bibcode :2003JChPh.118.7401N. doi :10.1063/1.1562610.
- ^ Abascal JL, Fernández RG, Vega C, Carignano MA (octubre de 2006). "La temperatura de fusión del modelo de potencial de seis sitios del agua". The Journal of Chemical Physics . 125 (16): 166101. Bibcode :2006JChPh.125p6101A. doi :10.1063/1.2360276. PMID 17092145. S2CID 33883071.
- ^ Nada H (diciembre de 2016). "2O y una simulación de dinámica molecular". The Journal of Chemical Physics . 145 (24): 244706. Bibcode :2016JChPh.145x4706N. doi :10.1063/1.4973000. PMID 28049310.
- ^ Florová P, Sklenovský P, Banáš P, Otyepka M (noviembre de 2010). "Los modelos explícitos de agua afectan la solvatación específica y la dinámica de los péptidos desplegados mientras que el comportamiento conformacional y la flexibilidad de los péptidos plegados permanecen intactos". Journal of Chemical Theory and Computation . 6 (11): 3569–79. doi : 10.1021/ct1003687 . PMID 26617103.
- ^ Silverstein KA, Haymet AD, Dill KA (1998). "Un modelo simple del agua y el efecto hidrofóbico". Revista de la Sociedad Química Americana . 120 (13): 3166–3175. doi :10.1021/ja973029k.
- ^ Izvekov S, Voth GA (octubre de 2005). "Granulado grueso multiescala de sistemas en estado líquido". The Journal of Chemical Physics . 123 (13). AIP Publishing: 134105. Bibcode :2005JChPh.123m4105I. doi :10.1063/1.2038787. PMID 16223273.
- ^ Medders GR, Paesani F (marzo de 2015). "Espectroscopia infrarroja y Raman de agua líquida a través de la dinámica molecular de muchos cuerpos de "primeros principios". Revista de teoría y computación química . 11 (3): 1145–54. doi :10.1021/ct501131j. PMID 26579763.
- ^ Cisneros GA, Wikfeldt KT, Ojamäe L, Lu J, Xu Y, Torabifard H, et al. (Julio de 2016). "Modelado de interacciones moleculares en el agua: de funciones de energía potencial de pares a de muchos cuerpos". Reseñas químicas . 116 (13): 7501–28. doi : 10.1021/acs.chemrev.5b00644. PMC 5450669 . PMID 27186804.
- ^ Wikfeldt KT, Batista ER, Vila FD, Jónsson H (octubre de 2013). "Un potencial de interacción H2O transferible basado en una expansión multipolar de un solo centro: SCME". Química física Química Física . 15 (39): 16542–56. arXiv : 1306.0327 . Bibcode :2013PCCP...1516542W. doi :10.1039/c3cp52097h. PMID 23949215. S2CID 15215071.



