Biogénesis mitocondrial
La biogénesis mitocondrial es el proceso por el cual las células aumentan el número de mitocondrias . [1] [2] Fue descrita por primera vez por John Holloszy en la década de 1960, cuando se descubrió que el entrenamiento de resistencia física inducía niveles más altos de contenido mitocondrial, lo que conducía a una mayor captación de glucosa por los músculos. [3] La biogénesis mitocondrial se activa por numerosas señales diferentes durante períodos de estrés celular o en respuesta a estímulos ambientales, como el ejercicio aeróbico . [1] [2] [4]
Fondo
La capacidad de una mitocondria para autorreplicarse tiene sus raíces en su historia evolutiva. Se cree comúnmente que las mitocondrias descienden de células que formaron relaciones endosimbióticas con α-protobacterias ; tienen su propio genoma para la replicación. [5] Sin embargo, evidencia reciente sugiere que las mitocondrias pueden haber evolucionado sin simbiosis. [6] La mitocondria es un regulador clave de la actividad metabólica de la célula, y también es un orgánulo importante tanto en la producción como en la degradación de radicales libres. [7] Se postula que un mayor número de copias mitocondriales (o una mayor masa mitocondrial) es protector para la célula.
Las mitocondrias se producen a partir de la transcripción y traducción de genes tanto en el genoma nuclear como en el genoma mitocondrial . La mayoría de las proteínas mitocondriales provienen del genoma nuclear, mientras que el genoma mitocondrial codifica partes de la cadena de transporte de electrones junto con el ARNr y el ARNt mitocondriales . La biogénesis mitocondrial aumenta las enzimas metabólicas para la glucólisis, la fosforilación oxidativa y, en última instancia, una mayor capacidad metabólica mitocondrial. Sin embargo, dependiendo de los sustratos energéticos disponibles y del estado redox de la célula, la célula puede aumentar o disminuir el número y el tamaño de las mitocondrias. [8] De manera crítica, el número y la morfología de las mitocondrias varían según el tipo de célula y la demanda específica del contexto, por lo que el equilibrio entre la fusión/fisión mitocondrial regula la distribución, la morfología y la función mitocondriales. [9] [8]
Importación de proteínas
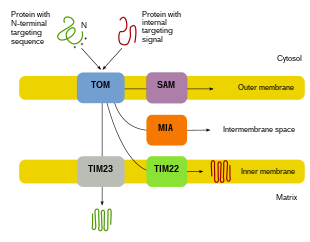
Dado que la mayoría de las proteínas mitocondriales provienen del genoma nuclear, las proteínas necesitan ser dirigidas y transportadas adecuadamente a las mitocondrias para realizar sus funciones. [8] [10] [11] Primero, el ARNm se traduce en el citosol de la célula. [10] [11] Las proteínas precursoras desplegadas resultantes podrán entonces alcanzar sus respectivos compartimentos mitocondriales. [11] [10] Las proteínas precursoras serán transportadas a una de cuatro áreas de las mitocondrias, que incluyen la membrana externa, la membrana interna, el espacio intermembrana y la matriz. [10] [11] Todas las proteínas ingresarán a las mitocondrias por una translocasa en la membrana mitocondrial externa (MTO). [11] [10] [5] Algunas proteínas tendrán una señal de direccionamiento N-terminal, y estas proteínas serán detectadas y transportadas a la matriz, donde luego serán escindidas y plegadas. [12] [11] [10] Otras proteínas pueden tener información de orientación en sus secuencias y no incluirán una señal N-terminal. [11] [10] Durante las últimas dos décadas, los investigadores han descubierto más de treinta proteínas que participan en la importación de proteínas mitocondriales. [11] A medida que los investigadores aprenden más sobre estas proteínas y cómo llegan a los respectivos compartimentos mitocondriales que las utilizan, se hace evidente que hay una multitud de procesos que trabajan juntos en la célula para permitir la biogénesis mitocondrial. [11] [8]
Fusión y fisión
Las mitocondrias son muy versátiles y pueden cambiar su forma a través de eventos de fisión y fusión. [9] [8] En definitiva, la fisión es el evento en el que una sola entidad se rompe, mientras que la fusión es el evento en el que dos o más entidades se unen para formar un todo. [8] Los procesos de fisión y fusión se oponen entre sí y permiten que la red mitocondrial se remodele constantemente. [9] [8] Si un estímulo induce un cambio en el equilibrio de fisión y fusión en una célula, podría alterar significativamente la red mitocondrial. [9] [13] Por ejemplo, un aumento en la fisión mitocondrial crearía muchas mitocondrias fragmentadas, lo que se ha demostrado que es útil para eliminar mitocondrias dañadas y para crear mitocondrias más pequeñas para un transporte eficiente a áreas que demandan energía. [13] [14] Por lo tanto, lograr un equilibrio entre estos mecanismos permite que una célula tenga la organización adecuada de su red mitocondrial durante la biogénesis y puede tener un papel importante en la adaptación muscular al estrés fisiológico. [13]
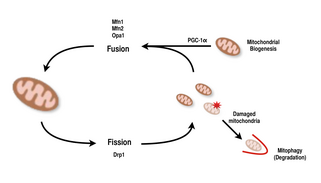
En los mamíferos, la fusión y fisión mitocondrial están controladas por GTPasas de la familia de las dinaminas . [8] [13] El proceso de fisión mitocondrial está dirigido por Drp1 , un miembro de la familia de las dinaminas citosólicas. [8] [9] Esta proteína forma una espiral alrededor de las mitocondrias y se contrae para romper las membranas externa e interna del orgánulo. [14] Por otro lado, el proceso de fusión está dirigido por diferentes proteínas dinaminas ancladas a la membrana en diferentes niveles de las mitocondrias. [13] La fusión a nivel de la membrana mitocondrial externa está mediada por Mfn1 y Mfn2 (Mitofusinas 1 y 2), [15] y la fusión a nivel de la membrana mitocondrial interna está mediada por Opa1 . [8] [12] [13] Múltiples estudios de investigación han observado aumentos correlacionados entre la capacidad respiratoria mitocondrial con la expresión de los genes Mfn1, Mnf2 y Drp1 después de ejercicios de resistencia. [14] [15] Por lo tanto, se apoya que la reorganización de la red mitocondrial en las células musculares juega un papel importante en la respuesta al ejercicio. [4] [13] [15]
Regulación
PGC-1α , un miembro de la familia de coactivadores transcripcionales del receptor activado por el proliferador de peroxisomas gamma (PGC) , es el regulador maestro de la biogénesis mitocondrial. [1] [2] [16] Se sabe que coactiva el factor respiratorio nuclear 2 (NRF2/GABPA) , y junto con NRF-2 coactiva el factor respiratorio nuclear 1 ( NRF1 ). [15] [16] Los NRF, a su vez, activan el factor de transcripción mitocondrial A (tfam) , que es directamente responsable de la transcripción de proteínas mitocondriales codificadas en el núcleo. [15] [16] Esto incluye tanto las proteínas mitocondriales estructurales como las implicadas en la transcripción, traducción y reparación del ADNmt . [16] PGC-1β, una proteína que es estructuralmente similar a PGC-1α , también está implicada en la regulación de la biogénesis mitocondrial, pero se diferencia en que no aumenta en respuesta al ejercicio. [5] [17] [16] Si bien se han observado aumentos significativos en las mitocondrias encontradas en tejidos donde se sobreexpresa PGC-1α, a medida que el cofactor interactúa con estos factores de transcripción clave, los ratones knockout con PGC-1α alterado aún son viables y muestran una abundancia mitocondrial normal. [17] [5] [16] Por lo tanto, PGC-1α no es necesario para el desarrollo normal de las mitocondrias en ratones, pero cuando se los somete a estrés fisiológico, estos ratones exhiben una tolerancia disminuida en comparación con los ratones con niveles normales de PGC-1α. [5] [16] [17] De manera similar, en ratones knockout con PGC-1β alterado, los ratones mostraron niveles mayormente normales de función mitocondrial con una capacidad disminuida para adaptarse al estrés fisiológico. [18] [5] Sin embargo, un experimento de doble knockout de PGC-1α/β creó ratones que murieron principalmente dentro de las 24 horas por defectos en la maduración mitocondrial del tejido cardíaco. [19] Estos hallazgos sugieren que si bien tanto PGC-1α como PGC-1β no establecen por sí solos la capacidad de una célula para realizar la biogénesis mitocondrial, juntos pueden complementarse entre sí para una maduración y función mitocondrial óptimas durante períodos de estrés fisiológico. [19] [5] [17]
La quinasa activada por AMP (AMPK) también regula la biogénesis mitocondrial al fosforilar y activar PGC-1α al detectar una deficiencia de energía en el músculo. [5] [16] En ratones con proporciones reducidas de ATP/AMP que se producirían durante el ejercicio, se ha demostrado que el agotamiento de energía se correlaciona con la activación de AMPK. [5] [18] [16] La activación de AMPK luego continuó activando PGC-1α y NRF en estos ratones, y se estimuló la biogénesis mitocondrial. [5] [18] [16]
Envejecimiento
Se ha demostrado que la capacidad de biogénesis mitocondrial disminuye con la edad, y dicha disminución de la función mitocondrial se ha asociado con la diabetes y las enfermedades cardiovasculares. [20] [21] [22] El envejecimiento y la enfermedad pueden inducir cambios en los niveles de expresión de las proteínas implicadas en los mecanismos de fisión y fusión de las mitocondrias, creando así mitocondrias disfuncionales. [23] [24] Una hipótesis sobre los resultados perjudiciales del envejecimiento está asociada con la pérdida de telómeros , los segmentos finales de los cromosomas que protegen la información genética de la degradación. [21] [24] La pérdida de telómeros también se ha asociado con una disminución de la función mitocondrial. [24] [21] La deficiencia de la transcriptasa inversa de la telomerasa (TERT) , una enzima que desempeña un papel en la preservación de los telómeros, se ha correlacionado con p53 activado, una proteína que suprime PGC-1α. [24] [23] [21] Por lo tanto, la pérdida de telómeros y TERT que viene con el envejecimiento se ha asociado con una biogénesis mitocondrial deteriorada. [21] [23] [24] También se ha demostrado que la expresión de AMPK disminuye con la edad, lo que también puede contribuir a suprimir la biogénesis mitocondrial. [5] [24]
Aplicaciones clínicas de la biogénesis mitocondrial dirigida
La biogénesis mitocondrial puede ser un objetivo para prevenir la proliferación del cáncer. Específicamente, dos reguladores de la biogénesis, PGC1α y c-Myc , pueden ser el objetivo para prevenir la proliferación del cáncer. PGC1α es un componente clave en la biogénesis mitocondrial: como coactivador transcripcional, se dirige a múltiples factores de transcripción y al receptor alfa relacionado con el estrógeno (ERRα). [25] Se ha descubierto que los compuestos que se dirigen a la vía entre PGC1α y ERRα, como el agonista inverso de ERRα, XCT-790 , disminuyen significativamente la biogénesis mitocondrial, reduciendo así en gran medida la proliferación de células cancerosas y aumentando su sensibilidad a los agentes quimioterapéuticos. [26] c-Myc, un factor de transcripción, puede inhibirse durante su dimerización con la proteína Max por moléculas como IIA6B17 [27] y omomyc. [28] La inhibición del complejo c-Myc-Max puede bloquear el ciclo celular e inducir la apoptosis en las células cancerosas.
Referencias
- ^ abc Valero T (2014). "Editorial (Número temático: Biogénesis mitocondrial: enfoques farmacológicos)". Current Pharmaceutical Design . 20 (35): 5507–5509. doi :10.2174/138161282035140911142118. hdl : 10454/13341 . PMID 24606795.
- ^ abc Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). "Biogénesis mitocondrial en salud y enfermedad. Aproximaciones moleculares y terapéuticas". Current Pharmaceutical Design . 20 (35): 5619–33. doi :10.2174/1381612820666140306095106. PMID 24606801.
- ^ Holloszy JO (abril de 2011). "Regulación de la biogénesis mitocondrial y la expresión de GLUT4 mediante el ejercicio". Fisiología integral . 1 (2): 921–40. doi :10.1002/cphy.c100052. ISBN 9780470650714. Número de identificación personal 23737207.
- ^ ab Boushel R, Lundby C, Qvortrup K, Sahlin K (octubre de 2014). "Plasticidad mitocondrial con entrenamiento físico y entornos extremos". Reseñas de ciencias del deporte y el ejercicio . 42 (4): 169–74. doi : 10.1249/JES.0000000000000025 . PMID 25062000. S2CID 39267910.
- ^ abcdefghijk Jornayvaz FR, Shulman GI (2010). "Regulación de la biogénesis mitocondrial". Ensayos en bioquímica . 47 : 69–84. doi :10.1042/bse0470069. PMC 3883043 . PMID 20533901.
- ^ Harish A, Kurland CG (diciembre de 2017). "Las mitocondrias no son bacterias cautivas". Journal of Theoretical Biology . 434 : 88–98. doi :10.1016/j.jtbi.2017.07.011. PMID 28754286.
- ^ Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (mayo de 2004). "Efectos de la restricción calórica a corto y medio plazo en la fuga de protones mitocondriales musculares y la producción de especies reactivas de oxígeno". American Journal of Physiology. Endocrinology and Metabolism . 286 (5): E852-61. doi :10.1152/ajpendo.00367.2003. PMID 14736705.
- ^ abcdefghij Mishra P, Chan DC (febrero de 2016). "Regulación metabólica de la dinámica mitocondrial". The Journal of Cell Biology . 212 (4): 379–87. doi :10.1083/jcb.201511036. PMC 4754720 . PMID 26858267.
- ^ abcde Bertholet AM, Delerue T, Millet AM, Moulis MF, David C, Daloyau M, et al. (junio de 2016). "Dinámica de fusión/fisión mitocondrial en la neurodegeneración y la plasticidad neuronal". Neurobiology of Disease . 90 : 3–19. doi :10.1016/j.nbd.2015.10.011. PMID 26494254. S2CID 12627451.
- ^ abcdefg Dudek J, Rehling P, van der Laan M (febrero de 2013). "Importación de proteínas mitocondriales: principios comunes y redes fisiológicas". Biochimica et Biophysica Acta (BBA) - Investigación de células moleculares . 1833 (2): 274–85. doi : 10.1016/j.bbamcr.2012.05.028 . hdl : 11858/00-001M-0000-000E-CAAB-9 . PMID 22683763.
- ^ abcdefghi Baker MJ, Frazier AE, Gulbis JM, Ryan MT (septiembre de 2007). "Maquinaria de importación de proteínas mitocondriales: correlación entre la estructura y la función". Tendencias en biología celular . 17 (9): 456–64. doi :10.1016/j.tcb.2007.07.010. PMID 17825565.
- ^ ab Ventura-Clapier R, Garnier A, Veksler V (julio de 2008). "Control transcripcional de la biogénesis mitocondrial: el papel central de PGC-1alfa". Investigación cardiovascular . 79 (2): 208–17. doi : 10.1093/cvr/cvn098 . PMID 18430751.
- ^ abcdefg Youle RJ, van der Bliek AM (agosto de 2012). "Fisión, fusión y estrés mitocondrial". Ciencia . 337 (6098): 1062–5. doi : 10.1126/ciencia.1219855. PMC 4762028 . PMID 22936770.
- ^ abc Bo H, Zhang Y, Ji LL (julio de 2010). "Redefiniendo el papel de las mitocondrias en el ejercicio: una remodelación dinámica". Anales de la Academia de Ciencias de Nueva York . 1201 : 121–8. doi :10.1111/j.1749-6632.2010.05618.x. PMID 20649548. S2CID 33936266.
- ^ abcde Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, et al. (agosto de 2005). "La expresión de mitofusinas 1/2 y ERRalpha aumenta en el músculo esquelético humano después del ejercicio físico". The Journal of Physiology . 567 (Pt 1): 349–58. doi :10.1113/jphysiol.2005.092031. PMC 1474174 . PMID 15961417.
- ^ abcdefghij Johri A, Chandra A, Flint Beal M (septiembre de 2013). "PGC-1α, disfunción mitocondrial y enfermedad de Huntington". Free Radical Biology & Medicine . 62 : 37–46. doi :10.1016/j.freeradbiomed.2013.04.016. PMC 3722269 . PMID 23602910.
- ^ abcd Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY, et al. (octubre de 2004). "Defectos en el metabolismo energético adaptativo con hiperactividad vinculada al SNC en ratones sin PGC-1alfa". Cell . 119 (1): 121–35. doi : 10.1016/j.cell.2004.09.013 . PMID 15454086.
- ^ abc Scarpulla RC (julio de 2011). "Control metabólico de la biogénesis mitocondrial a través de la red reguladora de la familia PGC-1". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research . 1813 (7): 1269–78. doi :10.1016/j.bbamcr.2010.09.019. PMC 3035754 . PMID 20933024.
- ^ ab Lai L, Leone TC, Zechner C, Schaeffer PJ, Kelly SM, Flanagan DP, et al. (julio de 2008). "Los coactivadores transcripcionales PGC-1alpha y PGC-lbeta controlan los programas superpuestos necesarios para la maduración perinatal del corazón". Genes & Development . 22 (14): 1948–61. doi :10.1101/gad.1661708. PMC 2492740 . PMID 18628400.
- ^ Handy DE, Loscalzo J (junio de 2012). "Regulación redox de la función mitocondrial". Antioxidantes y señalización redox . 16 (11): 1323–67. doi :10.1089/ars.2011.4123. PMC 3324814. PMID 22146081 .
- ^ abcde David R (abril de 2011). "Envejecimiento: mitocondrias y telómeros se unen". Nature Reviews. Molecular Cell Biology . 12 (4): 204. doi : 10.1038/nrm3082 . PMID 21407239.
- ^ Hagen TM, Wehr CM, Ames BN (noviembre de 1998). "Decaimiento mitocondrial en el envejecimiento. Reversión mediante la suplementación de acetil-L-carnitina y N-tert-butil-alfa-fenil-nitrona". Anales de la Academia de Ciencias de Nueva York . 854 : 214–23. doi :10.1111/j.1749-6632.1998.tb09904.x. PMID 9928432. S2CID 25332524.
- ^ abc Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, et al. (febrero de 2011). "La disfunción de los telómeros induce compromiso metabólico y mitocondrial". Nature . 470 (7334): 359–65. doi :10.1038/nature09787. PMC 3741661 . PMID 21307849.
- ^ abcdef Sahin E, DePinho RA (mayo de 2012). "Eje del envejecimiento: telómeros, p53 y mitocondrias". Nature Reviews. Biología celular molecular . 13 (6): 397–404. doi :10.1038/nrm3352. PMC 3718675. PMID 22588366 .
- ^ Scarpulla, Richard (2011). "Control metabólico de la biogénesis mitocondrial a través de la red reguladora de la familia PGC-1". Biochim Biophys Acta . 1813 (7): 1269–1278. doi : 10.1016/j.bbamcr.2010.09.019 . PMC 3035754 . PMID 20933024.
- ^ Kokabu, Tetsuya; Mori, Taisuke; Matsushima, Hiroshi; Yoriki, Kaori; Kataoka, Hisashi; Tarumi, Yosuke; Kitawaki, Jo (2019). "Efecto antitumoral de XCT790, un agonista inverso de ERRα, sobre células de cáncer de endometrio ERα-negativas". Cell Oncol (Dordr) . 42 (2): 223–235. doi :10.1007/s13402-019-00423-5. PMID 30706380. S2CID 256111946.
- ^ Lu, Xiaohong; Vogt, Peter; Boger, Dale; Lunec, John (2008). "Alteración de la función transcripcional de MYC por un antagonista de molécula pequeña de la dimerización de MYC/MAX". Oncol. Rep . Radiología médica. 19 (3): 825–830. doi :10.1007/978-3-540-77385-6. ISBN . 978-3-540-77384-9. Número de identificación personal 18288422.
- ^ Demma, Marcos; Mapelli, Claudio; Sol, Angie; Bodea, Esmaranda; Ruprecht, Benjamín; Javaid, Sarah; Wiswell, Derek; Muise, Eric; Chen, Shiyang; Zelina, Juan; Orvieto, Federica; Santoprete, Alessia; Alteza, Simona; Tucci, Federica; Escandón, Enrique; Salón, Brian; Ray, Kallol; Walji, Abbas; O'Neil, Jennifer (2019). "Omomyc revela nuevos mecanismos para inhibir el oncogén MYC". Biol celular mol . 39 (22): e00248-19. doi :10.1128/MCB.00248-19. PMC 6817756 . PMID 31501275.
Lectura adicional
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (febrero de 2015). "Supresión de la biogénesis mitocondrial a través de la señalización de la proteína quinasa activada por mitógeno dependiente del receptor tipo Toll 4/señalización de la quinasa regulada por señal extracelular en la lesión renal aguda inducida por endotoxina". The Journal of Pharmacology and Experimental Therapeutics . 352 (2): 346–57. doi :10.1124/jpet.114.221085. PMC 4293437 . PMID 25503387.
- Cameron RB, Beeson CC, Schnellmann RG (diciembre de 2016). "Desarrollo de terapias que inducen la biogénesis mitocondrial para el tratamiento de enfermedades degenerativas agudas y crónicas". Journal of Medicinal Chemistry . 59 (23): 10411–10434. doi :10.1021/acs.jmedchem.6b00669. PMC 5564430 . PMID 27560192.
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Biogénesis mitocondrial como objetivo farmacológico: un nuevo enfoque para enfermedades agudas y crónicas". Revisión anual de farmacología y toxicología . 56 : 229–49. doi :10.1146/annurev-pharmtox-010715-103155. PMID 26566156.