Migración celular
La migración celular es un proceso central en el desarrollo y mantenimiento de los organismos multicelulares . La formación de tejido durante el desarrollo embrionario , la cicatrización de heridas y las respuestas inmunes requieren el movimiento orquestado de las células en direcciones particulares a ubicaciones específicas. Las células a menudo migran en respuesta a señales externas específicas, incluidas señales químicas y señales mecánicas . [1] Los errores durante este proceso tienen graves consecuencias, incluida la discapacidad intelectual , la enfermedad vascular , la formación de tumores y la metástasis . [2] [3] Una comprensión del mecanismo por el cual las células migran puede conducir al desarrollo de nuevas estrategias terapéuticas para controlar, por ejemplo, las células tumorales invasivas.
Debido al entorno altamente viscoso (bajo número de Reynolds ), las células necesitan producir fuerzas continuamente para moverse. Las células logran el movimiento activo mediante mecanismos muy diferentes. Muchos organismos procariotas menos complejos (y células espermáticas) utilizan flagelos o cilios para impulsarse. La migración de células eucariotas normalmente es mucho más compleja y puede consistir en combinaciones de diferentes mecanismos de migración. Generalmente implica cambios drásticos en la forma de la célula que son impulsados por el citoesqueleto . Dos escenarios de migración muy distintos son el movimiento de arrastre (el más estudiado) y la motilidad de vesículas . [4] [5] Un ejemplo paradigmático de movimiento de arrastre es el caso de los queratocitos epidérmicos de los peces, que se han utilizado ampliamente en la investigación y la enseñanza. [6]
Estudios de migración celular
La migración de células cultivadas adheridas a una superficie o en 3D se estudia comúnmente mediante microscopía . [7] [8] [5] Como el movimiento celular es muy lento, se graban videos de microscopía time-lapse de unos pocos μm/minuto de las células migratorias para acelerar el movimiento. Dichos videos (Figura 1) revelan que el frente celular líder es muy activo, con un comportamiento característico de contracciones y expansiones sucesivas. En general, se acepta que el frente líder es el motor principal que empuja a la célula hacia adelante.
Características comunes
Se cree que los procesos que subyacen a la migración de células de mamíferos son consistentes con los de la locomoción (no espermatozoides ) . [9] Las observaciones en común incluyen:
- desplazamiento citoplasmático en el borde delantero (frontal)
- Eliminación laminar de los restos acumulados dorsalmente hacia el borde posterior (parte posterior)
La última característica se observa más fácilmente cuando los agregados de una molécula de superficie se unen con un anticuerpo fluorescente o cuando pequeñas perlas se unen artificialmente al frente de la célula. [10]
Se ha observado que otras células eucariotas migran de forma similar. La ameba Dictyostelium discoideum es útil para los investigadores porque muestra de forma constante quimiotaxis en respuesta al AMP cíclico ; se mueve más rápidamente que las células de mamíferos cultivadas; y tiene un genoma haploide que simplifica el proceso de conexión de un producto génico particular con su efecto sobre el comportamiento celular. [11]


Procesos moleculares de migración
Existen dos teorías principales sobre cómo la célula hace avanzar su borde frontal: el modelo del citoesqueleto y el modelo de flujo de membrana. Es posible que ambos procesos subyacentes contribuyan a la extensión celular.
Modelo citoesquelético (A)
A la vanguardia
La experimentación ha demostrado que hay una rápida polimerización de actina en el borde delantero de la célula. [12] Esta observación ha llevado a la hipótesis de que la formación de filamentos de actina "empuja" el borde delantero hacia adelante y es la principal fuerza móvil para avanzar el borde delantero de la célula. [13] [14] Además, los elementos del citoesqueleto pueden interactuar extensa e íntimamente con la membrana plasmática de una célula. [15]
Borde de salida
Otros componentes del citoesqueleto (como los microtúbulos) desempeñan funciones importantes en la migración celular. Se ha descubierto que los microtúbulos actúan como "puntales" que contrarrestan las fuerzas contráctiles necesarias para la retracción del borde posterior durante el movimiento celular. Cuando los microtúbulos del borde posterior de la célula son dinámicos, pueden remodelarse para permitir la retracción. Cuando se suprime la dinámica, los microtúbulos no pueden remodelarse y, por lo tanto, se oponen a las fuerzas contráctiles. [16] La morfología de las células con dinámica de microtúbulos suprimida indica que las células pueden extender el borde frontal (polarizado en la dirección del movimiento), pero tienen dificultad para retraer su borde posterior. [17] Por otro lado, las altas concentraciones de fármacos o las mutaciones de microtúbulos que despolimerizan los microtúbulos pueden restaurar la migración celular, pero hay una pérdida de direccionalidad. Se puede concluir que los microtúbulos actúan tanto para restringir el movimiento celular como para establecer la direccionalidad.
Modelo de flujo de membrana (B)
El borde delantero en la parte delantera de una célula migratoria es también el sitio en el que la membrana de los depósitos de membrana interna se devuelve a la superficie celular al final del ciclo endocítico . [18] [19] Esto sugiere que la extensión del borde delantero se produce principalmente por la adición de membrana en la parte delantera de la célula. Si es así, los filamentos de actina que se forman allí podrían estabilizar la membrana añadida de modo que se forme una extensión estructurada, o lámina, en lugar de una estructura similar a una burbuja (o bleb) en su parte delantera. [20] Para que una célula se mueva, es necesario llevar un nuevo suministro de "pies" (proteínas llamadas integrinas , que unen una célula a la superficie sobre la que se arrastra) al frente. Es probable que estos pies sean endocitados [21] hacia la parte trasera de la célula y llevados al frente de la célula por exocitosis, para ser reutilizados para formar nuevas uniones al sustrato.
En el caso de las amebas de Dictyostelium , tres mutantes sensibles a la temperatura condicionales que afectan el reciclaje de la membrana bloquean la migración celular a la temperatura restrictiva (más alta); [22] [23] [24] proporcionan un respaldo adicional a la importancia del ciclo endocítico en la migración celular. Además, estas amebas se mueven bastante rápido: aproximadamente una longitud de célula en ~5 minutos. Si se las considera cilíndricas (lo que es más o menos cierto durante la quimiotaxización), esto requeriría que reciclaran el equivalente a una superficie celular cada 5 minutos, que es aproximadamente lo que se mide. [25]

Base mecanicista de la migración ameboides
El arrastre adhesivo no es el único modo de migración exhibido por las células eucariotas. Es importante destacar que se ha descubierto que varios tipos de células ( amoebas de Dictyostelium , neutrófilos , células cancerosas metastásicas y macrófagos ) son capaces de migrar independientemente de la adhesión. Históricamente, el físico EM Purcell teorizó (en 1977) que en condiciones de dinámica de fluidos de bajo número de Reynolds , que se aplican a escala celular, el flujo superficial hacia atrás podría proporcionar un mecanismo para que los objetos microscópicos naden hacia adelante. [27] Después de algunas décadas, se proporcionó apoyo experimental para este modelo de movimiento celular cuando se descubrió (en 2010) que tanto las células ameboides como los neutrófilos pueden realizar quimiotaxia hacia una fuente de quimioatrayente mientras están suspendidos en un medio isodense. [28] Posteriormente se demostró, utilizando optogenética , que las células que migran de forma ameboide sin adherencias exhiben un flujo de membrana plasmática hacia la parte posterior de la célula que puede impulsar a las células al ejercer fuerzas tangenciales sobre el fluido circundante. [26] [29] El tráfico polarizado de vesículas que contienen membrana desde la parte posterior a la parte frontal de la célula ayuda a mantener el tamaño celular. [26] También se observó un flujo de membrana hacia atrás en células de Dictyostelium discoideum . [30] Estas observaciones brindan un fuerte apoyo a los modelos de movimiento celular que dependen de un flujo de membrana de superficie celular hacia atrás (Modelo B, arriba). Curiosamente, también se ha descubierto que la migración de grupos supracelulares está respaldada por un mecanismo similar de flujo de superficie hacia atrás. [31]
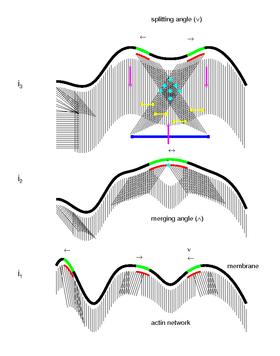
Mecanismo biomecánico y molecular colectivo del movimiento celular.
Basándose en algunos modelos matemáticos, estudios recientes plantean la hipótesis de un nuevo modelo biológico para el mecanismo biomecánico y molecular colectivo del movimiento celular. [32] Se propone que los microdominios tejen la textura del citoesqueleto y sus interacciones marcan la ubicación para la formación de nuevos sitios de adhesión. Según este modelo, la dinámica de señalización de los microdominios organiza el citoesqueleto y su interacción con el sustrato. A medida que los microdominios desencadenan y mantienen la polimerización activa de los filamentos de actina, su propagación y movimiento en zigzag en la membrana generan una red altamente interconectada de filamentos curvos o lineales orientados en un amplio espectro de ángulos con respecto al límite celular. También se propone que la interacción de los microdominios marca la formación de nuevos sitios de adhesión focal en la periferia celular. La interacción de la miosina con la red de actina genera entonces retracción/ondulación de la membrana, flujo retrógrado y fuerzas contráctiles para el movimiento hacia adelante. Finalmente, la aplicación continua de estrés en los antiguos sitios de adhesión focal podría dar como resultado la activación de la calpaína inducida por calcio y, en consecuencia, el desprendimiento de las adhesiones focales que completa el ciclo.
Polaridad en células migratorias
Las células migratorias tienen una polaridad : una parte delantera y una trasera. Sin ella, se moverían en todas direcciones a la vez, es decir, se dispersarían. Se desconoce cómo se formula esta polaridad a nivel molecular dentro de una célula. En una célula que serpentea de manera aleatoria, la parte delantera puede ceder fácilmente y volverse pasiva a medida que alguna otra región, o regiones, de la célula forman un nuevo frente. En las células que sufren quimiotaxación, la estabilidad de la parte delantera parece mejorar a medida que la célula avanza hacia una mayor concentración de la sustancia química estimulante. Desde una perspectiva biofísica, la polaridad se explicó en términos de un gradiente en la carga de la superficie de la membrana interna entre las regiones delanteras y los bordes traseros de la célula. [33] Esta polaridad se refleja a nivel molecular por una restricción de ciertas moléculas a regiones particulares de la superficie celular interna . Por lo tanto, el fosfolípido PIP3 y Ras, Rac y CDC42 activados se encuentran en la parte delantera de la célula, mientras que Rho GTPasa y PTEN se encuentran hacia la parte trasera. [34] [35] [36] [37]
Se cree que las actinas filamentosas y los microtúbulos son importantes para establecer y mantener la polaridad de una célula. [38] Los fármacos que destruyen los filamentos de actina tienen efectos múltiples y complejos, lo que refleja el amplio papel que estos filamentos desempeñan en muchos procesos celulares. Puede ser que, como parte del proceso locomotor, las vesículas de membrana se transporten a lo largo de estos filamentos hasta el frente de la célula. En las células que realizan quimiotaxización, la mayor persistencia de la migración hacia el objetivo puede ser el resultado de una mayor estabilidad de la disposición de las estructuras filamentosas dentro de la célula y determinar su polaridad. A su vez, estas estructuras filamentosas pueden estar dispuestas dentro de la célula de acuerdo con la forma en que las moléculas como PIP3 y PTEN están dispuestas en la membrana celular interna. Y la ubicación de estas parece estar determinada a su vez por las señales quimioatrayentes a medida que inciden en receptores específicos en la superficie externa de la célula.
Aunque se sabe desde hace muchos años que los microtúbulos influyen en la migración celular, el mecanismo por el que lo hacen sigue siendo controvertido. En una superficie plana, los microtúbulos no son necesarios para el movimiento, pero son necesarios para proporcionar direccionalidad al movimiento celular y una protrusión eficiente del borde delantero. [17] [39] Cuando están presentes, los microtúbulos retardan el movimiento celular cuando su dinámica se suprime por un tratamiento farmacológico o por mutaciones de la tubulina. [17]
Problemas inversos en el contexto de la motilidad celular
Se ha establecido un área de investigación llamada problemas inversos en la motilidad celular. [40] [41] [32] Este enfoque se basa en la idea de que los cambios de comportamiento o forma de una célula contienen información sobre los mecanismos subyacentes que generan estos cambios. La lectura del movimiento celular, es decir, la comprensión de los procesos biofísicos y mecanoquímicos subyacentes, es de suma importancia. [42] Los modelos matemáticos desarrollados en estos trabajos determinan algunas características físicas y propiedades materiales de las células localmente a través del análisis de secuencias de imágenes de células vivas y utilizan esta información para realizar más inferencias sobre las estructuras moleculares, la dinámica y los procesos dentro de las células, como la red de actina, los microdominios, la quimiotaxis, la adhesión y el flujo retrógrado.
Véase también
- Formación de la tapa
- Quimiotaxis
- Migración celular colectiva
- Durotaxis
- Ciclo endocítico
- Modelos murinos de metástasis de cáncer de mama
- Neurofílico
- Dinámica de proteínas
Referencias
- ^ Mak M, Spill F, Kamm RD, Zaman MH (febrero de 2016). "Migración unicelular en microambientes complejos: mecánica y dinámica de señalización". Journal of Biomechanical Engineering . 138 (2): 021004. doi :10.1115/1.4032188. PMC 4844084 . PMID 26639083.
- ^ Swaney K, Huang CH, Devreotes PN (2010). "Quimiotaxis eucariota: una red de vías de señalización controla la motilidad, la detección direccional y la polaridad". Revisión anual de biofísica . 39 : 265–289. doi :10.1146/annurev.biophys.093008.131228. PMC 4364543 . PMID 20192768.
- ^ Zhan H, Bhattacharya S, Cai H, Iglesias PA, Huang CH, Devreotes PN (septiembre de 2020). "Una red de señalización excitable Ras/PI3K/ERK controla la migración y la transformación oncogénica en células epiteliales". Developmental Cell . 54 (5): 608–623. doi :10.1016/j.devcel.2020.08.001. PMC 7505206 . PMID 32877650.
- ^ Huber F, Schnauß J, Rönicke S, Rauch P, Müller K, Fütterer C, et al. (enero de 2013). "Complejidad emergente del citoesqueleto: de filamentos individuales a tejido". Avances en Física . 62 (1): 1–112. Bibcode :2013AdPhy..62....1H. doi :10.1080/00018732.2013.771509. PMC 3985726 . PMID 24748680. en línea
- ^ ab Pebworth MP, Cismas SA, Asuri P (2014). "Una nueva plataforma de cultivo 2.5D para investigar el papel de los gradientes de rigidez en la migración celular independiente de la adhesión". PLOS ONE . 9 (10): e110453. Bibcode :2014PLoSO...9k0453P. doi : 10.1371/journal.pone.0110453 . PMC 4195729 . PMID 25310593.
- ^ Prieto D, Aparicio G, Sotelo-Silveira JR (noviembre de 2017). "Análisis de la migración celular: un experimento de laboratorio de bajo costo para cursos de biología celular y del desarrollo utilizando queratocitos de escamas de peces". Educación en bioquímica y biología molecular . 45 (6): 475–482. doi : 10.1002/bmb.21071 . PMID 28627731.
- ^ Dormann D, Weijer CJ (agosto de 2006). "Obtención de imágenes de la migración celular". The EMBO Journal . 25 (15): 3480–3493. doi :10.1038/sj.emboj.7601227. PMC 1538568 . PMID 16900100.
- ^ Shih W, Yamada S (diciembre de 2011). "Imágenes de células vivas de células migrantes que expresan proteínas marcadas con fluorescencia en una matriz tridimensional". Journal of Visualized Experiments (58). doi :10.3791/3589. PMC 3369670. PMID 22215133 .
- ^ "¿Qué es la migración celular?". Portal de migración celular . Consorcio de migración celular. Archivado desde el original el 22 de octubre de 2014. Consultado el 24 de marzo de 2013 .
- ^ Abercrombie M, Heaysman JE, Pegrum SM (octubre de 1970). "La locomoción de fibroblastos en cultivo. 3. Movimientos de partículas en la superficie dorsal de la lámina principal". Experimental Cell Research . 62 (2): 389–398. doi :10.1016/0014-4827(70)90570-7. PMID 5531377.
- ^ Willard SS, Devreotes PN (septiembre de 2006). "Vías de señalización que median la quimiotaxis en la ameba social, Dictyostelium discoideum". Revista Europea de Biología Celular . 85 (9–10): 897–904. doi :10.1016/j.ejcb.2006.06.003. PMID 16962888.
- ^ Wang YL (agosto de 1985). "Intercambio de subunidades de actina en el borde delantero de fibroblastos vivos: posible papel de la cinta de correr". The Journal of Cell Biology . 101 (2): 597–602. doi :10.1083/jcb.101.2.597. PMC 2113673 . PMID 4040521.
- ^ Mitchison TJ, Cramer LP (febrero de 1996). "Motilidad celular basada en actina y locomoción celular". Cell . 84 (3): 371–379. doi : 10.1016/S0092-8674(00)81281-7 . PMID 8608590. S2CID 982415.
- ^ Pollard TD, Borisy GG (febrero de 2003). "Motilidad celular impulsada por el ensamblaje y desensamblaje de filamentos de actina". Cell . 112 (4): 453–465. doi : 10.1016/S0092-8674(03)00120-X . PMID 12600310. S2CID 6887118.
- ^ Doherty GJ, McMahon HT (2008). "Mediación, modulación y consecuencias de las interacciones entre la membrana y el citoesqueleto". Revista anual de biofísica . 37 : 65–95. doi :10.1146/annurev.biophys.37.032807.125912. PMID 18573073.
- ^ Yang H, Ganguly A, Cabral F (octubre de 2010). "La inhibición de la migración celular y la división celular se correlaciona con distintos efectos de los fármacos inhibidores de los microtúbulos". The Journal of Biological Chemistry . 285 (42): 32242–32250. doi : 10.1074/jbc.M110.160820 . PMC 2952225 . PMID 20696757.
- ^ abc Ganguly A, Yang H, Sharma R, Patel KD, Cabral F (diciembre de 2012). "El papel de los microtúbulos y su dinámica en la migración celular". The Journal of Biological Chemistry . 287 (52): 43359–43369. doi : 10.1074/jbc.M112.423905 . PMC 3527923 . PMID 23135278.
- ^ Bretscher MS (enero de 1983). "Distribución de receptores para transferrina y lipoproteína de baja densidad en la superficie de células gigantes HeLa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 80 (2): 454–458. Bibcode :1983PNAS...80..454B. doi : 10.1073/pnas.80.2.454 . PMC 393396 . PMID 6300844.
- ^ Hopkins CR, Gibson A, Shipman M, Strickland DK, Trowbridge IS (junio de 1994). "En los fibroblastos migratorios, los receptores de reciclaje se concentran en túbulos estrechos en el área pericentriolar y luego se dirigen a la membrana plasmática de la lámina principal". The Journal of Cell Biology . 125 (6): 1265–1274. doi :10.1083/jcb.125.6.1265. PMC 2290921 . PMID 7515888.
- ^ Bretscher MS (noviembre de 1996). "Cómo lograr que el flujo de la membrana y el citoesqueleto cooperen en el movimiento celular". Cell . 87 (4): 601–606. doi : 10.1016/S0092-8674(00)81380-X . PMID 8929529. S2CID 14776455.
- ^ Bretscher MS (febrero de 1992). "Integrinas circulantes: alfa 5 beta 1, alfa 6 beta 4 y Mac-1, pero no alfa 3 beta 1, alfa 4 beta 1 o LFA-1". The EMBO Journal . 11 (2): 405–410. doi :10.1002/j.1460-2075.1992.tb05068.x. PMC 556468 . PMID 1531629.
- ^ Thompson CR, Bretscher MS (septiembre de 2002). "La polaridad y la locomoción celular, así como la endocitosis, dependen de la NSF". Desarrollo . 129 (18): 4185–4192. doi :10.1242/dev.129.18.4185. PMID 12183371.
- ^ Bretscher MS, Clotworthy M (agosto de 2007). "Uso de sitios loxP únicos para mejorar la recombinación homóloga: mutantes ts en Sec1 de Dictyostelium discoideum". PLOS ONE . 2 (8): e724. Bibcode :2007PLoSO...2..724B. doi : 10.1371/journal.pone.0000724 . PMC 1933600 . PMID 17684569.
- ^ Zanchi R, Howard G, Bretscher MS, Kay RR (octubre de 2010). "El gen exocítico secA es necesario para la motilidad y osmorregulación de las células de Dictyostelium". Journal of Cell Science . 123 (Pt 19): 3226–3234. doi :10.1242/jcs.072876. PMC 2939799 . PMID 20807800.
- ^ Aguado-Velasco C, Bretscher MS (diciembre de 1999). "Circulación de la membrana plasmática en Dictyostelium". Biología molecular de la célula . 10 (12): 4419–4427. doi :10.1091/mbc.10.12.4419. PMC 25767 . PMID 10588667.
- ^ abc O'Neill PR, Castillo-Badillo JA, Meshik X, Kalyanaraman V, Melgarejo K, Gautam N (julio de 2018). "El flujo de membrana impulsa un modo de migración de células ameboides independiente de la adhesión". Developmental Cell . 46 (1): 9–22.e4. doi :10.1016/j.devcel.2018.05.029. PMC 6048972 . PMID 29937389.
- ^ Purcell EM (1977). "Vida con un número de Reynolds bajo". American Journal of Physics . 45 (3): 3–11. Bibcode :1977AmJPh..45....3P. doi :10.1119/1.10903. hdl : 2433/226838 .
- ^ Barry NP, Bretscher MS (junio de 2010). "Las amebas y los neutrófilos de Dictyostelium pueden nadar". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (25): 11376–11380. Bibcode :2010PNAS..10711376B. doi : 10.1073/pnas.1006327107 . PMC 2895083 . PMID 20534502.
- ^ Bell GR, Collins SR (julio de 2018). ""Rho"ing a Cellular Boat with Rearward Membrane Flow" ("Rho"ing de un barco celular con flujo de membrana hacia atrás) Developmental Cell . 46 (1): 1–3. doi : 10.1016/j.devcel.2018.06.008 . PMID 29974859.
- ^ Tanaka M, Kikuchi T, Uno H, Okita K, Kitanishi-Yumura T, Yumura S (octubre de 2017). "Rotación y flujo de la membrana celular para la migración celular". Informes científicos . 7 (1): 12970. Código bibliográfico : 2017NatSR...712970T. doi :10.1038/s41598-017-13438-5. PMC 5636814 . PMID 29021607.
- ^ Shellard A, Szabó A, Trepat X, Mayor R (octubre de 2018). "La contracción supracelular en la parte posterior de los grupos de células de la cresta neural impulsa la quimiotaxis colectiva". Science . 362 (6412): 339–343. Bibcode :2018Sci...362..339S. doi :10.1126/science.aau3301. PMC 6218007 . PMID 30337409.
- ^ abc Coskun H, Coskun H (marzo de 2011). "Médico celular: lectura del movimiento celular: una técnica de diagnóstico matemático a través del análisis del movimiento de una sola célula". Boletín de biología matemática . 73 (3): 658–682. doi :10.1007/s11538-010-9580-x. PMID 20878250. S2CID 37036941.
- ^ Banerjee T, Biswas D, Pal DS, Miao Y, Iglesias PA, Devreotes PN (octubre de 2022). "La dinámica espaciotemporal de la carga superficial de la membrana regula la polaridad y la migración celular". Nature Cell Biology . 24 (10): 1499–1515. doi :10.1038/s41556-022-00997-7. PMC 10029748 . PMID 36202973. S2CID 248990694.
- ^ Parent CA, Devreotes PN (abril de 1999). "El sentido de orientación de una célula". Science . 284 (5415): 765–770. Bibcode :1999Sci...284..765P. doi :10.1126/science.284.5415.765. PMID 10221901.
- ^ Ridley AJ, Schwartz MA, Burridge K, Firtel RA, Ginsberg MH, Borisy G, et al. (diciembre de 2003). "Migración celular: integración de señales de adelante hacia atrás". Science . 302 (5651): 1704–1709. Bibcode :2003Sci...302.1704R. doi :10.1126/science.1092053. PMID 14657486. S2CID 16029926.
- ^ Pal DS, Banerjee T, Lin Y, de Trogoff F, Borleis J, Iglesias PA, et al. (julio de 2023). "La activación de nodos descendentes individuales en la red de factores de crecimiento dirige la migración de células inmunitarias". Developmental Cell . 58 (13): 1170–1188.e7. doi :10.1016/j.devcel.2023.04.019. PMC 10524337 . PMID 37220748.
- ^ Lin Y, Pal DS, Banerjee P, Banerjee T, Qin G, Deng Y, et al. (julio de 2024). "La supresión de Ras potencia la polarización y migración celular impulsada por la contractilidad de actomiosina trasera". Nature Cell Biology : 1–15. doi :10.1038/s41556-024-01453-4. PMID 38951708.
- ^ Li R, Gundersen GG (noviembre de 2008). "Más allá de la polaridad de los polímeros: cómo el citoesqueleto construye una célula polarizada". Nature Reviews. Molecular Cell Biology . 9 (11): 860–873. doi :10.1038/nrm2522. PMID 18946475. S2CID 19500145.
- ^ Meyer AS, Hughes-Alford SK, Kay JE, Castillo A, Wells A, Gertler FB, et al. (junio de 2012). "La protrusión 2D pero no la motilidad predice la migración de células cancerosas inducida por factores de crecimiento en colágeno 3D". The Journal of Cell Biology . 197 (6): 721–729. doi :10.1083/jcb.201201003. PMC 3373410 . PMID 22665521.
- ^ Coskun H (2006). Modelos matemáticos para la motilidad de células ameboides y problemas inversos basados en modelos (tesis doctoral). Universidad de Iowa – vía ProQuest.
- ^ Coskun H, Li Y, Mackey MA (enero de 2007). "Motilidad de células ameboides: un modelo y un problema inverso, con una aplicación a los datos de imágenes de células vivas". Journal of Theoretical Biology . 244 (2): 169–179. Bibcode :2007JThBi.244..169C. doi :10.1016/j.jtbi.2006.07.025. PMID 16997326.
- ^ Coskun H, Coskun H (marzo de 2011). "Médico celular: lectura del movimiento celular: una técnica de diagnóstico matemático a través del análisis del movimiento de una sola célula". Boletín de biología matemática . 73 (3): 658–82. doi :10.1007/s11538-010-9580-x. PMID 20878250.; Resumen para legos en: "Los matemáticos utilizan el 'perfil' celular para detectar anomalías, incluido el cáncer". ScienceDaily .
Enlaces externos
- Portal de migración celular El Portal de migración celular es un recurso completo y actualizado periódicamente sobre la migración celular.
- El citoesqueleto y la migración celular Un recorrido por imágenes y vídeos del laboratorio JV Small en Salzburgo y Viena
