Sistema de recompensas
El sistema de recompensa (el circuito mesocorticolímbico) es un grupo de estructuras neuronales responsables de la saliencia del incentivo (es decir, "querer"; deseo o ansia de una recompensa y motivación ), el aprendizaje asociativo (principalmente el refuerzo positivo y el condicionamiento clásico ) y las emociones con valencia positiva , particularmente las que involucran el placer como un componente central (p. ej., alegría , euforia y éxtasis ). [2] [3] La recompensa es la propiedad atractiva y motivacional de un estímulo que induce un comportamiento apetitivo, también conocido como comportamiento de aproximación y comportamiento consumatorio. [2] Un estímulo gratificante se ha descrito como "cualquier estímulo, objeto, evento, actividad o situación que tenga el potencial de hacer que nos acerquemos a él y lo consumamos es, por definición, una recompensa". [2] En el condicionamiento operante , los estímulos gratificantes funcionan como reforzadores positivos ; [1] sin embargo, la afirmación inversa también es válida: los reforzadores positivos son gratificantes. [1] [4] El sistema de recompensa motiva a los animales a acercarse a estímulos o a participar en conductas que aumentan la aptitud física (sexo, alimentos ricos en energía, etc.). La supervivencia de la mayoría de las especies animales depende de maximizar el contacto con estímulos beneficiosos y minimizar el contacto con estímulos dañinos. La cognición de recompensa sirve para aumentar la probabilidad de supervivencia y reproducción al provocar un aprendizaje asociativo, provocar un comportamiento de aproximación y consumación y desencadenar emociones de valencia positiva . [1] Por lo tanto, la recompensa es un mecanismo que evolucionó para ayudar a aumentar la aptitud adaptativa de los animales. [5] En la adicción a las drogas , ciertas sustancias sobreactivan el circuito de recompensa, lo que lleva a un comportamiento compulsivo de búsqueda de sustancias resultante de la plasticidad sináptica en el circuito. [6]
Las recompensas primarias son una clase de estímulos gratificantes que facilitan la supervivencia de uno mismo y de la descendencia , e incluyen recompensas homeostáticas (p. ej., comida sabrosa ) y reproductivas (p. ej., contacto sexual e inversión parental ). [2] [7] Las recompensas intrínsecas son recompensas incondicionadas que son atractivas y motivan el comportamiento porque son inherentemente placenteras. [2] Las recompensas extrínsecas (p. ej., dinero o ver al equipo deportivo favorito ganar un partido) son recompensas condicionadas que son atractivas y motivan el comportamiento pero no son inherentemente placenteras. [2] [8] Las recompensas extrínsecas derivan su valor motivacional como resultado de una asociación aprendida (es decir, condicionamiento) con recompensas intrínsecas. [2] Las recompensas extrínsecas también pueden provocar placer (p. ej., euforia por ganar mucho dinero en una lotería) después de haber sido condicionadas clásicamente con recompensas intrínsecas. [2]
Definición
En neurociencia, el sistema de recompensa es una colección de estructuras cerebrales y vías neuronales que son responsables de la cognición relacionada con la recompensa, incluido el aprendizaje asociativo (principalmente el condicionamiento clásico y el refuerzo operante ), la prominencia de los incentivos (es decir, la motivación y el "querer", el deseo o el anhelo de una recompensa) y las emociones con valencia positiva , en particular las emociones que implican placer (es decir, el "gusto" hedónico). [1] [3]
Los términos que se utilizan habitualmente para describir el comportamiento relacionado con el componente de "querer" o deseo de la recompensa incluyen el comportamiento apetitivo, el comportamiento de aproximación, el comportamiento preparatorio, el comportamiento instrumental, el comportamiento anticipatorio y la búsqueda. [9] Los términos que se utilizan habitualmente para describir el comportamiento relacionado con el componente de "gusto" o placer de la recompensa incluyen el comportamiento consumatorio y el comportamiento de toma. [9]
Las tres funciones principales de las recompensas son su capacidad para:
- producir aprendizaje asociativo (es decir, condicionamiento clásico y refuerzo operante ); [1]
- afectan la toma de decisiones e inducen un comportamiento de aproximación (a través de la asignación de relevancia motivacional a estímulos gratificantes); [1]
- provocar emociones con valencia positiva , en particular placer. [1]
Neuroanatomía
Descripción general
Las estructuras cerebrales que componen el sistema de recompensa se encuentran principalmente dentro del circuito cortico-basal-tálamo-cortical ; [10] la porción de los ganglios basales del circuito impulsa la actividad dentro del sistema de recompensa. [10] La mayoría de las vías que conectan las estructuras dentro del sistema de recompensa son interneuronas glutamatérgicas , neuronas espinosas medianas GABAérgicas (MSN) y neuronas de proyección dopaminérgicas , [10] [11] aunque otros tipos de neuronas de proyección contribuyen (por ejemplo, neuronas de proyección orexinérgicas ). El sistema de recompensa incluye el área tegmental ventral , el estriado ventral (es decir, el núcleo accumbens y el tubérculo olfatorio ), el estriado dorsal (es decir, el núcleo caudado y el putamen ), la sustancia negra (es decir, la pars compacta y la pars reticulata ), la corteza prefrontal , la corteza cingulada anterior , la corteza insular , el hipocampo , el hipotálamo (en particular, el núcleo orexinérgico en el hipotálamo lateral ), el tálamo (múltiples núcleos), el núcleo subtalámico , el globo pálido (tanto externo como interno ), el pálido ventral , el núcleo parabranquial , la amígdala y el resto de la amígdala extendida . [3] [10] [12] [13] [14] El núcleo del rafe dorsal y el cerebelo parecen modular algunas formas de cognición relacionada con la recompensa (es decir, aprendizaje asociativo , prominencia motivacional y emociones positivas ) y también comportamientos. [15] [16] [17] El núcleo tegmental laterodorsal (LDT) , el núcleo pedunculopontino (PPTg) y la habénula lateral (LHb) (tanto directa como indirectamente a través del núcleo tegmental rostromedial (RMTg) ) también son capaces de inducir prominencia aversiva y prominencia de incentivo. a través de sus proyecciones al área tegmental ventral (ATV). [18] Tanto la LDT como la PPTg envían proyecciones glutamatérgicas al ATV que hacen sinapsis con neuronas dopaminérgicas, las cuales pueden producir saliencia de incentivo. La LHb envía proyecciones glutamatérgicas, la mayoría de las cuales hacen sinapsis con neuronas GABAérgicas RMTg que a su vez impulsan la inhibición de las neuronas dopaminérgicas del ATV, aunque algunas proyecciones de la LHb terminan en interneuronas del ATV. Estas proyecciones de la LHb se activan tanto por estímulos aversivos como por la ausencia de una recompensa esperada, y la excitación de la LHb puede inducir aversión. [19] [20] [21]
La mayoría de las vías de dopamina (es decir, neuronas que utilizan el neurotransmisor dopamina para comunicarse con otras neuronas) que se proyectan fuera del área tegmental ventral son parte del sistema de recompensa; [10] en estas vías, la dopamina actúa sobre receptores tipo D1 o tipo D2 para estimular (tipo D1) o inhibir (tipo D2) la producción de AMPc . [22] Las neuronas espinosas medianas GABAérgicas del cuerpo estriado también son componentes del sistema de recompensa. [10] Los núcleos de proyección glutamatérgicos en el núcleo subtalámico, la corteza prefrontal, el hipocampo, el tálamo y la amígdala se conectan a otras partes del sistema de recompensa a través de las vías del glutamato. [10] El haz prosencéfalo medial , que es un conjunto de muchas vías neuronales que median la recompensa de estimulación cerebral (es decir, la recompensa derivada de la estimulación electroquímica directa del hipotálamo lateral ), también es un componente del sistema de recompensa. [23]
Existen dos teorías con respecto a la actividad del núcleo accumbens y la generación de gusto y deseo. La hipótesis de inhibición (o hiperpolarización) propone que el núcleo accumbens ejerce efectos inhibidores tónicos sobre las estructuras posteriores, como el pálido ventral, el hipotálamo o el área tegmental ventral, y que al inhibir las neuronas motoras mayores en el núcleo accumbens (NAcc), estas estructuras se excitan, "liberando" el comportamiento relacionado con la recompensa. Si bien los agonistas del receptor GABA son capaces de provocar reacciones tanto de "gusto" como de "deseo" en el núcleo accumbens, las entradas glutamatérgicas de la amígdala basolateral , el hipocampo ventral y la corteza prefrontal medial pueden impulsar la prominencia del incentivo. Además, si bien la mayoría de los estudios encuentran que las neuronas NAcc reducen la activación en respuesta a la recompensa, varios estudios encuentran la respuesta opuesta. Esto ha llevado a la propuesta de la hipótesis de desinhibición (o despolarización), que propone que la excitación de las neuronas NAcc, o al menos ciertos subconjuntos, impulsan el comportamiento relacionado con la recompensa. [3] [24] [25]
Después de casi 50 años de investigación sobre la recompensa de la estimulación cerebral, los expertos han certificado que docenas de sitios en el cerebro mantendrán la autoestimulación intracraneal . Las regiones incluyen el hipotálamo lateral y los haces del prosencéfalo medial, que son especialmente efectivos. La estimulación allí activa las fibras que forman las vías ascendentes; las vías ascendentes incluyen la vía mesolímbica de la dopamina , que se proyecta desde el área tegmental ventral hasta el núcleo accumbens . Hay varias explicaciones de por qué la vía mesolímbica de la dopamina es central para los circuitos que median la recompensa. Primero, hay un marcado aumento en la liberación de dopamina de la vía mesolímbica cuando los animales participan en la autoestimulación intracraneal. [5] Segundo, los experimentos indican consistentemente que la recompensa de la estimulación cerebral estimula el refuerzo de las vías que normalmente se activan por recompensas naturales , y la recompensa de drogas o la autoestimulación intracraneal pueden ejercer una activación más poderosa de los mecanismos centrales de recompensa porque activan el centro de recompensa directamente en lugar de a través de los nervios periféricos . [5] [26] [27] En tercer lugar, cuando a los animales se les administran drogas adictivas o participan en conductas naturalmente gratificantes, como la alimentación o la actividad sexual, se produce una marcada liberación de dopamina en el núcleo accumbens. [5] Sin embargo, la dopamina no es el único compuesto de recompensa en el cerebro.
Ruta clave

Área tegmental ventral
- El área tegmental ventral (ATV) es importante para responder a estímulos y señales que indican la presencia de una recompensa. Los estímulos gratificantes (y todas las drogas adictivas) actúan sobre el circuito haciendo que la ATV libere señales de dopamina al núcleo accumbens , ya sea de forma directa o indirecta. [ cita requerida ] La ATV tiene dos vías importantes: la vía mesolímbica , que se proyecta a las regiones límbicas (estriatales) y sustenta los comportamientos y procesos motivacionales, y la vía mesocortical , que se proyecta a la corteza prefrontal y sustenta las funciones cognitivas, como el aprendizaje de señales externas, etc. [28]
- Las neuronas dopaminérgicas en esta región convierten el aminoácido tirosina en DOPA utilizando la enzima tirosina hidroxilasa , que luego se convierte en dopamina utilizando la enzima DOPA descarboxilasa . [29]
Cuerpo estriado (núcleo accumbens)
- El cuerpo estriado participa ampliamente en la adquisición y la obtención de conductas aprendidas en respuesta a una señal gratificante. El ATV se proyecta al cuerpo estriado y activa las neuronas espinosas medianas GABAérgicas a través de los receptores D1 y D2 dentro del cuerpo estriado ventral (núcleo accumbens) y dorsal. [30]
- El estriado ventral (el núcleo accumbens) participa ampliamente en la adquisición de conductas cuando se alimenta del ATV, y en la provocación de conductas cuando se alimenta del PFC. La capa NAc se proyecta al pálido y al ATV, regulando las funciones límbicas y autónomas. Esto modula las propiedades de refuerzo de los estímulos y los aspectos a corto plazo de la recompensa. El núcleo NAc se proyecta a la sustancia negra y participa en el desarrollo de conductas de búsqueda de recompensas y su expresión. Participa en el aprendizaje espacial, la respuesta condicional y la elección impulsiva; los elementos a largo plazo de la recompensa. [28]
- El estriado dorsal participa en el aprendizaje, el estriado medial dorsal en el aprendizaje dirigido a objetivos y el estriado lateral dorsal en el aprendizaje estímulo-respuesta, que es fundamental para la respuesta pavloviana. [31] Tras la activación repetida por un estímulo, el núcleo accumbens puede activar el estriado dorsal a través de un circuito intraestriatal. La transición de señales del NAc al DS permite que las señales asociadas a la recompensa activen el DS sin que la recompensa en sí esté presente. Esto puede activar los antojos y las conductas de búsqueda de recompensa (y es responsable de desencadenar la recaída durante la abstinencia en la adicción). [32]
Corteza prefrontal
- Las neuronas dopaminérgicas del VTA se proyectan al PFC, activando neuronas glutamatérgicas que se proyectan a muchas otras regiones, incluido el estriado dorsal y el NAc, lo que en última instancia permite que el PFC medie la prominencia y los comportamientos condicionales en respuesta a los estímulos. [32]
- Cabe destacar que la abstinencia de drogas adictivas activa la corteza prefrontal, una proyección glutamatérgica al NAc, que genera fuertes ansias y modula la reanudación de las conductas adictivas resultantes de la abstinencia. La corteza prefrontal también interactúa con el ATV a través de la vía mesocortical y ayuda a asociar las señales ambientales con la recompensa. [32]
Hipocampo
- El hipocampo tiene múltiples funciones, entre ellas la creación y el almacenamiento de recuerdos. En el circuito de recompensa, sirve para los recuerdos contextuales y las señales asociadas. En última instancia, sustenta el restablecimiento de las conductas de búsqueda de recompensa a través de señales y desencadenantes contextuales. [33]
Amígdala
- La amígdala recibe información del VTA y envía sus resultados al NAc. La amígdala es importante para crear recuerdos emocionales potentes y probablemente sustenta la creación de recuerdos fuertes asociados a estímulos. [34] También es importante para mediar los efectos de ansiedad de la abstinencia y el aumento del consumo de drogas en la adicción. [35]
Centros de placer
El placer es un componente de la recompensa, pero no todas las recompensas son placenteras (p. ej., el dinero no provoca placer a menos que esta respuesta esté condicionada). [2] Los estímulos que son naturalmente placenteros y, por lo tanto, atractivos, se conocen como recompensas intrínsecas , mientras que los estímulos que son atractivos y motivan el comportamiento de aproximación, pero no son inherentemente placenteros, se denominan recompensas extrínsecas . [2] Las recompensas extrínsecas (p. ej., el dinero) son gratificantes como resultado de una asociación aprendida con una recompensa intrínseca. [2] En otras palabras, las recompensas extrínsecas funcionan como imanes motivacionales que provocan reacciones de "querer", pero no de "gustar" una vez que se han adquirido. [2]
El sistema de recompensa contiene centros de placer o puntos calientes hedónicos , es decir, estructuras cerebrales que median las reacciones de placer o "gusto" a partir de recompensas intrínsecas. A partir de octubre de 2017, [actualizar]se han identificado puntos calientes hedónicos en subcompartimentos dentro de la capa del núcleo accumbens , el pálido ventral , el núcleo parabranquial , la corteza orbitofrontal (OFC) y la corteza insular . [3] [14] [36] El punto caliente dentro de la capa del núcleo accumbens se encuentra en el cuadrante rostrodorsal de la capa medial, mientras que el punto frío hedónico se encuentra en una región más posterior. El pálido ventral posterior también contiene un punto caliente hedónico, mientras que el pálido ventral anterior contiene un punto frío hedónico. En ratas, las microinyecciones de opioides , endocannabinoides y orexina son capaces de mejorar las reacciones de gusto en estos puntos calientes. [3] Se ha demostrado que los puntos calientes hedónicos ubicados en la corteza orbitofrontal anterior y la ínsula posterior responden a la orexina y los opioides en ratas, al igual que el punto frío hedónico superpuesto en la ínsula anterior y la corteza orbitofrontal posterior. [36] Por otro lado, solo se ha demostrado que el punto caliente del núcleo parabranquial responde a los agonistas del receptor de benzodiazepina. [3]
Los puntos calientes hedónicos están vinculados funcionalmente, en el sentido de que la activación de un punto caliente da como resultado el reclutamiento de los otros, como lo indica la expresión inducida de c-Fos , un gen temprano inmediato . Además, la inhibición de un punto caliente da como resultado la atenuación de los efectos de la activación de otro punto caliente. [3] [36] Por lo tanto, se cree que la activación simultánea de cada punto caliente hedónico dentro del sistema de recompensa es necesaria para generar la sensación de una euforia intensa . [37]
Querer y gustar

La prominencia del incentivo es el atributo de "querer" o "deseo", que incluye un componente motivacional, que la capa del núcleo accumbens (capa NAcc) asigna a un estímulo gratificante. [2] [38] [39] El grado de neurotransmisión de dopamina a la capa NAcc desde la vía mesolímbica está altamente correlacionado con la magnitud de la prominencia del incentivo para los estímulos gratificantes. [38]
La activación de la región dorso-rostral del núcleo accumbens se correlaciona con aumentos en el deseo sin aumentos concurrentes en el gusto. [40] Sin embargo, la neurotransmisión dopaminérgica hacia la capa del núcleo accumbens es responsable no solo de la prominencia motivacional apetitiva (es decir, prominencia de incentivo) hacia estímulos gratificantes, sino también de la prominencia motivacional aversiva, que aleja la conducta de estímulos indeseables. [9] [41] [42] En el cuerpo estriado dorsal, la activación de las MSN que expresan D1 produce prominencia de incentivo apetitivo, mientras que la activación de las MSN que expresan D2 produce aversión. En el NAcc, tal dicotomía no es tan clara, y la activación de las MSN D1 y D2 es suficiente para mejorar la motivación, [43] [44] probablemente a través de la desinhibición del ATV mediante la inhibición del pálido ventral. [45] [46]
La teoría de la sensibilización a los incentivos de Robinson y Berridge de 1993 propuso que la recompensa contiene componentes psicológicos separables: el deseo (incentivo) y el gusto (placer). Para explicar el aumento del contacto con un determinado estímulo, como el chocolate, intervienen dos factores independientes: nuestro deseo de comer el chocolate (deseo) y el efecto placentero del chocolate (gusto). Según Robinson y Berridge, el deseo y el gusto son dos aspectos del mismo proceso, por lo que las recompensas suelen desearse y gustarse en el mismo grado. Sin embargo, el deseo y el gusto también cambian de forma independiente en determinadas circunstancias. Por ejemplo, las ratas que no comen después de recibir dopamina (experimentando una pérdida del deseo de comida) actúan como si todavía les gustara la comida. En otro ejemplo, los electrodos de autoestimulación activados en el hipotálamo lateral de las ratas aumentan el apetito, pero también provocan reacciones más adversas a sabores como el azúcar y la sal; aparentemente, la estimulación aumenta el deseo pero no el gusto. Estos resultados demuestran que el sistema de recompensa de las ratas incluye procesos independientes de deseo y gusto. Se piensa que el componente de deseo está controlado por vías dopaminérgicas , mientras que el componente de gusto está controlado por sistemas opiáceos-GABA-endocannabinoides. [5]
Sistema anti-recompensa
Koobs y Le Moal propusieron que existe un circuito independiente responsable de la atenuación de la conducta de búsqueda de recompensa, al que denominaron circuito anti-recompensa. Este componente actúa como freno del circuito de recompensa, impidiendo así la búsqueda excesiva de comida, sexo, etc. Este circuito involucra múltiples partes de la amígdala (el núcleo del lecho de la estría terminal, el núcleo central), el núcleo accumbens y moléculas señalizadoras, entre ellas la noradrenalina, el factor liberador de corticotropina y la dinorfina. [47] También se ha planteado la hipótesis de que este circuito media los componentes desagradables del estrés, y por lo tanto se piensa que está involucrado en la adicción y la abstinencia. Mientras que el circuito de recompensa media el refuerzo positivo inicial involucrado en el desarrollo de la adicción, es el circuito anti-recompensa el que domina más tarde a través del refuerzo negativo que motiva la búsqueda de los estímulos gratificantes. [48]
Aprendiendo
Los estímulos gratificantes pueden impulsar el aprendizaje tanto en forma de condicionamiento clásico (condicionamiento pavloviano) como de condicionamiento operante (condicionamiento instrumental) . En el condicionamiento clásico, una recompensa puede actuar como un estímulo incondicionado que, cuando se asocia con el estímulo condicionado, hace que el estímulo condicionado provoque respuestas tanto musculoesqueléticas (en forma de conductas simples de aproximación y evitación) como vegetativas. En el condicionamiento operante, una recompensa puede actuar como un reforzador en el sentido de que aumenta o apoya las acciones que conducen a sí misma. [1] Las conductas aprendidas pueden o no ser sensibles al valor de los resultados a los que conducen; las conductas que son sensibles a la contingencia de un resultado en el desempeño de una acción, así como al valor del resultado, están dirigidas a objetivos , mientras que las acciones provocadas que son insensibles a la contingencia o al valor se denominan hábitos . [49] Se cree que esta distinción refleja dos formas de aprendizaje, libre de modelos y basado en modelos. El aprendizaje libre de modelos implica el simple almacenamiento en caché y actualización de valores. Por el contrario, el aprendizaje basado en modelos implica el almacenamiento y la construcción de un modelo interno de eventos que permite la inferencia y la predicción flexible. Aunque generalmente se supone que el condicionamiento pavloviano no tiene modelos, la relevancia del incentivo asignado a un estímulo condicionado es flexible con respecto a los cambios en los estados motivacionales internos. [50]
Distintos sistemas neuronales son responsables del aprendizaje de asociaciones entre estímulos y resultados, acciones y resultados, y estímulos y respuestas. Aunque el condicionamiento clásico no se limita al sistema de recompensa, la mejora del desempeño instrumental mediante estímulos (es decir, transferencia pavloviana-instrumental ) requiere del núcleo accumbens. El aprendizaje instrumental habitual y dirigido a objetivos dependen del estriado lateral y del estriado medial, respectivamente. [49]
Durante el aprendizaje instrumental, se producen cambios opuestos en la proporción de receptores AMPA a NMDA y ERK fosforilada en las MSN de tipo D 1 y tipo D 2 que constituyen las vías directa e indirecta , respectivamente. [51] [52] Estos cambios en la plasticidad sináptica y el aprendizaje que los acompaña dependen de la activación de los receptores D1 y NMDA estriatales. La cascada intracelular activada por los receptores D1 implica el reclutamiento de la proteína quinasa A y, a través de la fosforilación resultante de DARPP-32 , la inhibición de las fosfatasas que desactivan ERK. Los receptores NMDA activan ERK a través de una vía Ras-Raf-MEK-ERK diferente pero interrelacionada . La activación de ERK mediada por NMDA sola es autolimitada, ya que la activación de NMDA también inhibe la inhibición mediada por PKA de las fosfatasas desactivadoras de ERK. Sin embargo, cuando las cascadas D1 y NMDA se coactivan, funcionan sinérgicamente y la activación resultante de ERK regula la plasticidad sináptica en forma de reestructuración de la espina, transporte de receptores AMPA, regulación de CREB y aumento de la excitabilidad celular mediante la inhibición de Kv4.2 . [53] [54] [55]
Trastornos
Adicción
La sobreexpresión de ΔFosB (DeltaFosB), un factor de transcripción genética , en las neuronas espinosas medianas de tipo D1 del núcleo accumbens es el factor común crucial entre prácticamente todas las formas de adicción (es decir, adicciones conductuales y adicciones a las drogas ) que induce el comportamiento relacionado con la adicción y la plasticidad neuronal . [56] [57] [58] [59] En particular, ΔFosB promueve la autoadministración , la sensibilización de la recompensa y los efectos de sensibilización cruzada de la recompensa entre drogas y comportamientos adictivos específicos. [56] [57] [58] [60] [61] También se sabe que ciertas modificaciones epigenéticas de las colas de las proteínas histonas (es decir, modificaciones de las histonas) en regiones específicas del cerebro desempeñan un papel crucial en la base molecular de las adicciones . [59] [62] [63] [64]
Las drogas y conductas adictivas son gratificantes y reforzantes (es decir, son adictivas ) debido a sus efectos sobre la vía de recompensa de la dopamina . [13] [65]
El hipotálamo lateral y el haz prosencéfalo medial han sido los sitios de recompensa de estimulación cerebral estudiados con mayor frecuencia, particularmente en estudios de los efectos de las drogas en la recompensa de estimulación cerebral. [66] El sistema de neurotransmisores que se ha identificado más claramente con las acciones de formación de hábito de las drogas de abuso es el sistema dopaminérgico mesolímbico, con sus objetivos eferentes en el núcleo accumbens y sus aferentes GABAérgicos locales. Las acciones relevantes para la recompensa de la anfetamina y la cocaína están en las sinapsis dopaminérgicas del núcleo accumbens y quizás en la corteza prefrontal medial . Las ratas también aprenden a presionar la palanca para las inyecciones de cocaína en la corteza prefrontal medial, que funciona aumentando el recambio de dopamina en el núcleo accumbens. [67] [68] La nicotina infundida directamente en el núcleo accumbens también mejora la liberación local de dopamina, presumiblemente por una acción presináptica en las terminales dopaminérgicas de esta región. Los receptores nicotínicos se localizan en los cuerpos celulares dopaminérgicos y las inyecciones locales de nicotina aumentan la activación de las células dopaminérgicas que es fundamental para la recompensa nicotínica. [69] [70] Algunas drogas adicionales que crean hábito también es probable que reduzcan la producción de neuronas espinosas medianas como consecuencia, a pesar de activar las proyecciones dopaminérgicas. Para los opiáceos, el sitio de umbral más bajo para los efectos de recompensa involucra acciones en las neuronas GABAérgicas en el área tegmental ventral , un sitio secundario de acciones de recompensa de opiáceos en las neuronas de salida espinosas medianas del núcleo accumbens. Por lo tanto, lo siguiente forma el núcleo del circuito de recompensa de drogas actualmente caracterizado; Aferentes GABAérgicos a las neuronas dopaminérgicas mesolímbicas (sustrato primario de la recompensa opiácea), las propias neuronas dopaminérgicas mesolímbicas (sustrato primario de la recompensa estimulante psicomotora) y eferentes GABAérgicos a las neuronas dopaminérgicas mesolímbicas (un sitio secundario de la recompensa opiácea). [66]
Motivación
La disfuncionalidad de la prominencia motivacional aparece en una serie de síntomas y trastornos psiquiátricos. La anhedonia , tradicionalmente definida como una capacidad reducida para sentir placer, ha sido reexaminada como reflejo de una atenuación de la prominencia de incentivos, ya que la mayoría de las poblaciones anhedónicas exhiben un "gusto" intacto. [71] [72] En el otro extremo del espectro, la prominencia de incentivos aumentada que se reduce para estímulos específicos es característica de las adicciones conductuales y a las drogas. En el caso del miedo o la paranoia, la disfunción puede radicar en una prominencia aversiva elevada . [73] En la literatura moderna, la anhedonia se asocia con las dos formas propuestas de placer, "anticipatorio" y "consumatorio".
Los estudios de neuroimagen en los diagnósticos asociados con anhedonia han informado una actividad reducida en la corteza orbitofrontal y el cuerpo estriado ventral. [74] Un metanálisis informó que la anhedonia estaba asociada con una respuesta neuronal reducida a la anticipación de la recompensa en el núcleo caudado, el putamen, el núcleo accumbens y la corteza prefrontal medial (mPFC). [75]
Trastornos del estado de ánimo
Ciertos tipos de depresión se asocian con una motivación reducida, evaluada por la disposición a realizar un esfuerzo para obtener una recompensa. Estas anomalías se han vinculado tentativamente con una actividad reducida en áreas del cuerpo estriado, y aunque se ha planteado la hipótesis de que las anomalías dopaminérgicas desempeñan un papel, la mayoría de los estudios que investigan la función de la dopamina en la depresión han informado de resultados inconsistentes. [76] [77] Aunque los estudios post mortem y de neuroimagen han encontrado anomalías en numerosas regiones del sistema de recompensa, pocos hallazgos se replican de forma consistente. Algunos estudios han informado de una actividad reducida de la NAcc, el hipocampo, la corteza prefrontal medial (mPFC) y la corteza orbitofrontal (OFC), así como una actividad elevada de la amígdala basolateral y la corteza cingulada subgenual (sgACC) durante tareas relacionadas con la recompensa o los estímulos positivos. Estas anomalías de neuroimagen se complementan con poca investigación post mortem, pero la poca investigación que se ha realizado sugiere una reducción de las sinapsis excitatorias en la mPFC. [78] La actividad reducida en el mPFC durante las tareas relacionadas con la recompensa parece estar localizada en regiones más dorsales (es decir, la corteza cingulada pregenual ), mientras que el sgACC más ventral es hiperactivo en la depresión. [79]
Los intentos de investigar los circuitos neuronales subyacentes en modelos animales también han arrojado resultados contradictorios. Se utilizan habitualmente dos paradigmas para simular la depresión, la derrota social crónica (CSDS) y el estrés crónico leve (CMS), aunque existen muchos. El CSDS produce una preferencia reducida por la sacarosa, interacciones sociales reducidas y una mayor inmovilidad en la prueba de natación forzada. El CMS reduce de forma similar la preferencia por la sacarosa y la desesperación conductual evaluada mediante pruebas de suspensión de la cola y natación forzada. Los animales susceptibles al CSDS muestran una mayor activación fásica del VTA, y la inhibición de las proyecciones VTA-NAcc atenúa los déficits conductuales inducidos por el CSDS. [80] Sin embargo, la inhibición de las proyecciones VTA - mPFC exacerba el aislamiento social. Por otro lado, las reducciones asociadas al CMS en la preferencia por la sacarosa y la inmovilidad fueron atenuadas y exacerbadas por la excitación e inhibición del VTA, respectivamente. [81] [82] Aunque estas diferencias pueden atribuirse a diferentes protocolos de estimulación o paradigmas traduccionales deficientes, los resultados variables también pueden deberse a la funcionalidad heterogénea de las regiones relacionadas con la recompensa. [83]
La estimulación optogenética de la corteza prefrontal medial en su conjunto produce efectos antidepresivos. Este efecto parece estar localizado en el homólogo de la corteza pgACC en roedores (la corteza prelímbica), ya que la estimulación del homólogo de la corteza sgACC en roedores (la corteza infralímbica) no produce efectos conductuales. Además, la estimulación cerebral profunda en la corteza infralímbica, que se cree que tiene un efecto inhibidor, también produce un efecto antidepresivo. Este hallazgo es congruente con la observación de que la inhibición farmacológica de la corteza infralímbica atenúa las conductas depresivas. [83]
Esquizofrenia
La esquizofrenia se asocia con déficits en la motivación, comúnmente agrupados bajo otros síntomas negativos como la reducción del habla espontánea . Con frecuencia se informa que la experiencia de "gustar" está intacta, [84] tanto conductual como neuronalmente, aunque los resultados pueden ser específicos para ciertos estímulos, como las recompensas monetarias. [85] Además, el aprendizaje implícito y las tareas simples relacionadas con la recompensa también están intactas en la esquizofrenia. [86] Más bien, los déficits en el sistema de recompensa son evidentes durante las tareas relacionadas con la recompensa que son cognitivamente complejas. Estos déficits están asociados tanto con la actividad anormal del núcleo estriatal como de la corteza oftálmica, así como con anomalías en las regiones asociadas con funciones cognitivas como la corteza prefrontal dorsolateral (CPDL). [87]
Trastorno por déficit de atención e hiperactividad
En las personas con TDAH , los aspectos centrales del sistema de recompensa están poco activos, lo que dificulta obtener recompensas de las actividades habituales. Las personas con este trastorno experimentan un aumento de la motivación después de que una conducta de alta estimulación desencadena una liberación de dopamina. Después de ese aumento y recompensa, el regreso a los niveles iniciales da como resultado una caída inmediata de la motivación. [88]
Se dice que los deterioros de la función dopaminérgica y serotoninérgica son factores clave en el TDAH. [89] Estos deterioros pueden conducir a disfunción ejecutiva , como desregulación del procesamiento de recompensa y disfunción motivacional, incluida la anhedonia. [90]
Historia
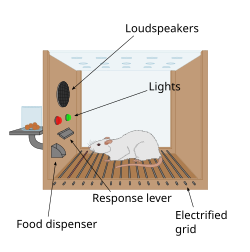
La primera pista sobre la presencia de un sistema de recompensa en el cerebro llegó con un descubrimiento accidental de James Olds y Peter Milner en 1954. Descubrieron que las ratas realizaban comportamientos como presionar una barra, para administrar una breve ráfaga de estimulación eléctrica a sitios específicos en sus cerebros. Este fenómeno se llama autoestimulación intracraneal o recompensa de estimulación cerebral . Por lo general, las ratas presionan una palanca cientos o miles de veces por hora para obtener esta estimulación cerebral, deteniéndose solo cuando están agotadas. Mientras intentaban enseñar a las ratas cómo resolver problemas y correr laberintos, la estimulación de ciertas regiones del cerebro donde se encontraba la estimulación parecía dar placer a los animales. Probaron lo mismo con humanos y los resultados fueron similares. La explicación de por qué los animales se involucran en un comportamiento que no tiene valor para la supervivencia ni de ellos mismos ni de su especie es que la estimulación cerebral está activando el sistema subyacente a la recompensa. [91]
En un descubrimiento fundamental realizado en 1954, los investigadores James Olds y Peter Milner descubrieron que la estimulación eléctrica de bajo voltaje de ciertas regiones del cerebro de la rata actuaba como una recompensa al enseñar a los animales a correr laberintos y resolver problemas. [92] [ verificación fallida ] [93] Parecía que la estimulación de esas partes del cerebro les daba placer a los animales, [92] y en trabajos posteriores los humanos informaron sensaciones placenteras a partir de dicha estimulación. [ cita requerida ] Cuando se probó a las ratas en cajas de Skinner donde podían estimular el sistema de recompensa presionando una palanca, las ratas presionaron durante horas. [93] La investigación en las siguientes dos décadas estableció que la dopamina es una de las principales sustancias químicas que ayudan a la señalización neuronal en estas regiones, y se sugirió que la dopamina era la "sustancia química del placer" del cerebro. [94]
Ivan Pavlov fue un psicólogo que utilizó el sistema de recompensa para estudiar el condicionamiento clásico . Pavlov utilizó el sistema de recompensa recompensando a los perros con comida después de que habían escuchado una campana u otro estímulo. Pavlov recompensaba a los perros de modo que estos asociaran la comida, la recompensa, con la campana, el estímulo. [95] Edward L. Thorndike utilizó el sistema de recompensa para estudiar el condicionamiento operante. Comenzó colocando gatos en una caja de rompecabezas y colocando comida fuera de la caja de modo que el gato quisiera escapar. Los gatos trabajaron para salir de la caja de rompecabezas para llegar a la comida. Aunque los gatos comieron la comida después de escapar de la caja, Thorndike aprendió que los gatos intentaron escapar de la caja sin la recompensa de la comida. Thorndike utilizó las recompensas de la comida y la libertad para estimular el sistema de recompensa de los gatos. Thorndike utilizó esto para ver cómo los gatos aprendían a escapar de la caja. [96] Más recientemente, Ivan De Araujo y sus colegas utilizaron nutrientes dentro del intestino para estimular el sistema de recompensa a través del nervio vago. [97]
Otras especies
Los animales aprenden rápidamente a presionar una barra para obtener una inyección de opiáceos directamente en el tegmento del mesencéfalo o en el núcleo accumbens . Los mismos animales no funcionan para obtener los opiáceos si las neuronas dopaminérgicas de la vía mesolímbica están inactivadas. En esta perspectiva, los animales, al igual que los humanos, realizan conductas que aumentan la liberación de dopamina.
Kent Berridge , un investigador en neurociencia afectiva , descubrió que los sabores dulces ( que agradaban ) y amargos ( que desagradaban ) producían expresiones orofaciales distintas , y estas expresiones se mostraban de manera similar en los recién nacidos humanos, los orangutanes y las ratas. Esto fue evidencia de que el placer (específicamente, el agrado ) tiene características objetivas y era esencialmente el mismo en varias especies animales. La mayoría de los estudios de neurociencia han demostrado que cuanto más dopamina se libera por la recompensa, más efectiva es la recompensa. Esto se llama impacto hedónico, que puede cambiar por el esfuerzo por la recompensa y la recompensa en sí. Berridge descubrió que bloquear los sistemas de dopamina no parecía cambiar la reacción positiva a algo dulce (medida por la expresión facial). En otras palabras, el impacto hedónico no cambiaba en función de la cantidad de azúcar. Esto descartó la suposición convencional de que la dopamina media el placer. Incluso con alteraciones de dopamina más intensas, los datos parecieron permanecer constantes. [98] Sin embargo, un estudio clínico de enero de 2019 que evaluó el efecto de un precursor de la dopamina ( levodopa ), un antagonista ( risperidona ) y un placebo en las respuestas de recompensa a la música, incluido el grado de placer experimentado durante los escalofríos musicales , medido por los cambios en la actividad electrodérmica , así como las calificaciones subjetivas, encontró que la manipulación de la neurotransmisión de dopamina regula bidireccionalmente la cognición del placer (específicamente, el impacto hedónico de la música ) en sujetos humanos. [99] [100] Esta investigación demostró que el aumento de la neurotransmisión de dopamina actúa como una condición sine qua non para las reacciones hedónicas placenteras a la música en humanos. [99] [100]
Berridge desarrolló la hipótesis de la prominencia de los incentivos para abordar el aspecto de deseo de las recompensas. Explica el uso compulsivo de drogas por parte de los drogadictos incluso cuando la droga ya no produce euforia, y los antojos experimentados incluso después de que el individuo haya terminado de pasar por la abstinencia. Algunos adictos responden a ciertos estímulos que implican cambios neuronales causados por las drogas. Esta sensibilización en el cerebro es similar al efecto de la dopamina porque ocurren reacciones de deseo y gusto . Los cerebros y las conductas humanas y animales experimentan cambios similares con respecto a los sistemas de recompensa porque estos sistemas son tan prominentes. [98]
Véase también
Referencias
- ^ abcdefghi Schultz W (2015). "Señales neuronales de recompensa y decisión: de las teorías a los datos". Physiological Reviews . 95 (3): 853–951. doi :10.1152/physrev.00023.2014. PMC 4491543 . PMID 26109341.
Las recompensas en el condicionamiento operante son reforzadores positivos. ... La conducta operante ofrece una buena definición de recompensas. Cualquier cosa que haga que un individuo vuelva a por más es un reforzador positivo y, por lo tanto, una recompensa. Aunque ofrece una buena definición, el refuerzo positivo es solo una de varias funciones de recompensa. ... Las recompensas son atractivas. Son motivadoras y nos hacen hacer un esfuerzo. ... Las recompensas inducen una conducta de aproximación, también llamada conducta apetitiva o preparatoria, conducta sexual y conducta consumatoria. ... Por lo tanto, cualquier estímulo, objeto, evento, actividad o situación que tenga el potencial de hacer que nos acerquemos a ella y la consumamos es, por definición, una recompensa. ... Los estímulos, objetos, eventos, situaciones y actividades gratificantes constan de varios componentes principales. En primer lugar, las recompensas tienen componentes sensoriales básicos (visual, auditivo, somatosensorial, gustativo y olfativo) ... En segundo lugar, las recompensas son salientes y, por lo tanto, provocan atención, que se manifiesta como respuestas de orientación. La relevancia de las recompensas se deriva de tres factores principales, a saber, su intensidad física e impacto (relevancia física), su novedad y sorpresa (relevancia novedad/sorpresa) y su impacto motivacional general compartido con los castigos (relevancia motivacional). Una forma separada no incluida en este esquema, la relevancia de incentivo, aborda principalmente la función de la dopamina en la adicción y se refiere solo a la conducta de aproximación (en oposición al aprendizaje) ... En tercer lugar, las recompensas tienen un componente de valor que determina los efectos motivadores positivos de las recompensas y no está contenido en, ni explicado por, los componentes sensoriales y atencionales. Este componente refleja preferencias conductuales y, por lo tanto, es subjetivo y solo parcialmente determinado por parámetros físicos. Solo este componente constituye lo que entendemos como recompensa. Media el refuerzo conductual específico, la generación de aproximación y los efectos emocionales de las recompensas que son cruciales para la supervivencia y reproducción del organismo, mientras que todos los demás componentes solo apoyan estas funciones. ... Las recompensas también pueden ser intrínsecas a la conducta. Contrastan con las recompensas extrínsecas que proporcionan motivación para la conducta y constituyen la esencia de la conducta operante en pruebas de laboratorio. Las recompensas intrínsecas son actividades que son placenteras por sí mismas y se realizan por sí mismas, sin ser el medio para obtener recompensas extrínsecas. ... Las recompensas intrínsecas son recompensas genuinas por derecho propio, ya que inducen aprendizaje, aproximación y placer, como perfeccionar, tocar y disfrutar del piano. Aunque pueden servir para condicionar recompensas de orden superior, no son recompensas condicionadas de orden superior, ya que la obtención de sus propiedades de recompensa no requiere emparejarse con una recompensa incondicionada. ... Estas emociones también se denominan gusto (por placer) y deseo (por deseo) en la investigación de la adicción y respaldan firmemente las funciones de generación de aprendizaje y aproximación de la recompensa.
- ^ abcdefghijklm Schultz, Wolfram (julio de 2015). "Señales neuronales de recompensa y decisión: de las teorías a los datos". Physiological Reviews . 95 (3): 853–951. doi :10.1152/physrev.00023.2014. PMC 4491543 . PMID 26109341.
- ^ abcdefgh Berridge KC, Kringelbach ML (mayo de 2015). "Sistemas de placer en el cerebro". Neuron . 86 (3): 646–664. doi :10.1016/j.neuron.2015.02.018. PMC 4425246 . PMID 25950633.
En la corteza prefrontal, la evidencia reciente indica que la corteza orbitofrontal OFC y la corteza insular pueden contener cada una sus propios puntos calientes adicionales (DC Castro et al., Soc. Neurosci., resumen). En subregiones específicas de cada área, las microinyecciones estimulantes de opioides o de orexina parecen mejorar la cantidad de reacciones
de gusto
provocadas por el dulzor, de manera similar a los puntos calientes del núcleo accumbens NAc y del pálido ventral VP. La confirmación exitosa de puntos calientes hedónicos en la corteza orbitofrontal o la ínsula sería importante y posiblemente relevante para el sitio orbitofrontal medio anterior mencionado anteriormente que rastrea especialmente el placer subjetivo de los alimentos en los humanos (Georgiadis et al., 2012; Kringelbach, 2005; Kringelbach et al., 2003; Small et al., 2001; Veldhuizen et al., 2010). Finalmente, en el tronco encefálico, un sitio del rombencéfalo cerca del núcleo parabranquial de la protuberancia dorsal también parece capaz de contribuir a las ganancias hedónicas de la función (Söderpalm y Berridge, 2000). Un mecanismo del tronco encefálico para el placer puede parecer más sorprendente que los puntos calientes del prosencéfalo para cualquiera que considere al tronco encefálico como meramente reflexivo, pero el núcleo parabranquial pontino contribuye al gusto, al dolor y a muchas sensaciones viscerales del cuerpo y también se ha sugerido que desempeña un papel importante en la motivación (Wu et al., 2012) y en la emoción humana (especialmente relacionada con la hipótesis del marcador somático) (Damasio, 2010).
- ^ Guo, Rong; Böhmer, Wendelin; Hebart, Martin; Chien, Samson; Sommer, Tobias; Obermayer, Klaus; Gläscher, Jan (14 de diciembre de 2016). "La interacción del aprendizaje instrumental y dirigido a objetivos modula las representaciones de errores de predicción en el estriado ventral". The Journal of Neuroscience . 36 (50). Sociedad de Neurociencia: 12650–12660. doi : 10.1523/jneurosci.1677-16.2016 . ISSN 0270-6474. PMC 6705659 . PMID 27974615.
- ^ abcde Kolb, Bryan; Whishaw, Ian Q. (2001). Introducción al cerebro y la conducta (1.ª ed.). Nueva York: Worth. pp. 438–441. ISBN 9780716751694.
- ^ Brain & Behavior Research Foundation (13 de marzo de 2019). "La biología de la adicción". YouTube .
- ^ "La dopamina está implicada en la agresión". Medical News Today . 15 de enero de 2008. Archivado desde el original el 23 de septiembre de 2010 . Consultado el 14 de noviembre de 2010 .
- ^ Duarte, Isabel C.; Alfonso, Sonia; Jorge, Elena; Cayolla, Ricardo; Ferreira, Carlos; Castelo-Branco, Miguel (1 de mayo de 2017). "Amor tribal: los correlatos neuronales del compromiso apasionado en los aficionados al fútbol". Neurociencia Social Cognitiva y Afectiva . 12 (5): 718–728. doi : 10.1093/scan/nsx003. PMC 5460049 . PMID 28338882.
- ^ abc Salamone, John D.; Correa, Mercè (noviembre de 2012). "Las misteriosas funciones motivacionales de la dopamina mesolímbica". Neuron . 76 (3): 470–485. doi :10.1016/j.neuron.2012.10.021. PMC 4450094 . PMID 23141060.
- ^ abcdefg Yager LM, Garcia AF, Wunsch AM, Ferguson SM (agosto de 2015). "Los entresijos del cuerpo estriado: papel en la adicción a las drogas". Neurociencia . 301 : 529–541. doi :10.1016/j.neuroscience.2015.06.033. PMC 4523218 . PMID 26116518.
[El cuerpo estriado] recibe entradas dopaminérgicas del área tegmental ventral (ATV) y la sustancia negra (SNr) y entradas glutamatérgicas de varias áreas, incluida la corteza, el hipocampo, la amígdala y el tálamo (Swanson, 1982; Phillipson y Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). Estas entradas glutamatérgicas hacen contacto en las cabezas de las espinas dendríticas de las neuronas de proyección espinosa media GABAérgicas (MSN) estriatales, mientras que las entradas dopaminérgicas hacen sinapsis en el cuello de la espina, lo que permite una interacción importante y compleja entre estas dos entradas en la modulación de la actividad de MSN ... También debe notarse que hay una pequeña población de neuronas en el [núcleo accumbens] NAc que coexpresan receptores D1 y D2, aunque esto está en gran medida restringido a la capa NAc (Bertran-González et al., 2008). ... Las neuronas en las subdivisiones del núcleo NAc y la capa NAc también difieren funcionalmente. El núcleo NAc está involucrado en el procesamiento de estímulos condicionados, mientras que la capa NAc es más importante en el procesamiento de estímulos no condicionados; Clásicamente, se piensa que estas dos poblaciones de MSN estriatales tienen efectos opuestos en la salida de los ganglios basales. La activación de las dMSN provoca una excitación neta del tálamo que da como resultado un bucle de retroalimentación cortical positivo; actuando así como una señal de "ir" para iniciar la conducta. Sin embargo, la activación de las iMSN provoca una inhibición neta de la actividad talámica que da como resultado un bucle de retroalimentación cortical negativo y, por lo tanto, sirve como un "freno" para inhibir la conducta... también hay evidencia creciente de que las iMSN desempeñan un papel en la motivación y la adicción (Lobo y Nestler, 2011; Grueter et al., 2013). Por ejemplo, la activación optogenética de las iMSN del núcleo y la cubierta del NAc suprimió el desarrollo de un CPP de cocaína, mientras que la ablación selectiva de las iMSN del núcleo y la cubierta del NAc... mejoró el desarrollo y la persistencia de un CPP de anfetamina (Durieux et al., 2009; Lobo et al., 2010). Estos hallazgos sugieren que las iMSN pueden modular bidireccionalmente la recompensa de la droga. ... En conjunto, estos datos sugieren que las iMSN normalmente actúan para restringir la conducta de consumo de drogas y que el reclutamiento de estas neuronas puede, de hecho, tener un efecto protector contra el desarrollo del consumo compulsivo de drogas.
- ^ Taylor SB, Lewis CR, Olive MF (2013). "El neurocircuito de la adicción a psicoestimulantes ilícitos: efectos agudos y crónicos en humanos". Subst Abuse Rehabil . 4 : 29–43. doi : 10.2147/SAR.S39684 . PMC 3931688 . PMID 24648786.
Las regiones de los ganglios basales, que incluyen el estriado dorsal y ventral, los segmentos internos y externos del globo pálido, el núcleo subtalámico y los cuerpos celulares dopaminérgicos en la sustancia negra, están altamente implicadas no solo en el control motor fino sino también en la función de la CPF [corteza prefrontal].43 De estas regiones, el [núcleo accumbens] NAc (descrito anteriormente) y el [estriado dorsal] DS (descrito a continuación) se examinan con mayor frecuencia con respecto a la adicción. Por lo tanto, aquí sólo se mencionará una breve descripción del papel modulador de los ganglios basales en los circuitos relevantes para la adicción. La salida general de los ganglios basales se realiza predominantemente a través del tálamo, que luego se proyecta de nuevo a la corteza prefrontal para formar bucles corticoestriatal-tálamo-corticales (CSTC). Se propone que tres bucles CSTC modulan la función ejecutiva, la selección de acciones y la inhibición conductual. En el circuito prefrontal dorsolateral, los ganglios basales modulan principalmente la identificación y selección de objetivos, incluidas las recompensas.44 El circuito OFC [corteza orbitofrontal] modula la toma de decisiones y la impulsividad, y el circuito cingulado anterior modula la evaluación de las consecuencias.44 Estos circuitos son modulados por entradas dopaminérgicas del área tegmental ventral [ATV] para guiar en última instancia las conductas relevantes para la adicción, incluida la persistencia y el estrechamiento del repertorio conductual hacia la búsqueda de drogas y el uso continuo de drogas a pesar de las consecuencias negativas.43–45
- ^ Grall-Bronnec M, Sauvaget A (2014). "El uso de estimulación magnética transcraneal repetitiva para modular el antojo y las conductas adictivas: una revisión crítica de la literatura sobre la eficacia, las consideraciones técnicas y metodológicas". Neurosci. Biobehav. Rev. 47 : 592–613. doi : 10.1016/j.neubiorev.2014.10.013 . PMID 25454360.
Los estudios han demostrado que los antojos están respaldados por la activación de los circuitos de recompensa y motivación (McBride et al., 2006, Wang et al., 2007, Wing et al., 2012, Goldman et al., 2013, Jansen et al., 2013 y Volkow et al., 2013). Según estos autores, las principales estructuras neuronales implicadas son: el núcleo accumbens, el estriado dorsal, la corteza orbitofrontal, la corteza cingulada anterior, la corteza prefrontal dorsolateral (CPDL), la amígdala, el hipocampo y la ínsula.
- ^ ab Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 365–366, 376. ISBN 978-0-07-148127-4Los sustratos neuronales que subyacen a la percepción de la recompensa y al
fenómeno del refuerzo positivo son un conjunto de estructuras interconectadas del prosencéfalo llamadas vías de recompensa cerebral; estas incluyen el núcleo accumbens (NAc; el componente principal del estriado ventral), el prosencéfalo basal (componentes del cual se han denominado amígdala extendida, como se analiza más adelante en este capítulo), el hipocampo, el hipotálamo y las regiones frontales de la corteza cerebral. Estas estructuras reciben una rica inervación dopaminérgica del área tegmental ventral (VTA) del mesencéfalo. Las drogas adictivas son gratificantes y reforzantes porque actúan en las vías de recompensa cerebrales para mejorar la liberación de dopamina o los efectos de la dopamina en el NAc o estructuras relacionadas, o porque producen efectos similares a la dopamina. ... Algunos investigadores describen una macroestructura que se postula que integra muchas de las funciones de este circuito como la amígdala extendida. Se dice que la amígdala extendida comprende varias estructuras del prosencéfalo basal que comparten una morfología, características inmunocitoquímicas y conectividad similares y que son muy adecuadas para mediar aspectos de la función de recompensa; estas incluyen el núcleo del lecho de la estría terminal, la amígdala medial central, la cubierta del NAc y la sustancia innominada sublenticular.
- ^ ab Richard JM, Castro DC, Difeliceantonio AG, Robinson MJ, Berridge KC (noviembre de 2013). "Mapeo de los circuitos cerebrales de recompensa y motivación: siguiendo los pasos de Ann Kelley". Neurosci. Biobehav. Rev. 37 ( 9 Pt A): 1919–1931. doi :10.1016/j.neubiorev.2012.12.008. PMC 3706488. PMID 23261404 .
Figura 3: Circuitos neuronales subyacentes al “deseo” motivado y al “gusto” hedónico. - ^ Luo M, Zhou J, Liu Z (agosto de 2015). "Procesamiento de recompensa por el núcleo del rafe dorsal: 5-HT y más allá". Learn. Mem . 22 (9): 452–460. doi :10.1101/lm.037317.114. PMC 4561406. PMID 26286655 .
- ^ Moulton EA, Elman I, Becerra LR, Goldstein RZ, Borsook D (mayo de 2014). "El cerebelo y la adicción: perspectivas obtenidas de la investigación en neuroimagen". Addiction Biology . 19 (3): 317–331. doi :10.1111/adb.12101. PMC 4031616 . PMID 24851284.
- ^ Caligiore D, Pezzulo G, Baldassarre G, Bostan AC, Strick PL, Doya K, Helmich RC, Dirkx M, Houk J, Jörntell H, Lago-Rodríguez A, Galea JM, Miall RC, Popa T, Kishore A, Verschure PF , Zucca R, Herreros I (febrero de 2017). "Documento de consenso: hacia una visión a nivel de sistemas de la función cerebelosa: la interacción entre el cerebelo, los ganglios basales y la corteza". Cerebelo . 16 (1): 203–229. doi :10.1007/s12311-016-0763-3. PMC 5243918 . PMID 26873754.
- ^ Ogawa, SK; Watabe-Uchida, M (2018). "Organización del sistema de dopamina y serotonina: mapeo anatómico y funcional de entradas monosinápticas utilizando el virus de la rabia". Farmacología, bioquímica y comportamiento . 174 : 9–22. doi :10.1016/j.pbb.2017.05.001. PMID 28476484. S2CID 5089422.
- ^ Morales, M; Margolis, EB (febrero de 2017). "Área tegmental ventral: heterogeneidad celular, conectividad y comportamiento". Nature Reviews. Neurociencia . 18 (2): 73–85. doi :10.1038/nrn.2016.165. PMID 28053327. S2CID 10311562.
- ^ Lammel, S; Lim, BK; Malenka, RC (enero de 2014). "Recompensa y aversión en un sistema heterogéneo de dopamina del mesencéfalo". Neurofarmacología . 76 Pt B: 351–9. doi :10.1016/j.neuropharm.2013.03.019. PMC 3778102 . PMID 23578393.
- ^ Nieh, EH; Kim, SY; Namburi, P; Tye, KM (20 de mayo de 2013). "Disección optogenética de circuitos neuronales que subyacen a la valencia emocional y a los comportamientos motivados". Brain Research . 1511 : 73–92. doi :10.1016/j.brainres.2012.11.001. hdl :1721.1/92890. PMC 4099056 . PMID 23142759.
- ^ Trantham-Davidson H, Neely LC, Lavin A, Seamans JK (2004). "Mecanismos subyacentes a la regulación diferencial de la inhibición por parte de los receptores de dopamina D1 y D2 en la corteza prefrontal". The Journal of Neuroscience . 24 (47): 10652–10659. doi :10.1523/jneurosci.3179-04.2004. PMC 5509068 . PMID 15564581.
- ^ You ZB, Chen YQ, Wise RA (2001). "Liberación de dopamina y glutamato en el núcleo accumbens y el área tegmental ventral de la rata tras la autoestimulación hipotalámica lateral". Neurociencia . 107 (4): 629–639. doi :10.1016/s0306-4522(01)00379-7. PMID 11720786. S2CID 33615497.
- ^ ab Castro, DC; Cole, SL; Berridge, KC (2015). "Funciones del hipotálamo lateral, el núcleo accumbens y el pálido ventral en la alimentación y el hambre: interacciones entre los circuitos homeostáticos y de recompensa". Frontiers in Systems Neuroscience . 9 : 90. doi : 10.3389/fnsys.2015.00090 . PMC 4466441 . PMID 26124708.
- ^ Carlezon WA, Jr; Thomas, MJ (2009). "Sustratos biológicos de la recompensa y la aversión: una hipótesis de la actividad del núcleo accumbens". Neurofarmacología . 56 (Supl 1): 122–32. doi :10.1016/j.neuropharm.2008.06.075. PMC 2635333 . PMID 18675281.
- ^ Wise RA, Rompre PP (1989). "Dopamina cerebral y recompensa". Revista Anual de Psicología . 40 : 191–225. doi :10.1146/annurev.ps.40.020189.001203. PMID 2648975.
- ^ Wise RA (octubre de 2002). "Circuitos de recompensa cerebral: perspectivas a partir de incentivos no detectados". Neuron . 36 (2): 229–240. doi : 10.1016/S0896-6273(02)00965-0 . PMID 12383779. S2CID 16547037.
- ^ ab Kokane, SS y Perrotti, LI (2020). Diferencias de sexo y el papel del estradiol en los circuitos de recompensa mesolímbicos y la vulnerabilidad a la adicción a la cocaína y los opiáceos. Frontiers in Behavioral Neuroscience, 14.
- ^ Becker, JB y Chartoff, E. (2019). Diferencias sexuales en los mecanismos neuronales que median la recompensa y la adicción. Neuropsicofarmacología, 44(1), 166-183.
- ^ Stoof, JC y Kebabian, JW (1984). Dos receptores de dopamina: bioquímica, fisiología y farmacología. Ciencias de la vida, 35(23), 2281-2296.
- ^ Yin, HH, Knowlton, BJ y Balleine, BW (2005). El bloqueo de los receptores NMDA en el cuerpo estriado dorsomedial impide el aprendizaje acción-resultado en el condicionamiento instrumental. European Journal of Neuroscience, 22(2), 505-512.
- ^ abc Koob, GF y Volkow, ND (2016). Neurobiología de la adicción: un análisis de los neurocircuitos. The Lancet Psychiatry, 3(8), 760-773.
- ^ Kutlu, MG y Gould, TJ (2016). Efectos de las drogas de abuso en la plasticidad hipocampal y en el aprendizaje y la memoria dependientes del hipocampo: contribuciones al desarrollo y mantenimiento de la adicción. Aprendizaje y memoria, 23(10), 515-533.
- ^ McGaugh, JL (julio de 2004). "La amígdala modula la consolidación de los recuerdos de experiencias emocionalmente estimulantes". Revista Anual de Neurociencia. 27 (1): 1–28.
- ^ Koob GF, Le Moal M. (2008). Adicción y el sistema antirecompensa del cerebro. Annu. Rev. Psychol. 59 29–53. 10.1146/annurev.psych.59.103006.093548 [PubMed] [CrossRef] [Google Scholar] Koob GF, Sanna PP, Bloom FE (1998). Neurociencia de la adicción. Neuron 21 467–476.
- ^ abc Castro, DC; Berridge, KC (24 de octubre de 2017). "Puntos calientes hedónicos de opioides y orexina en la corteza orbitofrontal y la ínsula de ratas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 114 (43): E9125–E9134. Bibcode :2017PNAS..114E9125C. doi : 10.1073/pnas.1705753114 . PMC 5664503 . PMID 29073109.
Aquí, demostramos que las estimulaciones con opioides u orexina en la corteza orbitofrontal y la ínsula mejoran causalmente las reacciones hedónicas de "gusto" por lo dulce y encontramos un tercer sitio cortical donde las mismas estimulaciones neuroquímicas reducen el impacto hedónico positivo.
- ^ Kringelbach ML, Berridge KC (2012). "The Joyful Mind" (PDF) . Scientific American . 307 (2): 44–45. Bibcode :2012SciAm.307b..40K. doi :10.1038/scientificamerican0812-40. PMID 22844850. Archivado desde el original (PDF) el 29 de marzo de 2017 . Consultado el 17 de enero de 2017 .
Por lo tanto, tiene sentido que los verdaderos centros de placer en el cerebro, aquellos directamente responsables de generar sensaciones placenteras, resulten estar dentro de algunas de las estructuras previamente identificadas como parte del circuito de recompensa. Uno de estos llamados puntos calientes hedónicos se encuentra en una subregión del núcleo accumbens llamada capa medial. Un segundo se encuentra dentro del pálido ventral, una estructura profunda cerca de la base del prosencéfalo que recibe la mayoría de sus señales del núcleo accumbens. ...
Por otro lado, la euforia intensa es más difícil de conseguir que los placeres cotidianos. La razón puede ser que un fuerte aumento del placer –como el aumento de placer inducido químicamente que producimos en animales de laboratorio– parece requerir la activación de toda la red a la vez. La defección de un solo componente amortigua el subidón.
No está claro si el circuito del placer –y en particular, el pálido ventral– funciona de la misma manera en los humanos.
- ^ ab Berridge KC (abril de 2012). "Del error de predicción a la prominencia del incentivo: cálculo mesolímbico de la motivación de recompensa". Eur. J. Neurosci . 35 (7): 1124–1143. doi :10.1111/j.1460-9568.2012.07990.x. PMC 3325516 . PMID 22487042.
Aquí analizo cómo los mecanismos mesocorticolímbicos generan el componente de motivación de la prominencia del incentivo. La prominencia del incentivo toma el aprendizaje y la memoria pavlovianos como una entrada y, como una entrada igualmente importante, toma factores de estado neurobiológicos (por ejemplo, estados de drogas, estados de apetito, estados de saciedad) que pueden variar independientemente del aprendizaje. Los cambios de estado neurobiológico pueden producir fluctuaciones no aprendidas o incluso reversiones en la capacidad de una señal de recompensa previamente aprendida para desencadenar la motivación. Tales fluctuaciones en la motivación desencadenada por señales pueden alejarse dramáticamente de todos los valores previamente aprendidos sobre el resultado de recompensa asociado. ... El aprendizaje asociativo y la predicción son contribuyentes importantes a la motivación para las recompensas. El aprendizaje da valor de incentivo a señales arbitrarias como un estímulo condicionado pavloviano (EC) que está asociado con una recompensa (estímulo incondicionado o ECU). Las señales aprendidas para la recompensa son a menudo potentes desencadenantes de deseos. Por ejemplo, las señales aprendidas pueden desencadenar apetitos normales en todos, y a veces pueden desencadenar impulsos compulsivos y recaídas en adictos.
'Querer' desencadenado por señales para el ECU
Un breve encuentro de EC (o breve encuentro ECU) a menudo prepara un pulso de motivación elevada para obtener y consumir más ECU de recompensa. Esta es una característica distintiva de la saliencia de incentivo.
Señales como imanes motivacionales atractivos
Cuando a un EC+ pavloviano se le atribuye saliencia de incentivo, no solo desencadena el 'querer' por su ECU, sino que a menudo la señal en sí misma se vuelve altamente atractiva, incluso en un grado irracional. Esta atracción de señales es otra característica distintiva de la saliencia de incentivos... A menudo son visibles dos características reconocibles de la saliencia de incentivos que se pueden usar en experimentos de neurociencia: (i) "deseo" dirigido por UCS: pulsos desencadenados por EC de "deseo" intensificado por la recompensa UCS; y (ii) "deseo" dirigido por EC: atracción motivada a la señal pavloviana, que convierte el estímulo arbitrario de EC en un imán motivacional.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 147-148, 367, 376. ISBN 978-0-07-148127-4Las neuronas DA del VTA
desempeñan un papel fundamental en la motivación, la conducta relacionada con la recompensa (Capítulo 15), la atención y múltiples formas de memoria. Esta organización del sistema DA, amplia proyección desde un número limitado de cuerpos celulares, permite respuestas coordinadas a nuevas y potentes recompensas. Así, actuando en diversos campos terminales, la dopamina confiere prominencia motivacional ("deseo") a la recompensa misma o a las señales asociadas (región de la corteza del núcleo accumbens), actualiza el valor asignado a diferentes metas a la luz de esta nueva experiencia (corteza prefrontal orbital), ayuda a consolidar múltiples formas de memoria (amígdala e hipocampo) y codifica nuevos programas motores que facilitarán la obtención de esta recompensa en el futuro (región central del núcleo accumbens y estriado dorsal). En este ejemplo, la dopamina modula el procesamiento de la información sensoriomotora en diversos circuitos neuronales para maximizar la capacidad del organismo de obtener futuras recompensas. ...
El circuito de recompensa cerebral que es el objetivo de las drogas adictivas normalmente media el placer y el fortalecimiento de las conductas asociadas con reforzadores naturales, como la comida, el agua y el contacto sexual. Las neuronas dopaminérgicas en el ATV se activan con la comida y el agua, y la liberación de dopamina en el NAc es estimulada por la presencia de reforzadores naturales, como la comida, el agua o una pareja sexual. ...
El NAc y el ATV son componentes centrales del circuito subyacente a la recompensa y la memoria de la recompensa. Como se mencionó anteriormente, la actividad de las neuronas dopaminérgicas en el ATV parece estar vinculada a la predicción de la recompensa. El NAc está involucrado en el aprendizaje asociado con el refuerzo y la modulación de las respuestas motoras a los estímulos que satisfacen las necesidades homeostáticas internas. La cubierta del NAc parece ser particularmente importante para las acciones iniciales de la droga dentro del circuito de recompensa; las drogas adictivas parecen tener un mayor efecto en la liberación de dopamina en la cubierta que en el núcleo del NAc. - ^ Berridge KC, Kringelbach ML (1 de junio de 2013). "Neurociencia del afecto: mecanismos cerebrales del placer y el displacer". Current Opinion in Neurobiology . 23 (3): 294–303. doi :10.1016/j.conb.2013.01.017. PMC 3644539 . PMID 23375169.
Por ejemplo, resulta que la dopamina mesolímbica, probablemente el candidato a neurotransmisor cerebral más popular para el placer hace dos décadas, no causa placer ni agrado en absoluto. Más bien, la dopamina media de manera más selectiva un proceso motivacional de prominencia de incentivos, que es un mecanismo para desear recompensas pero no para que les agraden... Más bien, la estimulación con opioides tiene la capacidad especial de mejorar el agrado solo si la estimulación ocurre dentro de un punto anatómico clave.
- ^ Calipari, Erin S.; Bagot, Rosemary C.; Purushothaman, Immanuel; Davidson, Thomas J.; Yorgason, Jordan T.; Peña, Catherine J.; Walker, Deena M.; Pirpinias, Stephen T.; Guise, Kevin G.; Ramakrishnan, Charu; Deisseroth, Karl; Nestler, Eric J. (8 de marzo de 2016). "La imagenología in vivo identifica la firma temporal de las neuronas espinosas medianas D1 y D2 en la recompensa de la cocaína". Actas de la Academia Nacional de Ciencias . 113 (10): 2726–2731. Bibcode :2016PNAS..113.2726C. doi : 10.1073/pnas.1521238113 . PMC 4791010 . PMID 26831103.
- ^ Baliki, MN; Mansour, A.; Baria, AT; Huang, L.; Berger, SE; Fields, HL; Apkarian, AV (9 de octubre de 2013). "La división de los accumbens humanos en un núcleo y una envoltura putativos disocia la codificación de valores para la recompensa y el dolor". Journal of Neuroscience . 33 (41): 16383–16393. doi :10.1523/JNEUROSCI.1731-13.2013. PMC 3792469 . PMID 24107968.
- ^ Soares-Cunha, Carina; Coímbra, Bárbara; Sousa, Nuño; Rodrigues, Ana J. (septiembre de 2016). "Reevaluación de las neuronas D1 y D2 del cuerpo estriado en recompensa y aversión". Reseñas de neurociencia y biocomportamiento . 68 : 370–386. doi :10.1016/j.neubiorev.2016.05.021. hdl : 1822/47044 . PMID 27235078. S2CID 207092810.
- ^ Bamford, Nigel S.; Wightman, R. Mark; Sulzer, David (febrero de 2018). "Efectos de la dopamina en las sinapsis corticoestriatales durante conductas basadas en recompensas". Neuron . 97 (3): 494–510. doi :10.1016/j.neuron.2018.01.006. PMC 5808590 . PMID 29420932.
- ^ Soares-Cunha, Carina; Coímbra, Bárbara; David-Pereira, Ana; Borges, Sonia; Pinto, Luisa; Costa, Patricio; Sousa, Nuño; Rodrigues, Ana J. (septiembre de 2016). "La activación de las neuronas que expresan el receptor de dopamina D2 en el núcleo accumbens aumenta la motivación". Comunicaciones de la naturaleza . 7 (1): 11829. Código bibliográfico : 2016NatCo...711829S. doi : 10.1038/ncomms11829. PMC 4931006 . PMID 27337658.
- ^ Soares-Cunha, Carina; Coímbra, Bárbara; Domingues, Ana Verónica; Vasconcelos, Nivaldo; Sousa, Nuño; Rodrigues, Ana João (marzo de 2018). "Microcircuito Nucleus Accumbens subyacente al aumento de la motivación impulsado por D2-MSN". eNeuro . 5 (2): ENEURO.0386–18.2018. doi :10.1523/ENEURO.0386-18.2018. PMC 5957524 . PMID 29780881.
- ^ Koob GF, Le Moal M. (2008). Adicción y el sistema antirrecompensa del cerebro. Annu. Rev. Psychol. 59 29–53. 10.1146/annurev.psych.59.103006.093548 [PubMed] [CrossRef] [Google Scholar] Koob GF, Sanna PP, Bloom FE (1998). Neurociencia de la adicción. Neuron 21 467–476
- ^ Meyer, JS y Quenzer, LF (2013). Psicofarmacología: fármacos, cerebro y comportamiento. Sinauer Associates.
- ^ ab Yin, HH; Ostlund, SB; Balleine, BW (octubre de 2008). "Aprendizaje guiado por recompensas más allá de la dopamina en el núcleo accumbens: las funciones integradoras de las redes de ganglios corticobasales". The European Journal of Neuroscience . 28 (8): 1437–48. doi :10.1111/j.1460-9568.2008.06422.x. PMC 2756656 . PMID 18793321.
- ^ Dayan, P; Berridge, KC (junio de 2014). "Aprendizaje pavloviano basado en modelos y libre de modelos: reevaluación, revisión y revelación". Neurociencia cognitiva, afectiva y conductual . 14 (2): 473–92. doi :10.3758/s13415-014-0277-8. PMC 4074442 . PMID 24647659.
- ^ Balleine, BW; Morris, RW; Leung, BK (2 de diciembre de 2015). "Integración talamocortical del aprendizaje y el rendimiento instrumental y su desintegración en la adicción". Brain Research . 1628 (Pt A): 104–16. doi :10.1016/j.brainres.2014.12.023. PMID 25514336. S2CID 11776683.
Es importante destacar que encontramos evidencia de una mayor actividad en la vía directa; tanto los cambios intracelulares en la expresión del marcador de plasticidad pERK como las proporciones AMPA/NMDA evocadas por la estimulación de las aferencias corticales aumentaron en las neuronas de la vía directa D1. Por el contrario, las neuronas D2 mostraron un cambio opuesto en la plasticidad; la estimulación de las aferencias corticales redujo las proporciones AMPA/NMDA en esas neuronas (Shan et al., 2014).
- ^ Nakanishi, S; Hikida, T; Yawata, S (12 de diciembre de 2014). "Control dopaminérgico distinto de las vías directas e indirectas en conductas de aprendizaje basadas en la recompensa y la evitación". Neurociencia . 282 : 49–59. doi :10.1016/j.neuroscience.2014.04.026. PMID 24769227. S2CID 21652525.
- ^ Shiflett, MW; Balleine, BW (15 de septiembre de 2011). "Sustratos moleculares del control de la acción en circuitos corticoestriatales". Progress in Neurobiology . 95 (1): 1–13. doi :10.1016/j.pneurobio.2011.05.007. PMC 3175490 . PMID 21704115.
- ^ Schultz, W (abril de 2013). "Actualización de las señales de recompensa de la dopamina". Current Opinion in Neurobiology . 23 (2): 229–38. doi :10.1016/j.conb.2012.11.012. PMC 3866681 . PMID 23267662.
- ^ Shiflett, MW; Balleine, BW (17 de marzo de 2011). "Contribuciones de la señalización ERK en el cuerpo estriado al aprendizaje y el rendimiento instrumental". Behavioural Brain Research . 218 (1): 240–7. doi :10.1016/j.bbr.2010.12.010. PMC 3022085 . PMID 21147168.
- ^ ab Nestler EJ (diciembre de 2013). "Base celular de la memoria para la adicción". Dialogues Clin. Neurosci . 15 (4): 431–443. doi :10.31887/DCNS.2013.15.4/enestler. PMC 3898681 . PMID 24459410.
- ^ ab Ruffle JK (noviembre de 2014). "Neurobiología molecular de la adicción: ¿de qué se trata todo el (Δ)FosB?". Am. J. Drug Alcohol Abuse . 40 (6): 428–437. doi :10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
La fuerte correlación entre la exposición crónica a drogas y ΔFosB ofrece nuevas oportunidades para terapias dirigidas en la adicción (118) y sugiere métodos para analizar su eficacia (119). Durante las últimas dos décadas, la investigación ha progresado desde la identificación de la inducción de ΔFosB hasta la investigación de su acción posterior (38). Es probable que la investigación de ΔFosB avance ahora hacia una nueva era: el uso de ΔFosB como biomarcador. ...
Conclusiones
ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción después de la exposición repetida a drogas. La formación de ΔFosB en múltiples regiones cerebrales y la vía molecular que conduce a la formación de complejos AP-1 son bien conocidas. El establecimiento de un propósito funcional para ΔFosB ha permitido una mayor determinación de algunos de los aspectos clave de sus cascadas moleculares, que involucran efectores como GluR2 (87,88), Cdk5 (93) y NFkB (100). Además, muchos de estos cambios moleculares identificados ahora están directamente relacionados con los cambios estructurales, fisiológicos y conductuales observados después de la exposición crónica a drogas (60,95,97,102). Los estudios epigenéticos han abierto nuevas fronteras de investigación que investigan los roles moleculares de ΔFosB, y los avances recientes han ilustrado el papel de ΔFosB actuando sobre el ADN y las histonas, realmente como un
interruptor molecular
(34). Como consecuencia de nuestra mejor comprensión de ΔFosB en la adicción, es posible evaluar el potencial adictivo de los medicamentos actuales (119), así como utilizarlo como un biomarcador para evaluar la eficacia de las intervenciones terapéuticas (121,122,124). Algunas de estas intervenciones propuestas tienen limitaciones (125) o están en sus primeras etapas (75). Sin embargo, se espera que algunos de estos hallazgos preliminares puedan conducir a tratamientos innovadores, que son muy necesarios en la adicción.
- ^ ab Olsen CM (diciembre de 2011). "Recompensas naturales, neuroplasticidad y adicciones no relacionadas con las drogas". Neurofarmacología . 61 (7): 1109–1122. doi :10.1016/j.neuropharm.2011.03.010. PMC 3139704 . PMID 21459101.
Estudios de neuroimagen funcional en humanos han demostrado que los juegos de azar (Breiter et al, 2001), las compras (Knutson et al, 2007), el orgasmo (
Komisaruk
et al, 2004), los videojuegos (Koepp et al, 1998; Hoeft et al, 2008) y la visión de comida apetitosa (Wang et al, 2004a) activan muchas de las mismas regiones cerebrales (es decir, el sistema mesocorticolímbico y la amígdala extendida) que las drogas de abuso (Volkow et al, 2004). ... La sensibilización cruzada también es bidireccional, ya que un historial de administración de anfetaminas facilita el comportamiento sexual y mejora el aumento asociado en NAc DA ... Como se describió para la recompensa de comida, la experiencia sexual también puede conducir a la activación de cascadas de señalización relacionadas con la plasticidad. El factor de transcripción delta FosB aumenta en el NAc, PFC, estriado dorsal y VTA después de una conducta sexual repetida (Wallace et al., 2008; Pitchers et al., 2010b). Este aumento natural de delta FosB o la sobreexpresión viral de delta FosB dentro del NAc modula el rendimiento sexual, y el bloqueo delta FosB por parte del NAc atenúa esta conducta (Hedges et al, 2009; Pitchers et al., 2010b). Además, la sobreexpresión viral de delta FosB mejora la preferencia condicionada por un lugar en un entorno emparejado con la experiencia sexual (Hedges et al., 2009). ... En algunas personas, hay una transición de la "normalidad" a la participación compulsiva en recompensas naturales (como la comida o el sexo), una condición que algunos han denominado adicciones conductuales o no relacionadas con las drogas (Holden, 2001; Grant et al., 2006a). ... En los seres humanos, el papel de la señalización de la dopamina en los procesos de sensibilización a los incentivos ha sido puesto de relieve recientemente por la observación de un síndrome de desregulación de la dopamina en algunos pacientes que toman fármacos dopaminérgicos. Este síndrome se caracteriza por un aumento inducido por la medicación (o una participación compulsiva) en recompensas no relacionadas con los fármacos, como el juego, las compras o el sexo (Evans et al, 2006; Aiken, 2007; Lader, 2008)."
Tabla 1: Resumen de la plasticidad observada tras la exposición a fármacos o reforzadores naturales - ^ ab Biliński P, Wojtyła A, Kapka-Skrzypczak L, Chwedorowicz R, Cyranka M, Studziński T (2012). "Regulación epigenética en la adicción a las drogas". Ann. Agric. Environ. Med . 19 (3): 491–496. PMID 23020045.
Por estas razones, ΔFosB se considera un factor de transcripción primario y causal en la creación de nuevas conexiones neuronales en el centro de recompensa, la corteza prefrontal y otras regiones del sistema límbico. Esto se refleja en el nivel aumentado, estable y duradero de sensibilidad a la cocaína y otras drogas, y la tendencia a la recaída incluso después de largos períodos de abstinencia. Estas redes de nueva construcción funcionan de manera muy eficiente a través de nuevas vías tan pronto como se consumen más drogas de abuso... De esta manera, la inducción de la expresión del gen CDK5 se produce junto con la supresión del gen G9A que codifica para la dimetiltransferasa que actúa sobre la histona H3. Se puede observar un mecanismo de retroalimentación en la regulación de estos 2 factores cruciales que determinan la respuesta epigenética adaptativa a la cocaína. Esto depende de que ΔFosB inhiba la expresión del gen G9a, es decir, la síntesis de H3K9me2 que a su vez inhibe los factores de transcripción para ΔFosB. Por esta razón, la hiperexpresión observada de G9a, que asegura altos niveles de la forma dimetilada de la histona H3, elimina los efectos estructurales y de plasticidad neuronal causados por la cocaína mediante esta retroalimentación que bloquea la transcripción de ΔFosB.
- ^ Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (febrero de 2013). "Las recompensas naturales y de drogas actúan sobre mecanismos comunes de plasticidad neuronal con ΔFosB como mediador clave". The Journal of Neuroscience . 33 (8): 3434–3442. doi :10.1523/JNEUROSCI.4881-12.2013. PMC 3865508 . PMID 23426671.
Las drogas de abuso inducen neuroplasticidad en la vía de recompensa natural, específicamente el núcleo accumbens (NAc), lo que provoca el desarrollo y la expresión de la conducta adictiva. ... En conjunto, estos hallazgos demuestran que las drogas de abuso y las conductas de recompensa natural actúan sobre mecanismos moleculares y celulares comunes de plasticidad que controlan la vulnerabilidad a la adicción a las drogas, y que esta mayor vulnerabilidad está mediada por ΔFosB y sus objetivos transcripcionales posteriores. ... La conducta sexual es altamente gratificante (Tenk et al., 2009), y la experiencia sexual provoca conductas relacionadas con la droga que sensibilizan, incluyendo la sensibilización cruzada a la actividad locomotora inducida por la anfetamina (Amph) (Bradley y Meisel, 2001; Pitchers et al., 2010a) y una mayor recompensa por Amph (Pitchers et al., 2010a). Además, la experiencia sexual induce plasticidad neuronal en el NAc similar a la inducida por la exposición a psicoestimulantes, incluyendo una mayor densidad de espinas dendríticas (Meisel y Mullins, 2006; Pitchers et al., 2010a), tráfico de receptores de glutamato alterado y una menor fuerza sináptica en las neuronas de la capa del NAc que responden a la corteza prefrontal (Pitchers et al., 2012). Por último, se descubrió que los períodos de abstinencia de la experiencia sexual eran críticos para aumentar la recompensa Amph, la espinogénesis NAc (Pitchers et al., 2010a) y el tráfico del receptor de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa naturales y farmacológicas comparten mecanismos comunes de plasticidad neuronal.
- ^ Beloate LN, Weems PW, Casey GR, Webb IC, Coolen LM (febrero de 2016). "La activación del receptor NMDA del núcleo accumbens regula la sensibilización cruzada a las anfetaminas y la expresión de deltaFosB tras la experiencia sexual en ratas macho". Neurofarmacología . 101 : 154–164. doi :10.1016/j.neuropharm.2015.09.023. PMID 26391065. S2CID 25317397.
- ^ Robison AJ, Nestler EJ (noviembre de 2011). "Mecanismos transcripcionales y epigenéticos de la adicción". Nat. Rev. Neurosci . 12 (11): 623–637. doi :10.1038/nrn3111. PMC 3272277 . PMID 21989194.
ΔFosB actúa como una de las proteínas de control maestras que gobiernan esta plasticidad estructural. ... ΔFosB también reprime la expresión de G9a, lo que conduce a una reducción de la metilación represiva de histonas en el gen cdk5. El resultado neto es la activación del gen y el aumento de la expresión de CDK5. ... Por el contrario, ΔFosB se une al gen
c-fos
y recluta varios correpresores, incluidos HDAC1 (histona desacetilasa 1) y SIRT 1 (sirtuina 1). ... El resultado neto es la represión del gen
c-fos
.
Figura 4: Base epigenética de la regulación de la expresión genética por fármacos - ^ Hitchcock LN, Lattal KM (2014). "Epigenética mediada por histonas en la adicción". Epigenética y neuroplasticidad: evidencia y debate . Progreso en biología molecular y ciencia traslacional. Vol. 128. págs. 51–87. doi :10.1016/B978-0-12-800977-2.00003-6. ISBN . 9780128009772. PMC 5914502 . PMID 25410541.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Walker DM, Nestler EJ (2018). "Neuroepigenética y adicción". Neurogenética, parte II . Manual de neurología clínica. Vol. 148. págs. 747–765. doi :10.1016/B978-0-444-64076-5.00048-X. ISBN 9780444640765. PMC 5868351 . PMID 29478612.
- ^ Rang HP (2003). Farmacología . Edimburgo: Churchill Livingstone. pág. 596. ISBN. 978-0-443-07145-4.
- ^ ab Roy A. Wise, Activación de las vías de recompensa cerebral por fármacos, Drug and Alcohol Dependence 1998; 51 13–22.
- ^ Goeders NE, Smith JE (1983). "Participación dopaminérgica cortical en el refuerzo de la cocaína". Science . 221 (4612): 773–775. Bibcode :1983Sci...221..773G. doi :10.1126/science.6879176. PMID 6879176.
- ^ Goeders NE, Smith JE (1993). "La autoadministración intracraneal de cocaína en la corteza prefrontal medial aumenta el recambio de dopamina en el núcleo accumbens". J. Pharmacol. Exp. Ther . 265 (2): 592–600. PMID 8496810.
- ^ Clarke, Hommer DW; Pert A.; Skirboll LR (1985). "Acciones electrofisiológicas de la nicotina en unidades individuales de la sustancia negra". Br. J. Pharmacol . 85 (4): 827–835. doi :10.1111/j.1476-5381.1985.tb11081.x. PMC 1916681 . PMID 4041681.
- ^ Westfall, Thomas C.; Grant, Heather; Perry, Holly (enero de 1983). "Liberación de dopamina y 5-hidroxitriptamina de cortes del cuerpo estriatal de ratas tras la activación de los receptores colinérgicos nicotínicos". Farmacología general: el sistema vascular . 14 (3): 321–325. doi :10.1016/0306-3623(83)90037-x. PMID 6135645.
- ^ Rømer Thomsen, K; Whybrow, PC; Kringelbach, ML (2015). "Reconceptualización de la anhedonia: nuevas perspectivas para equilibrar las redes de placer en el cerebro humano". Frontiers in Behavioral Neuroscience . 9 : 49. doi : 10.3389/fnbeh.2015.00049 . PMC 4356228 . PMID 25814941.
- ^ Thomsen, KR (2015). "Medición de la anhedonia: deterioro de la capacidad para buscar, experimentar y aprender sobre la recompensa". Frontiers in Psychology . 6 : 1409. doi : 10.3389/fpsyg.2015.01409 . PMC 4585007 . PMID 26441781.
- ^ Olney, JJ; Warlow, SM; Naffziger, EE; Berridge, KC (agosto de 2018). "Perspectivas actuales sobre la relevancia de los incentivos y aplicaciones a los trastornos clínicos". Current Opinion in Behavioral Sciences . 22 : 59–69. doi :10.1016/j.cobeha.2018.01.007. PMC 5831552 . PMID 29503841.
- ^ Preda, Adrian (2014). "Correlaciones de la anhedonia en las imágenes cerebrales". En Ritsner, Michael (ed.). Anhedonia: un manual completo . Dordrecht: Springer Netherlands. ISBN 978-94-017-8590-7.
- ^ Zhang, B; Lin, P; Shi, H; Öngür, D; Auerbach, RP; Wang, X; Yao, S; Wang, X (septiembre de 2016). "Mapeo de la disfunción específica de la anhedonia en un enfoque transdiagnóstico: un metaanálisis de ALE". Imágenes cerebrales y comportamiento . 10 (3): 920–39. doi :10.1007/s11682-015-9457-6. PMC 4838562 . PMID 26487590.
- ^ Treadway, Michael, T. (2016). "La neurobiología de los déficits motivacionales en la depresión: una actualización sobre los posibles mecanismos patológicos". En Simpson, Eleanor H.; Balsam, Peter D. (eds.). Neurociencia conductual de la motivación (Temas actuales en neurociencias conductuales) (1.ª ed.). Suiza: Springer International Publishing. p. 343. ISBN 978-3-319-26933-7En una literatura relativamente reciente ,
los estudios de motivación y refuerzo en la depresión han sido en gran medida consistentes en detectar diferencias en comparación con los controles sanos (Whitton et al. 2015). En varios estudios que utilizaron la tarea de gasto de esfuerzo por recompensa (EEfRT), los pacientes con TDM dedicaron menos esfuerzo por las recompensas en comparación con los controles (Treadway et al. 2012; Yang et al. 2014)
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Salamone, JD; Yohn, SE; López-Cruz, L; San Miguel, N; Correa, M (mayo de 2016). "Aspectos de la motivación relacionados con la activación y el esfuerzo: mecanismos neuronales e implicaciones para la psicopatología". Brain: A Journal of Neurology . 139 (Pt 5): 1325–47. doi :10.1093/brain/aww050. PMC 5839596 . PMID 27189581.
- ^ Russo, SJ; Nestler, EJ (septiembre de 2013). "El circuito de recompensa del cerebro en los trastornos del estado de ánimo". Nature Reviews. Neuroscience . 14 (9): 609–25. doi :10.1038/nrn3381. PMC 3867253 . PMID 23942470.
- ^ Treadway, MT; Zald, DH (enero de 2011). "Reconsiderando la anhedonia en la depresión: lecciones de la neurociencia traslacional". Neuroscience and Biobehavioral Reviews . 35 (3): 537–55. doi :10.1016/j.neubiorev.2010.06.006. PMC 3005986 . PMID 20603146.
- ^ Walsh, JJ; Han, MH (12 de diciembre de 2014). "La heterogeneidad de las neuronas del área tegmental ventral: funciones de proyección en un contexto relacionado con el estado de ánimo". Neurociencia . 282 : 101–8. doi :10.1016/j.neuroscience.2014.06.006. PMC 4339667 . PMID 24931766.
- ^ Lammel, S; Lim, BK; Malenka, RC (enero de 2014). "Recompensa y aversión en un sistema heterogéneo de dopamina del mesencéfalo". Neurofarmacología . 76 Pt B: 351–9. doi :10.1016/j.neuropharm.2013.03.019. PMC 3778102 . PMID 23578393.
- ^ Knowland, D; Lim, BK (5 de enero de 2018). "Marcos basados en circuitos de conductas depresivas: el papel de los circuitos de recompensa y más allá". Farmacología, bioquímica y comportamiento . 174 : 42–52. doi : 10.1016/j.pbb.2017.12.010. PMC 6340396. PMID 29309799.
- ^ ab Lammel, S; Tye, KM; Warden, MR (enero de 2014). "Progreso en la comprensión de los trastornos del estado de ánimo: disección optogenética de circuitos neuronales". Genes, cerebro y comportamiento . 13 (1): 38–51. doi : 10.1111/gbb.12049 . PMID 23682971. S2CID 18542868.
- ^ Bucci, P; Galderisi, S (mayo de 2017). "Categorización y evaluación de los síntomas negativos". Current Opinion in Psychiatry . 30 (3): 201–208. doi :10.1097/YCO.0000000000000322. PMID 28212174. S2CID 9923114.
También proporcionan una evaluación separada de la anhedonia consumatoria (experiencia reducida de placer derivada de actividades placenteras en curso) y la anhedonia anticipatoria (capacidad reducida para anticipar el placer futuro). De hecho, la primera parece estar relativamente intacta en la esquizofrenia, mientras que la segunda parece estar alterada [32 – 34]. Sin embargo, también se han publicado datos discrepantes [35].
- ^ Young, Anticevic y Barch 2018, p. 215a,"Varias revisiones recientes (por ejemplo, Cohen y Minor, 2010) han descubierto que las personas con esquizofrenia muestran respuestas emocionales autoinformadas relativamente intactas a los estímulos que provocan afecto, así como otros indicadores de respuesta intacta... Un panorama más mixto surge de los estudios de neuroimagen funcional que examinan las respuestas cerebrales a otros tipos de estímulos placenteros en la esquizofrenia (Paradiso et al., 2003)"
- ^ Young, Anticevic y Barch 2018, p. 215b,"Por ello, es sorprendente que los estudios conductuales hayan sugerido que el aprendizaje de refuerzo está intacto en la esquizofrenia cuando el aprendizaje es relativamente implícito (aunque, véase Siegert et al., 2008 para evidencia de un aprendizaje deficiente en la tarea de tiempo de reacción serial), pero más deteriorado cuando se necesitan representaciones explícitas de contingencias de estímulo-recompensa (véase Gold et al., 2008). Este patrón ha dado lugar a la teoría de que el sistema de aprendizaje de refuerzo gradual mediado estriatalmente puede estar intacto en la esquizofrenia, mientras que los sistemas de aprendizaje más rápidos, en línea y mediados corticalmente están deteriorados".
- ^ Young, Anticevic y Barch 2018, p. 216, "Recientemente hemos demostrado que las personas con esquizofrenia pueden mostrar un mejor desempeño en el control cognitivo cuando la información sobre las recompensas se presenta externamente, pero no cuando deben mantenerse internamente (Mann et al., 2013), con cierta evidencia de deterioro en la corteza prefrontal dorsolateral y la activación estriatal durante el mantenimiento interno de la información de recompensa que se asocia con las diferencias de motivación de los individuos (Chung y Barch, 2016)".
- ^ Littman, Ph.D., Ellen (febrero de 2017). "¿Nunca es suficiente? Por qué los cerebros con TDAH anhelan estimulación". Revista ADDditude . New Hope Media LLC . Consultado el 27 de mayo de 2021 .
- ^ Chandler DJ, Waterhouse BD, Gao WJ (mayo de 2014). "Nuevas perspectivas sobre la regulación catecolaminérgica de los circuitos ejecutivos: evidencia de modulación independiente de las funciones prefrontales por neuronas dopaminérgicas y noradrenérgicas del mesencéfalo". Frontiers in Neural Circuits . 8 : 53. doi : 10.3389/fncir.2014.00053 . PMC 4033238 . PMID 24904299.
- ^ Blum, Kenneth; Chen, Amanda Lih-Chuan; Braverman, Eric R; Comings, David E; Chen, Thomas JH; Arcuri, Vanessa; Blum, Seth H; Downs, Bernard W; Waite, Roger L; Notaro, Alison; Lubar, Joel; Williams, Lonna; Prihoda, Thomas J; Palomo, Tomas; Oscar-Berman, Marlene (octubre de 2008). "Trastorno por déficit de atención e hiperactividad y síndrome de deficiencia de recompensa". Enfermedad neuropsiquiátrica y tratamiento . 4 (5): 893–918. doi : 10.2147/ndt.s2627 . ISSN 1176-6328. PMC 2626918 . PMID 19183781.
- ^ Wise RA (1996). "Drogas adictivas y recompensa por estimulación cerebral". Annu. Rev. Neurosci . 19 : 319–340. doi :10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ ab «sistema nervioso humano | Descripción, desarrollo, anatomía y función». Enciclopedia Británica . 23 de enero de 2024.
- ^ ab James Olds y Peter Milner (diciembre de 1954). «Refuerzo positivo producido por estimulación eléctrica del área septal y otras regiones del cerebro de rata». Journal of Comparative and Physiological Psychology . 47 (6): 419–427. doi :10.1037/h0058775. PMID 13233369. Archivado desde el original el 5 de febrero de 2012. Consultado el 26 de abril de 2011 .
- ^ Kringelbach, Morten L.; Berridge, Kent C. (25 de junio de 2010). "La neuroanatomía funcional del placer y la felicidad". Discovery Medicine . 9 (49): 579–587. PMC 3008353 . PMID 20587348 – vía www.discoverymedicine.com.
- ^ Ivan Petrovich Pavlov; GV Anrep (2003). Reflejos condicionados. Courier Corporation. pp. 1–. ISBN 978-0-486-43093-5.
- ^ Fridlund, Alan y James Kalat. Mente y cerebro: la ciencia de la psicología. California: Cengage Learning, 2014. Versión impresa.
- ^ Han W, Tellez LA, Perkins MH, Perez IO, Qu T, Ferreira J; et al. (2018). "Un circuito neuronal para la recompensa inducida por el intestino". Cell . 175 (3): 665–678.e23. doi :10.1016/j.cell.2018.08.049. PMC 6195474 . PMID 30245012.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ ab Berridge, Kent C.; Kringelbach, Morten L. (agosto de 2008). "Neurociencia afectiva del placer: recompensa en humanos y animales". Psicofarmacología . 199 (3): 457–480. doi :10.1007/s00213-008-1099-6. PMC 3004012 . PMID 18311558.
- ^ ab Ferreri L, Mas-Herrero E, Zatorre RJ, Ripollés P, Gomez-Andres A, Alicart H, Olivé G, Marco-Pallarés J, Antonijoan RM, Valle M, Riba J, Rodriguez-Fornells A (enero de 2019). "La dopamina modula las experiencias de recompensa provocadas por la música". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (9): 3793–3798. Código Bib : 2019PNAS..116.3793F. doi : 10.1073/pnas.1811878116 . PMC 6397525 . PMID 30670642.
Escuchar música placentera suele ir acompañado de reacciones corporales mensurables, como piel de gallina o escalofríos en la columna vertebral, comúnmente llamados "escalofríos" o "escalofríos". ... En general, nuestros resultados revelaron de manera directa que las intervenciones farmacológicas modulaban de manera bidireccional la recompensa. respuestas provocadas por la música. En particular, descubrimos que la risperidona perjudicaba la capacidad de los participantes para experimentar placer musical, mientras que la levodopa la mejoraba. ... Aquí, en cambio, al estudiar las respuestas a recompensas abstractas en sujetos humanos, demostramos que la manipulación de la transmisión dopaminérgica afecta tanto al placer (es decir, la cantidad de tiempo que se informa sobre escalofríos y excitación emocional medida por EDA) como a los componentes motivacionales de la recompensa musical (dinero dispuesto a gastar). Estos hallazgos sugieren que la señalización dopaminérgica es una condición sine qua non no solo para las respuestas motivacionales , como se ha demostrado con las recompensas primarias y secundarias, pero también con las reacciones hedónicas a la música. Este resultado respalda hallazgos recientes que muestran que la dopamina también media la percepción placentera obtenida mediante otros tipos de recompensas abstractas y desafía hallazgos previos en modelos animales sobre recompensas primarias, como la comida.
- ^ ab Goupil L, Aucouturier JJ (febrero de 2019). "Placer musical y emociones musicales". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (9): 3364–3366. Bibcode :2019PNAS..116.3364G. doi : 10.1073/pnas.1900369116 . PMC 6397567 . PMID 30770455.
En un estudio farmacológico publicado en PNAS, Ferreri et al. (1) presentan evidencia de que mejorar o inhibir la señalización de la dopamina usando levodopa o risperidona modula el placer experimentado al escuchar música. ... En una salva final para establecer no sólo la implicación correlacional sino también causal de la dopamina en el placer musical, los autores han recurrido a la manipulación directa de la señalización dopaminérgica en el cuerpo estriado, primero aplicando estimulación magnética transcraneal excitatoria e inhibitoria sobre la corteza prefrontal dorsolateral izquierda de sus participantes, una región conocida por modular la función estriatal (5), y finalmente, en el estudio actual, administrando agentes farmacéuticos capaces de alterar la disponibilidad sináptica de la dopamina (1), ambos influyeron en el placer percibido, las medidas fisiológicas de excitación y el valor monetario asignado a la música en la dirección prevista. ... Si bien la cuestión de la expresión musical de la emoción tiene una larga historia de investigación, incluso en PNAS (6), y la línea de investigación psicofisiológica de la década de 1990 ya había establecido que el placer musical podía activar el sistema nervioso autónomo (7), la demostración de los autores de la implicación del sistema de recompensa en las emociones musicales se tomó como prueba inaugural de que se trataba de emociones verídicas cuyo estudio tiene plena legitimidad para informar la neurobiología de nuestras funciones cognitivas, sociales y afectivas cotidianas (8). Por cierto, esta línea de trabajo, que culminó en el artículo de Ferreri et al. (1), ha hecho plausiblemente más para atraer fondos de investigación para el campo de las ciencias de la música que cualquier otra en esta comunidad. La evidencia de Ferreri et al. (1) proporciona el respaldo más reciente a un modelo neurobiológico convincente en el que el placer musical surge de la interacción de antiguos sistemas de recompensa/valoración (estriatal-límbico-paralímbico) con sistemas de percepción/predicciones filogenéticamente más avanzados (temporofrontal).
- Young, Jared W.; Anticevic, Alan; Barch, Deanna M. (2018). "Neurociencia cognitiva y motivacional de los trastornos psicóticos". En Charney, Dennis S.; Sklar, Pamela; Buxbaum, Joseph D.; Nestler, Eric J. (eds.). Neurobiología de las enfermedades mentales de Charney y Nestler (5.ª ed.). Nueva York: Oxford University Press. ISBN 9780190681425.
Enlaces externos
- Recompensa de Scholarpedia
- Señales de recompensa de Scholarpedia