Materia orgánica particulada

Adaptado de Simon et al., 2002. [2]
| Parte de una serie sobre el |
| Ciclo del carbono |
|---|
 |
La materia orgánica particulada (POM) es una fracción de la materia orgánica total definida operacionalmente como aquella que no pasa a través de un tamaño de poro de filtro que generalmente varía de 0,053 milímetros (53 μm) a 2 milímetros. [3]
El carbono orgánico particulado (COP) es un término estrechamente relacionado que a menudo se utiliza indistintamente con el de materia orgánica particulada (POM). El COP se refiere específicamente a la masa de carbono en el material orgánico particulado, mientras que el POM se refiere a la masa total de la materia orgánica particulada. Además del carbono, el POM incluye la masa de los demás elementos de la materia orgánica, como el nitrógeno, el oxígeno y el hidrógeno. En este sentido, el COP es un componente del POM y, por lo general, hay aproximadamente el doble de POM que de COP. [4] Muchas de las afirmaciones que se pueden hacer sobre el POM se aplican igualmente al COP, y gran parte de lo que se dice en este artículo sobre el POM podría haberse dicho igualmente sobre el COP.
La materia orgánica particulada a veces se denomina materia orgánica suspendida, materia macroorgánica o materia orgánica de fracción gruesa. Cuando se aíslan muestras de tierra mediante tamizado o filtración, esta fracción incluye detritos parcialmente descompuestos y material vegetal, polen y otros materiales. [5] [6] Al tamizar para determinar el contenido de POM, la consistencia es crucial porque las fracciones de tamaño aisladas dependerán de la fuerza de agitación. [7]
El POM se descompone fácilmente, cumple muchas funciones del suelo y proporciona material terrestre a los cuerpos de agua. Es una fuente de alimento tanto para los organismos del suelo como para los organismos acuáticos y proporciona nutrientes para las plantas. En los cuerpos de agua, el POM puede contribuir sustancialmente a la turbidez, limitando la profundidad fótica que puede suprimir la productividad primaria. El POM también mejora la estructura del suelo , lo que conduce a una mayor infiltración de agua , aireación y resistencia a la erosión . [5] [8] Las prácticas de manejo del suelo , como la labranza y la aplicación de compost / estiércol , alteran el contenido de POM del suelo y el agua. [5] [6]
Descripción general
El carbono orgánico particulado (COP) se define operacionalmente como todo el carbono combustible, no carbonatado , que se puede recolectar en un filtro . La comunidad oceanográfica ha utilizado históricamente una variedad de filtros y tamaños de poro, más comúnmente filtros de fibra de vidrio o cuarzo de 0,7, 0,8 o 1,0 μm . La biomasa del zooplancton vivo se excluye intencionalmente del COP mediante el uso de un prefiltro o tomas de muestreo especialmente diseñadas que repelen a los organismos nadadores. [9] Las partículas submicrónicas, incluidas la mayoría de los procariotas marinos , que tienen un diámetro de 0,2 a 0,8 μm, a menudo no se capturan, pero deben considerarse parte del COP en lugar del carbono orgánico disuelto (COD), que generalmente se define operacionalmente como <0,2 μm. [10] [9] Por lo general, se considera que el POC contiene partículas suspendidas y que se hunden de ≥ 0,2 μm de tamaño, que por lo tanto incluye biomasa de células microbianas vivas, material detrítico que incluye células muertas, pellets fecales , otro material agregado y materia orgánica de origen terrestre. Algunos estudios dividen aún más el POC operativamente en función de su tasa de hundimiento o tamaño, [11] con partículas ≥ 51 μm a veces equiparadas a la fracción de hundimiento. [12] Tanto el DOC como el POC juegan papeles importantes en el ciclo del carbono , pero el POC es la principal vía por la que el carbono orgánico producido por el fitoplancton se exporta, principalmente por sedimentación gravitacional, desde la superficie hasta el océano profundo y eventualmente a los sedimentos , y por lo tanto es un componente clave de la bomba biológica . [13] [14] [15] [16] [17] [9]
Ecosistemas terrestres
Materia orgánica del suelo
La materia orgánica del suelo es todo lo que hay en el suelo de origen biológico. El carbono es su componente clave y representa aproximadamente el 58% en peso. La evaluación simple de la materia orgánica total se obtiene midiendo el carbono orgánico en el suelo. Los organismos vivos (incluidas las raíces) contribuyen aproximadamente con el 15% de la materia orgánica total en el suelo. Estos son fundamentales para el funcionamiento del ciclo del carbono del suelo . Lo que sigue se refiere al 85% restante de la materia orgánica del suelo, el componente no vivo. [18]
Como se muestra a continuación, la materia orgánica no viva presente en los suelos se puede agrupar en cuatro categorías distintas en función de su tamaño, comportamiento y persistencia. [19] Estas categorías están organizadas en orden decreciente de capacidad de descomposición. Cada una de ellas contribuye a la salud del suelo de diferentes maneras. [19] [18]
| Materia orgánica del suelo |
| ||||||||||||||||||
| (no vivo) |
Materia orgánica disuelta (MOD): es la materia orgánica que se disuelve en el agua del suelo. Está compuesta por compuestos orgánicos relativamente simples (por ejemplo, ácidos orgánicos, azúcares y aminoácidos) que se descomponen fácilmente. Tiene un tiempo de renovación de menos de 12 meses. Aquí se incluyen los exudados de las raíces de las plantas (mucílagos y gomas). [18]
Materia orgánica particulada (MOP): es la materia orgánica que conserva evidencia de su estructura celular original, [18] y se analiza con más detalle en la siguiente sección.
Humus : es generalmente la mayor proporción de materia orgánica en el suelo, contribuyendo del 45 al 75%. Por lo general, se adhiere a los minerales del suelo y juega un papel importante en la estructuración del suelo. El humus es el producto final de la actividad de los organismos del suelo, es químicamente complejo y no tiene características reconocibles de su origen. El humus es de tamaño unitario muy pequeño y tiene una gran área superficial en relación con su peso. Retiene nutrientes, tiene una alta capacidad de retención de agua y una importante capacidad de intercambio catiónico , amortigua los cambios de pH y puede retener cationes. El humus se descompone bastante lentamente y existe en el suelo durante décadas. [18]
Materia orgánica resistente: tiene un alto contenido de carbono e incluye carbón vegetal, materiales vegetales carbonizados, grafito y carbón. Los tiempos de renovación son largos y se estima que duran cientos de años. No es biológicamente activa, pero contribuye positivamente a las propiedades estructurales del suelo, incluida la capacidad de retención de agua, la capacidad de intercambio catiónico y las propiedades térmicas. [18]
Papel del POM en los suelos
La materia orgánica particulada (MOP) incluye restos vegetales y heces animales en constante descomposición, así como los detritos resultantes de la actividad de los microorganismos. La mayor parte de esta materia sufre una descomposición continua por parte de los microorganismos (cuando las condiciones son suficientemente húmedas) y, por lo general, su tiempo de renovación es inferior a 10 años. Las partes menos activas pueden tardar entre 15 y 100 años en renovarse. Cuando todavía se encuentra en la superficie del suelo y es relativamente fresca, la materia orgánica particulada intercepta la energía de las gotas de lluvia y protege las superficies físicas del suelo de daños. A medida que se descompone, la materia orgánica particulada proporciona gran parte de la energía que necesitan los organismos del suelo, además de proporcionar una liberación constante de nutrientes al entorno del suelo. [18]
La descomposición de la materia orgánica del suelo proporciona energía y nutrientes. Los nutrientes que no son absorbidos por los organismos del suelo pueden estar disponibles para la absorción de las plantas. [6] La cantidad de nutrientes liberados ( mineralizados ) durante la descomposición depende de las características biológicas y químicas de la materia orgánica del suelo, como la relación C:N . [6] Además de la liberación de nutrientes, los descomponedores que colonizan la materia orgánica del suelo desempeñan un papel en la mejora de la estructura del suelo. [20] El micelio de los hongos enreda las partículas del suelo y libera polisacáridos pegajosos, similares al cemento, en el suelo; formando finalmente agregados del suelo [20]
El contenido de POM del suelo se ve afectado por los insumos orgánicos y la actividad de los descomponedores del suelo. La adición de materiales orgánicos, como estiércol o residuos de cultivos , generalmente da como resultado un aumento de POM. [6] Alternativamente, la labranza repetida o la perturbación del suelo aumenta la tasa de descomposición al exponer los organismos del suelo al oxígeno y sustratos orgánicos ; en última instancia, agotando el POM. Se observa una reducción en el contenido de POM cuando los pastizales nativos se convierten en tierras agrícolas. [5] La temperatura y la humedad del suelo también afectan la tasa de descomposición de POM. [6] Debido a que el POM es una fuente fácilmente disponible (lábil) de nutrientes del suelo, contribuye a la estructura del suelo y es muy sensible al manejo del suelo, se utiliza con frecuencia como un indicador para medir la calidad del suelo . [8]
Ecosistemas de agua dulce
En suelos mal gestionados, en particular en terrenos inclinados, la erosión y el transporte de sedimentos del suelo ricos en POM pueden contaminar los cuerpos de agua. [8] Debido a que el POM proporciona una fuente de energía y nutrientes, la rápida acumulación de materia orgánica en el agua puede provocar eutrofización . [20] Los materiales orgánicos suspendidos también pueden servir como un vector potencial para la contaminación del agua con bacterias fecales , metales tóxicos o compuestos orgánicos.
Ecosistemas marinos
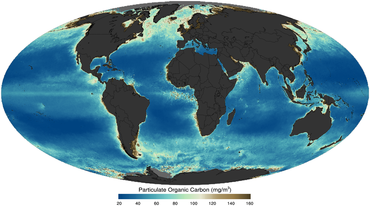
captada por satélite en 2011
_in_the_ocean.jpg/440px-Marine_particulate_organic_carbon_(POC)_in_the_ocean.jpg)

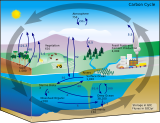
La vida y la materia orgánica particulada en el océano han dado forma fundamental al planeta. En el nivel más básico, la materia orgánica particulada puede definirse como materia viva y no viva de origen biológico con un tamaño de ≥0,2 μm de diámetro, que incluye cualquier cosa desde una pequeña bacteria (0,2 μm de tamaño) hasta ballenas azules (20 m de tamaño). [22] La materia orgánica desempeña un papel crucial en la regulación de los ciclos y eventos biogeoquímicos marinos globales , desde el Gran Evento de Oxidación en la historia temprana de la Tierra [23] hasta el secuestro de dióxido de carbono atmosférico en el océano profundo. [24] Por lo tanto, comprender la distribución, las características, la dinámica y los cambios a lo largo del tiempo de la materia particulada en el océano es fundamental para comprender y predecir el ecosistema marino, desde la dinámica de la red alimentaria hasta los ciclos biogeoquímicos globales. [25] [26]
Medición de POM
Las mediciones ópticas de partículas están surgiendo como una técnica importante para comprender el ciclo del carbono oceánico, incluidas las contribuciones a las estimaciones de su flujo descendente, que secuestra el dióxido de carbono en las profundidades marinas. Los instrumentos ópticos se pueden utilizar desde barcos o instalar en plataformas autónomas, lo que proporciona una cobertura espacial y temporal mucho mayor de las partículas en la zona mesopelágica del océano que las técnicas tradicionales, como las trampas de sedimentos . Las tecnologías para obtener imágenes de partículas han avanzado mucho en las últimas dos décadas, pero la traducción cuantitativa de estos inmensos conjuntos de datos en propiedades biogeoquímicas sigue siendo un desafío. En particular, se necesitan avances para permitir la traducción óptima de los objetos fotografiados en contenido de carbono y velocidades de hundimiento. Además, los diferentes dispositivos a menudo miden diferentes propiedades ópticas, lo que genera dificultades para comparar los resultados. [25]
Producción primaria oceánica
La producción primaria marina se puede dividir en producción nueva a partir de aportes de nutrientes alóctonos a la zona eufótica y producción regenerada a partir del reciclaje de nutrientes en las aguas superficiales. La producción nueva total en el océano equivale aproximadamente al flujo de materia orgánica particulada que se hunde en el océano profundo, alrededor de 4 × 10 9 toneladas de carbono al año. [27]
Modelo de partículas oceánicas que se hunden
Las partículas oceánicas que se hunden abarcan una amplia gama de formas, porosidad, lastre y otras características. El modelo que se muestra en el diagrama de la derecha intenta capturar algunas de las características predominantes que influyen en la forma del perfil del flujo de hundimiento (línea roja). [21] El hundimiento de partículas orgánicas producidas en las capas superiores iluminadas por el sol del océano forma una rama importante de la bomba biológica oceánica, que afecta el secuestro de carbono y el reabastecimiento de nutrientes en el océano mesopelágico. Las partículas que caen desde las capas superiores del océano sufren una remineralización por parte de bacterias colonizadas en su superficie e interior, lo que conduce a una atenuación del flujo de hundimiento de materia orgánica con la profundidad. El diagrama ilustra un modelo mecanicista para el flujo de masa de partículas que se hunde y depende de la profundidad, constituido por una gama de partículas que se hunden y remineralizan. [21]
La nieve marina varía en forma, tamaño y carácter, desde células individuales hasta gránulos y agregados, la mayoría de los cuales son rápidamente colonizados y consumidos por bacterias heterotróficas, lo que contribuye a la atenuación del flujo de hundimiento con la profundidad. [21]
Velocidad de hundimiento
El rango de velocidades de hundimiento registradas de partículas en los océanos abarca desde negativas (las partículas flotan hacia la superficie) [28] [29] hasta varios kilómetros por día (como con los gránulos fecales de salpa) [30]. Al considerar la velocidad de hundimiento de una partícula individual, se puede obtener una primera aproximación de la ley de Stoke (originalmente derivada para partículas esféricas, no porosas y flujo laminar) combinada con la aproximación de White [31] , que sugiere que la velocidad de hundimiento aumenta linealmente con el exceso de densidad (la diferencia con la densidad del agua) y el cuadrado del diámetro de la partícula (es decir, linealmente con el área de la partícula). Basándose en estas expectativas, muchos estudios han intentado relacionar la velocidad de hundimiento principalmente con el tamaño, que ha demostrado ser un predictor útil para partículas generadas en entornos controlados (por ejemplo, tanques rodantes). [32] [33] [34] Sin embargo, solo se observaron relaciones fuertes cuando todas las partículas se generaron utilizando la misma comunidad de agua/plancton. [35] Cuando las partículas fueron creadas por diferentes comunidades de plancton, el tamaño por sí solo fue un mal predictor (por ejemplo, Diercks y Asper, 1997), lo que apoya firmemente las nociones de que las densidades y formas de las partículas varían ampliamente según el material de origen. [35] [25]
El empaquetamiento y la porosidad contribuyen apreciablemente a determinar las velocidades de hundimiento. Por un lado, agregar materiales de lastrado, como frústulas de diatomeas, a los agregados puede llevar a un aumento en las velocidades de hundimiento debido al aumento del exceso de densidad. Por otro lado, la adición de partículas minerales de lastrado a las poblaciones de partículas marinas con frecuencia lleva a agregados más pequeños y más densamente empaquetados que se hunden más lentamente debido a su menor tamaño. [36] [37] Se ha demostrado que las partículas ricas en mucosidad flotan a pesar de tamaños relativamente grandes, [28] [38] mientras que se ha demostrado que los agregados que contienen petróleo o plástico se hunden rápidamente a pesar de la presencia de sustancias con un exceso de densidad menor que el agua de mar. [39] [40] En entornos naturales, las partículas se forman a través de diferentes mecanismos, por diferentes organismos y bajo diferentes condiciones ambientales que afectan la agregación (por ejemplo, salinidad, pH, minerales), el lastrado (por ejemplo, deposición de polvo, carga de sedimentos; [35] [34] van der Jagt et al., 2018) y el comportamiento de hundimiento (por ejemplo, viscosidad; [41] ). Por lo tanto, una conversión universal de tamaño a velocidad de hundimiento es impracticable. [42] [25]
Papel en la red alimentaria acuática inferior
Junto con la materia orgánica disuelta , la POM impulsa la cadena alimentaria acuática inferior al proporcionar energía en forma de carbohidratos, azúcares y otros polímeros que pueden degradarse. La POM en los cuerpos de agua se deriva de insumos terrestres (por ejemplo, materia orgánica del suelo, hojarasca), vegetación acuática sumergida o flotante o producción autóctona de algas (vivas o detríticas). Cada fuente de POM tiene su propia composición química que afecta su labilidad o accesibilidad a la cadena alimentaria. Se cree que la POM derivada de las algas es la más lábil, pero hay cada vez más evidencia de que la POM derivada terrestre puede complementar las dietas de microorganismos como el zooplancton cuando la productividad primaria es limitada. [43] [44]
La bomba biológica de carbono
La dinámica del depósito de carbono orgánico particulado (COP) en el océano es fundamental para el ciclo del carbono marino . El COP es el vínculo entre la producción primaria de la superficie, el océano profundo y los sedimentos. La velocidad a la que se degrada el COP en el océano oscuro puede afectar la concentración atmosférica de CO2 . Por lo tanto, un objetivo central de los estudios de geoquímica orgánica marina es mejorar la comprensión de la distribución, la composición y el ciclo del COP. En las últimas décadas se han visto mejoras en las técnicas analíticas que han ampliado enormemente lo que se puede medir, tanto en términos de diversidad estructural de compuestos orgánicos y composición isotópica, como de estudios ómicos moleculares complementarios . [9]


Como se ilustra en el diagrama, el fitoplancton fija dióxido de carbono en la zona eufótica utilizando energía solar y produce POC. El POC formado en la zona eufótica es procesado por microorganismos marinos (microbios), zooplancton y sus consumidores en agregados orgánicos ( nieve marina ), que luego se exporta a las zonas mesopelágicas (200–1000 m de profundidad) y batipelágica mediante hundimiento y migración vertical del zooplancton y los peces. [46] [47] [48]
La bomba biológica de carbono describe el conjunto de procesos biogeoquímicos asociados con la producción, el hundimiento y la remineralización del carbono orgánico en el océano. [49] [50] En resumen, la fotosíntesis de los microorganismos en las primeras decenas de metros de la columna de agua fija el carbono inorgánico (cualquiera de las especies químicas del dióxido de carbono disuelto) en biomasa . Cuando esta biomasa se hunde en las profundidades del océano, una parte de ella alimenta el metabolismo de los organismos que viven allí, incluidos los peces de aguas profundas y los organismos bentónicos. [48] El zooplancton desempeña un papel fundamental en la conformación del flujo de partículas a través de la ingestión y fragmentación de partículas, [51] [52] [53] [54] [55] [56] la producción de material fecal que se hunde rápidamente [48] [30] y la migración vertical activa. [57] [58] [59] [25]
Además de la importancia del carbono orgánico "exportado" como fuente de alimento para los organismos de las profundidades oceánicas, la bomba biológica de carbono cumple una valiosa función ecosistémica: el carbono orgánico exportado transporta aproximadamente entre 5 y 20 Gt C cada año a las profundidades oceánicas [60] , donde una parte (~0,2-0,5 Gt C) [61] queda secuestrada durante varios milenios. Por lo tanto, la bomba biológica de carbono tiene una magnitud similar a las emisiones actuales de carbono de los combustibles fósiles (~10 Gt C año−1). Cualquier cambio en su magnitud causado por un mundo en calentamiento puede tener implicaciones directas tanto para los organismos de las profundidades oceánicas como para las concentraciones atmosféricas de dióxido de carbono. [62] [47] [25]
La magnitud y eficiencia (cantidad de carbono secuestrado en relación con la producción primaria) de la bomba biológica de carbono, y por lo tanto el almacenamiento de carbono en el océano, está determinada en parte por la cantidad de materia orgánica exportada y la velocidad a la que se remineraliza (es decir, la velocidad con la que la materia orgánica que se hunde se reelabora y respira en la región de la zona mesopelágica ). [62] [63] [64] Especialmente el tamaño y la composición de las partículas son parámetros importantes que determinan la velocidad a la que se hunde una partícula, [65] [63] cuánto material contiene, [66] y qué organismos pueden encontrarlo y utilizarlo. [67] [68] [69] [25]
Las partículas que se hunden pueden ser fitoplancton, zooplancton, detritos, bolitas fecales o una mezcla de estos. [70] [71] [48] Varían en tamaño desde unos pocos micrómetros hasta varios centímetros, y las partículas de un diámetro de >0,5 mm se denominan nieve marina . [72] En general, se cree que las partículas de un fluido se hunden una vez que sus densidades son más altas que el fluido ambiental, es decir, cuando las densidades en exceso son mayores que cero. Por lo tanto, las células individuales de fitoplancton más grandes pueden contribuir a los flujos sedimentarios. Por ejemplo, se ha demostrado que las células de diatomeas grandes y las cadenas de diatomeas con un diámetro de >5 μm se hunden a velocidades de hasta varias decenas de metros por día, aunque esto solo es posible debido al pesado lastre de una frústula de sílice . [73] [74] Tanto el tamaño como la densidad afectan la velocidad de hundimiento de las partículas; Por ejemplo, para velocidades de hundimiento que siguen la Ley de Stokes , duplicar el tamaño de la partícula aumenta la velocidad de hundimiento en un factor de 4. [75] [73] Sin embargo, la naturaleza altamente porosa de muchas partículas marinas significa que no obedecen la Ley de Stokes porque pequeños cambios en la densidad de partículas (es decir, compacidad) pueden tener un gran impacto en sus velocidades de hundimiento. [63] Las partículas grandes que se hunden son típicamente de dos tipos: (1) agregados formados a partir de una serie de partículas primarias, incluyendo fitoplancton, bacterias, pellets fecales , protozoos vivos y zooplancton y escombros, y (2) pellets fecales de zooplancton , que pueden dominar eventos de flujo de partículas y hundirse a velocidades superiores a 1.000 md −1 . [48] [25]
Conocer el tamaño, la abundancia, la estructura y la composición (por ejemplo, el contenido de carbono) de las partículas sedimentadas es importante, ya que estas características imponen restricciones fundamentales al ciclo biogeoquímico del carbono. Por ejemplo, se espera que los cambios en el clima faciliten un cambio en la composición de las especies de una manera que altere la composición elemental de la materia particulada, el tamaño celular y la trayectoria del carbono a través de la red alimentaria , lo que influye en la proporción de biomasa exportada a la profundidad. [76] Como tal, es probable que cualquier cambio inducido por el clima en la estructura o función de las comunidades de fitoplancton altere la eficiencia de la bomba biológica de carbono, con retroalimentaciones sobre la tasa de cambio climático. [77] [78] [25]
Hipótesis de la derivación bioluminiscente

El consumo de POC bioluminiscente por parte de los peces puede provocar la emisión de pellets fecales bioluminiscentes (reenvasado), que también pueden producirse con POC no bioluminiscente si el intestino del pez ya está cargado de bacterias bioluminiscentes. [80]
En el diagrama de la derecha, el POC que se hunde se mueve hacia abajo seguido de una columna química. [81] Las flechas blancas simples representan el flujo de carbono. El panel (a) representa la vista clásica de una partícula no bioluminiscente. La longitud de la columna se identifica mediante la escala en el costado. [82] El panel (b) representa el caso de una partícula brillante en la hipótesis de la derivación de bioluminiscencia. Las bacterias bioluminiscentes se representan agregadas sobre la partícula. Su emisión de luz se muestra como una nube azulada a su alrededor. Las flechas punteadas azules representan la detección visual y el movimiento hacia la partícula de los organismos consumidores. Aumentar la detección visual permite una mejor detección por parte de los niveles tróficos superiores, lo que potencialmente conduce a la fragmentación del POC que se hunde en POC suspendido debido a una alimentación descuidada. [80]
Véase también
Referencias
- ^ Monroy, P., Hernández-García, E., Rossi, V. y López, C. (2017) "Modelado del hundimiento dinámico de partículas biogénicas en flujo oceánico". Nonlinear Processes in Geophysics , 24 (2): 293–305. doi :10.5194/npg-24-293-2017.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 3.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 3.0 Internacional. - ^ Simon, M., Grossart, H., Schweitzer, B. y Ploug, H. (2002) "Ecología microbiana de agregados orgánicos en ecosistemas acuáticos". Ecología microbiana acuática , 28 : 175–211. doi :10.3354/ame028175.
- ^ Cambardella, CA; Elliott, ET (1991). "Cambios en la materia orgánica del suelo particulado a lo largo de una secuencia de cultivo de pastizales". Revista de la Sociedad Americana de Ciencias del Suelo . 56 (3): 777–783. doi :10.2136/sssaj1992.03615995005600030017x.
- ^ Moody, CS y Worrall, F. (2017) "Modelado de las tasas de degradación del DOC utilizando la composición de la DOM y las variables hidroclimáticas". Journal of Geophysical Research: Biogeosciences , 122 (5): 1175–1191. doi :10.1002/2016JG003493.
- ^ abcd Brady, NC; Weil, RR (2007). La naturaleza y las propiedades de los suelos (11.ª ed.). Upper Saddle River, NJ: Prentice-Hall Inc.
- ^ abcdef Gregorich, EG; Beare, MH; McKim, UF; Skjemstad, JO (2006). "Características químicas y biológicas de la materia orgánica físicamente no complejada". Revista de la Sociedad Americana de Ciencias del Suelo . 70 (3): 975–985. Código Bibliográfico :2006SSASJ..70..975G. doi :10.2136/sssaj2005.0116.
- ^ Carter, MR (1993). Muestreo de suelos y métodos de análisis . CRC Press.
- ^ abc "Materia orgánica particulada". Calidad del suelo para la salud ambiental . NRCS.
- ^ abcde Kharbush, JJ, Close, HG, Van Mooy, BA, Arnosti, C., Smittenberg, RH, Le Moigne, FA, Mollenhauer, G., Scholz-Böttcher, B., Obreht, I., Koch, BP y Becker, K. (2020) "Carbono orgánico particulado deconstruido: composición molecular y química del carbono orgánico particulado en el océano". Frontiers in Marine Science , 7 : 518. doi :10.3389/fmars.2020.00518.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Wagner, Sasha; Schubotz, Florencia; Káiser, Karl; Hallmann, cristiano; Waska, Hannelore; Rossel, Pamela E.; Hansman, Roberta; Elvert, Marco; Middelburg, Jack J.; Engel, Anja; Blattmann, Thomas M.; Catalá, Teresa S.; Lennartz, Sinikka T.; Gómez-Sáez, Gonzalo V.; Pantoja-Gutiérrez, Silvio; Bao, Rui; Galy, Valier (2020). "Adivino DOM: una perspectiva actual sobre el futuro del carbono orgánico disuelto oceánico". Fronteras en las ciencias marinas . 7 . doi : 10.3389/fmars.2020.00341 . hdl : 21.11116/0000-0006-6F5D-7 .
- ^ Riley, JS; Sanders, R.; Marsay, C.; Le Moigne, FAC; Achterberg, EP; Poulton, AJ (2012). "La contribución relativa de las partículas de hundimiento rápido y lento a la exportación de carbono oceánico". Ciclos biogeoquímicos globales . 26 (1): n/a. Bibcode :2012GBioC..26.1026R. doi : 10.1029/2011GB004085 . S2CID 41836211.
- ^ Lam, Phoebe J.; Doney, Scott C.; Bishop, James KB (2011). "La bomba biológica dinámica del océano: perspectivas a partir de una recopilación global de perfiles de concentración de carbono orgánico particulado, CaCO3 y ópalo del mesopelágico". Ciclos biogeoquímicos globales . 25 (3): n/a. Código Bibliográfico :2011GBioC..25.3009L. doi : 10.1029/2010GB003868 .
- ^ Eppley, Richard W.; Peterson, Bruce J. (1979). "Flujo de materia orgánica particulada y nueva producción planctónica en las profundidades oceánicas". Nature . 282 (5740): 677–680. Bibcode :1979Natur.282..677E. doi :10.1038/282677a0. S2CID 42385900.
- ^ Volk, Tyler; Hoffert, Martin I. (2013). "Bombas de carbono oceánico: análisis de las fortalezas y eficiencias relativas en los cambios del CO2 atmosférico impulsados por el océano". El ciclo del carbono y el CO2 atmosférico: variaciones naturales desde el Arcaico hasta el presente . Serie de monografías geofísicas. págs. 99-110. doi :10.1029/gm032p0099. ISBN . 9781118664322.
- ^ Boyd, PW; Trull, TW (2007). "Entender la exportación de partículas biogénicas en aguas oceánicas: ¿hay consenso?". Progress in Oceanography . 72 (4): 276–312. Bibcode :2007PrOce..72..276B. doi :10.1016/j.pocean.2006.10.007.
- ^ Cavan, EL; Le Moigne, FAC; Poulton, AJ; Tarling, GA; Ward, P.; Daniels, CJ; Fragoso, GM; Sanders, RJ (2015). "La atenuación del flujo de carbono orgánico particulado en el mar de Scotia, océano Austral, está controlada por los gránulos fecales del zooplancton". Geophysical Research Letters . 42 (3): 821–830. Código Bibliográfico :2015GeoRL..42..821C. doi : 10.1002/2014GL062744 . S2CID 53508151.
- ^ Le Moigne, Frédéric AC (2019). "Vías de transporte descendente de carbono orgánico por la bomba de carbono biológico oceánico". Frontiers in Marine Science . 6 . doi : 10.3389/fmars.2019.00634 .
- ^ abcdefg Suelo: formas y funciones Recursos victorianos en línea . Actualizado el 23 de marzo de 2020.
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ ab Baldock JA y Skjemstad JO (1999) "Soil organic carbon/soil organic matter in soil" (Carbono orgánico del suelo/materia orgánica del suelo). En KI Peverill, LA Sparrow y DJ Reuter (Eds.) Soil analysis: an interpretation manual (Análisis del suelo: un manual de interpretación) , páginas 159-170, Commonwealth Scientific and Industrial Research Organisation, Melbourne. ISBN 9780643063761
- ^ abc Six, J.; Bossuyt, H.; Degryze, S; Denef, K (2004). "Una historia de la investigación sobre el vínculo entre los (micro)agregados, la biota del suelo y la dinámica de la materia orgánica del suelo". Investigación sobre suelos y labranza . 79 (1): 7–31. Bibcode :2004STilR..79....7S. doi :10.1016/j.still.2004.03.008.
- ^ abcd Omand, MM, Govindarajan, R., He, J. y Mahadevan, A. (2020) "Flujo de hundimiento de materia orgánica particulada en los océanos: sensibilidad a las características de las partículas". Scientific Reports , 10 (1): 1–16. doi :10.1038/s41598-020-60424-5.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Blanchard, JL, Heneghan, RF, Everett, JD, Trebilco, R. y Richardson, AJ (2017) "De bacterias a ballenas: uso de espectros de tamaño funcional para modelar ecosistemas marinos. Tendencias en ecología y evolución, 32(3), pp.174-186. doi :10.1016/j.tree.2016.12.003.
- ^ Holland, HD (2006) "La oxigenación de la atmósfera y los océanos". Philosophical Transactions of the Royal Society B: Biological Sciences , 361 (1470): 903–915. doi :10.1098/rstb.2006.1838.
- ^ Heinze, C., Meyer, S., Goris, N., Anderson, L., Steinfeldt, R., Chang, N., Quéré, CL y Bakker, DC (2015) "El sumidero de carbono del océano: impactos, vulnerabilidades y desafíos". Earth System Dynamics , 6 (1): 327–358. doi :10.5194/esd-6-327-2015.
- ^ abcdefghi Giering, SL, Cavan, EL, Basedow, SL, Briggs, N., Burd, AB, Darroch, LJ, Guidi, L., Irrison, JO, Iversen, MH, Kiko, R. y Lindsay, DJ (2020 ) "Hundimiento de partículas orgánicas en el océano: estimaciones de flujo a partir de dispositivos ópticos in situ". doi :10.3389/fmars.2019.00834.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Conte, Maureen H ; Ralph, Nate; Ross, Edith H (2001). "Variabilidad estacional e interanual en los flujos de partículas en las profundidades oceánicas en el sitio del Programa de Flujo Oceánico (OFP)/Serie Cronológica del Atlántico de las Bermudas (BATS) en el oeste del Mar de los Sargazos cerca de las Bermudas". Investigación en aguas profundas, parte II: estudios temáticos en oceanografía . 48 (8–9): 1471–1505. Bibcode :2001DSRII..48.1471C. doi :10.1016/S0967-0645(00)00150-8.
- ^ Eppley, RW y Peterson, BJ (1979) "Flujo de materia orgánica particulada y nueva producción planctónica en las profundidades del océano". Nature , 282 (5740): 677–680. doi :10.1038/282677a0.
- ^ ab Azetsu-Scott, Kumiko; Passow, Uta (2004). "Partículas marinas ascendentes: significado de las partículas transparentes de exopolímeros (TEP) en la capa superior del océano" (PDF) . Limnología y Oceanografía . 49 (3): 741–748. Bibcode :2004LimOc..49..741A. doi :10.4319/lo.2004.49.3.0741. S2CID 32205017.
- ^ Acuña, JL; López-Alvarez, M.; Nogueira, E.; González-Taboada, F. (2010). "Flotación de diatomeas al inicio de la floración primaveral de fitoplancton: un experimento in situ". Marine Ecology Progress Series . 400 : 115–125. Bibcode :2010MEPS..400..115A. doi : 10.3354/meps08405 . hdl : 10651/7011 .
- ^ ab Iversen, MH, Pakhomov, EA, Hunt, BP, Van der Jagt, H., Wolf-Gladrow, D. y Klaas, C. (2017) "¿Plomos o flotadores? Contribución de los pellets de salpa al flujo de exportación durante un gran evento de floración en el Océano Austral". Investigación en aguas profundas, parte II: estudios temáticos en oceanografía , 138 : 116–125. doi :10.1016/j.dsr2.2016.12.004.
- ^ White, Frank M. (2006). Flujo de fluidos viscosos. McGraw-Hill. ISBN 9780071244930.
- ^ Gardes, Astrid; Iversen, Morten H.; Grossart, Hans-Peter; Passow, Uta; Ullrich, Matías S. (2011). "Se requieren bacterias asociadas a diatomeas para la agregación de Thalassiosira weissflogii". La Revista ISME . 5 (3): 436–445. Código Bib : 2011ISMEJ...5..436G. doi :10.1038/ismej.2010.145. PMC 3105730 . PMID 20827289.
- ^ Iversen, MH; Ploug, H. (2013). "Efectos de la temperatura en la tasa de respiración específica del carbono y la velocidad de hundimiento de los agregados de diatomeas: posibles implicaciones para los procesos de exportación en las profundidades oceánicas". Biogeosciences . 10 (6): 4073–4085. Bibcode :2013BGeo...10.4073I. doi : 10.5194/bg-10-4073-2013 .
- ^ ab Iversen, Morten H.; Robert, Maya L. (2015). "Efectos de lastrado de la esmectita en la formación y exportación de agregados desde una comunidad de plancton natural". Química marina . 175 : 18–27. Bibcode :2015MarCh.175...18I. doi :10.1016/j.marchem.2015.04.009.
- ^ abc Iversen, Morten Hvitfeldt; Nowald, Nicolas; Ploug, Helle; Jackson, George A.; Fischer, Gerhard (2010). "Perfiles de alta resolución de la exportación vertical de materia orgánica particulada frente al cabo Blanc, Mauritania: procesos de degradación y efectos de lastrado". Investigación en aguas profundas, parte I: Documentos de investigación oceanográfica . 57 (6): 771–784. Bibcode :2010DSRI...57..771I. doi :10.1016/j.dsr.2010.03.007.
- ^ Hamm, Christian E. (2002). "Agregación interactiva y sedimentación de diatomeas y material litogénico de tamaño arcilloso". Limnología y Oceanografía . 47 (6): 1790–1795. Bibcode :2002LimOc..47.1790H. doi : 10.4319/lo.2002.47.6.1790 .
- ^ Passow, Uta; de la Rocha, Christina L.; Fairfield, Caitlin; Schmidt, Katrin (2014). "Agregación como función de partículas minerales". Limnología y Oceanografía . 59 (2): 532–547. Bibcode :2014LimOc..59..532P. doi : 10.4319/lo.2014.59.2.0532 .
- ^ Bochdansky, Alexander B.; Clouse, Melissa A.; Herndl, Gerhard J. (2016). "Reyes dragones de las profundidades marinas: las partículas marinas se desvían notablemente del espectro común de número-tamaño". Scientific Reports . 6 : 22633. Bibcode :2016NatSR...622633B. doi :10.1038/srep22633. PMC 4778057 . PMID 26940454.
- ^ Largo, Marc; Moriceau, Brivaëla; Gallinari, Morgane; Lamberto, Christophe; Huvet, Arnaud; Raffray, Jean; Soudant, Philippe (2015). "Interacciones entre microplásticos y agregados de fitoplancton: impacto en sus respectivos destinos". Química Marina . 175 : 39–46. Código Bib : 2015MarCh.175...39L. doi :10.1016/j.marchem.2015.04.003.
- ^ Passow, U.; Sweet, J.; Francis, S.; Xu, C.; Dissanayake, AL; Lin, YY; Santschi, PH; Quigg, A. (2019). "Incorporación de petróleo en agregados de diatomeas". Marine Ecology Progress Series . 612 : 65–86. Bibcode :2019MEPS..612...65P. doi : 10.3354/meps12881 .
- ^ Taucher, J.; Bach, LT; Riebesell, U.; Oschlies, A. (2014). "El efecto de la viscosidad en el flujo de partículas marinas: un mecanismo de retroalimentación relevante para el clima" (PDF) . Ciclos biogeoquímicos globales . 28 (4): 415–422. Bibcode :2014GBioC..28..415T. doi : 10.1002/2013GB004728 .
- ^ Jouandet, Marie-Paule; Trull, Thomas W.; Guidi, Lionel; Picheral, Marc; Ebersbach, Friederike; Stemmann, Lars; Blain, Stéphane (2011). "La obtención de imágenes ópticas de partículas mesopelágicas indica un flujo profundo de carbono debajo de una floración natural fertilizada con hierro en el océano Austral". Limnología y Oceanografía . 56 (3): 1130–1140. Bibcode :2011LimOc..56.1130J. doi : 10.4319/lo.2011.56.3.1130 .
- ^ Weidel, Brian; Solomon, Christopher T.; Pace, Michael L.; Kitchell, Jim; Carpenter, Stephen R.; Cole, Jonathan J. (1 de febrero de 2011). "Evidencia sólida de apoyo terrestre al zooplancton en lagos pequeños basada en isótopos estables de carbono, nitrógeno e hidrógeno". Actas de la Academia Nacional de Ciencias . 108 (5): 1975–1980. Bibcode :2011PNAS..108.1975C. doi : 10.1073/pnas.1012807108 . ISSN 0027-8424. PMC 3033307 . PMID 21245299.
- ^ Kankaala, Paula; Strandberg, Ursula; Kimmo K. Kahilainen; Aalto, Sanni L.; Galloway, Aaron WE; Taipale, Sami J. (11 de agosto de 2016). "Los carbohidratos terrestres sustentan al zooplancton de agua dulce durante la deficiencia de fitoplancton". Scientific Reports . 6 : 30897. Bibcode :2016NatSR...630897T. doi :10.1038/srep30897. ISSN 2045-2322. PMC 4980614 . PMID 27510848.
- ^ Henley, Sian F.; Cavan, Emma L.; Fawcett, Sarah E.; Kerr, Rodrigo; Monteiro, Thiago; Sherrell, Robert M.; Bowie, Andrew R.; Boyd, Philip W.; Barnes, David KA; Schloss, Irene R.; Marshall, Tanya; Flynn, Raquel; Smith, Shantelle (2020). "Cambios en la biogeoquímica del océano Austral y sus implicaciones para el ecosistema". Fronteras en la ciencia marina . 7 . doi : 10.3389/fmars.2020.00581 . hdl : 11336/128446 .
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Basu, S. y Mackey, KR (2018) "El fitoplancton como mediador clave de la bomba biológica de carbono: sus respuestas a un clima cambiante". Sustainability , 10 (3): 869. doi :10.3390/su10030869.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ ab Passow, U. y Carlson, CA (2012) "La bomba biológica en un mundo con alto contenido de CO2". Marine Ecology Progress Series , 470 : 249–271. doi :10.3354/meps09985.
- ^ abcde Turner, Jefferson T. (2015). "Pellets fecales de zooplancton, nieve marina, fitodetritos y la bomba biológica del océano". Progress in Oceanography . 130 : 205–248. Bibcode :2015PrOce.130..205T. doi :10.1016/j.pocean.2014.08.005.
- ^ Volk, T. y Hoffert, MI (1985) "Bombas de carbono oceánico: análisis de las fortalezas y eficiencias relativas en los cambios del CO2 atmosférico impulsados por el océano". En: El ciclo del carbono y el CO2 atmosférico: variaciones naturales desde el Arcaico hasta el presente , páginas 99-110, Universidad de California. ISBN 9780875900605 .
- ^ Giering, SL y Humphreys, MP (2018) "Bomba biológica". En: Enciclopedia de geoquímica , W. White (Ed.) Cham: Springer, páginas 1–6. doi :10.1007/978-3-319-39193-9_154-1.
- ^ Waite, AM, Safi, KA, Hall, JA y Nodder, SD (2000) "Sedimentación masiva de picoplancton incrustado en agregados orgánicos". Limnología y Oceanografía , 45 (1): 87–97. doi :10.4319/lo.2000.45.1.0087.
- ^ Iversen, MH y Poulsen, LK (2007) "Coprorrexia, coprofagia y coprocalia en los copépodos Calanus helgolandicus , Pseudocalanus elongatus y Oithona similis ". Serie de progreso de la ecología marina , 350 : 79–89. doi :10.3354/meps07095.
- ^ Poulsen, LK y Iversen, MH (2008) "Degradación de los desechos fecales de los copépodos: papel clave del protozooplancton". Marine Ecology Progress Series , 367 : 1–13. doi :10.3354/meps07611.
- ^ Iversen, MH, Nowald, N., Ploug, H., Jackson, GA y Fischer, G. (2010) "Perfiles de alta resolución de la exportación vertical de materia orgánica particulada frente a Cabo Blanc, Mauritania: procesos de degradación y efectos de lastrado". Investigación en aguas profundas, parte I: Documentos de investigación oceanográfica , 57 (6): 771–784. doi :10.1016/j.dsr.2010.03.007.
- ^ Giering, SL, Sanders, R., Lampitt, RS, Anderson, TR, Tamburini, C., Boutrif, M., Zubkov, MV, Marsay, CM, Henson, SA, Saw, K. y Cook, K. (2014) "Reconciliación del presupuesto de carbono en la zona crepuscular del océano". Nature , 507 (7493): 480–483. doi :10.1038/nature13123.
- ^ Svensen, C., Morata, N. y Reigstad, M. (2014) "Aumento de la degradación de los pellets fecales de copépodos por la acción conjunta de dinoflagelados y Centropages hamatus ". Marine Ecology Progress Series , 516 : 61–70. doi :10.3354/meps10976.
- ^ Steinberg, DK, Carlson, CA, Bates, NR, Goldthwait, SA, Madin, LP y Michaels, AF (2000) "Migración vertical del zooplancton y transporte activo de carbono orgánico e inorgánico disuelto en el mar de los Sargazos". Investigación en aguas profundas, parte I: Documentos de investigación oceanográfica , 47 (1): 137–158. doi :10.1016/S0967-0637(99)00052-7.
- ^ Jónasdóttir, SH, Visser, AW, Richardson, K. y Heath, MR (2015) "La bomba de lípidos estacional de los copépodos promueve el secuestro de carbono en las profundidades del Atlántico Norte". Actas de la Academia Nacional de Ciencias , 112 (39): 12122–12126. doi :10.1073/pnas.1512110112.
- ^ Kiko, R., Biastoch, A., Brandt, P., Cravatte, S., Hauss, H., Hummels, R., Kriest, I., Marin, F., McDonnell, AM, Oschlies, A. y Picheral, M. (2017) "Influencias biológicas y físicas en las nevadas marinas en el ecuador". Nature Geoscience , 10 (11): 852–858. doi :10.1038/ngeo3042.
- ^ Henson, SA, Sanders, R., Madsen, E., Morris, PJ, Le Moigne, F. y Quartly, GD (2011) "Una estimación reducida de la fuerza de la bomba biológica de carbono del océano". Geophysical Research Letters , 38 (4). doi :10.1029/2011GL046735.
- ^ Guidi, L., Legendre, L., Reygondeau, G., Uitz, J., Stemmann, L. y Henson, SA (2015) "Una nueva mirada a la remineralización del carbono oceánico para estimar el secuestro en aguas profundas". Ciclos biogeoquímicos globales , 29 (7): 1044–1059. doi :10.1002/2014GB005063.
- ^ ab Kwon, EY, Primeau, F. y Sarmiento, JL (2009) "El impacto de la profundidad de remineralización en el balance de carbono aire-mar". Nature Geoscience , 2 (9): 630–635. doi :10.1038/ngeo612.
- ^ abc Iversen, M. y Ploug, H. (2010) "Minerales de lastre y flujo de carbono que se hunde en el océano: tasas de respiración específicas del carbono y velocidad de hundimiento de los agregados de nieve marina". Biogeosciences , 7 : 2613–2624. doi :10.5194/bg-7-2613-2010.
- ^ Reygondeau, G., Guidi, L., Beaugrand, G., Henson, SA, Koubbi, P., MacKenzie, BR, Sutton, TT, Fioroni, M. y Maury, O. (2018) "Provincias biogeoquímicas globales de la zona mesopelágica". Revista de Biogeografía , 45 (2): 500–514. doi :10.1111/jbi.13149.
- ^ Ploug, H., Iversen, MH, Koski, M. y Buitenhuis, ET (2008) "Producción, tasas de respiración de oxígeno y velocidad de hundimiento de los pellets fecales de copépodos: mediciones directas del lastrado con ópalo y calcita". Limnología y Oceanografía , 53 (2): 469–476. doi :10.4319/lo.2008.53.2.0469.
- ^ Ploug, H., Iversen, MH y Fischer, G. (2008) "Lastre, velocidad de hundimiento y difusividad aparente en la nieve marina y los pellets fecales del zooplancton: implicaciones para la renovación del sustrato por las bacterias adheridas". Limnología y Oceanografía , 53 (5): 1878–1886. doi :10.4319/lo.2008.53.5.1878.
- ^ Kiørboe, T., Saiz, E. y Visser, A. (1999) "Percepción de señales hidrodinámicas en el copépodo Acartia tonsa ". Marine Ecology Progress Series , 179 : 97–111. doi :10.3354/meps179097.
- ^ Visser, AW (2001) "Señales hidromecánicas en el plancton". Marine Ecology Progress Series , 222 : 1–24. doi :10.3354/meps222001.
- ^ Visser, AW y Jackson, GA (2004) "Características de la columna química detrás de una partícula que se hunde en una columna de agua turbulenta". Marine Ecology Progress Series , 283 : 55–71. doi :10.3354/meps283055.
- ^ Simon, M.; Grossart, HP; Schweitzer, B.; Ploug, H. (2002). "Ecología microbiana de agregados orgánicos en ecosistemas acuáticos". Ecología microbiana acuática . 28 : 175–211. doi : 10.3354/ame028175 .
- ^ Turner, JT (2002). "Pellets fecales de zooplancton, nieve marina y floraciones de fitoplancton que se hunden". Ecología microbiana acuática . 27 : 57–102. doi : 10.3354/ame027057 .
- ^ Alldredge, Alice L.; Silver, Mary W. (1988). "Características, dinámica y significado de la nieve marina". Progreso en Oceanografía . 20 (1): 41–82. Bibcode :1988PrOce..20...41A. doi :10.1016/0079-6611(88)90053-5.
- ^ ab Waite, A.; Fisher, A.; Thompson, PA; Harrison, PJ (1997). "Las relaciones entre la tasa de hundimiento y el volumen celular iluminan los mecanismos de control de la tasa de hundimiento en diatomeas marinas". Marine Ecology Progress Series . 157 : 97–108. Bibcode :1997MEPS..157...97W. doi : 10.3354/meps157097 .
- ^ Miklasz, Kevin A.; Denny, Mark W. (2010). "Velocidades de hundimiento de diatomeas: predicciones mejoradas y conocimiento a partir de una ley de Stokes modificada". Limnología y Oceanografía . 55 (6): 2513–2525. Bibcode :2010LimOc..55.2513M. doi : 10.4319/lo.2010.55.6.2513 .
- ^ Moore, J. Keith; Villareal, Tracy A. (1996). "Relaciones entre tamaño y tasa de ascenso en diatomeas marinas con flotabilidad positiva". Limnología y Oceanografía . 41 (7): 1514–1520. Bibcode :1996LimOc..41.1514M. doi : 10.4319/lo.1996.41.7.1514 .
- ^ Finkel, ZV; Beardall, J.; Flynn, KJ; Quigg, A.; Rees, TAV; Raven, JA (2010). "Fitoplancton en un mundo cambiante: tamaño celular y estequiometría elemental". Journal of Plankton Research . 32 : 119–137. doi : 10.1093/plankt/fbp098 .
- ^ Matear, Richard J.; Hirst, Anthony C. (1999). "Retroalimentación del cambio climático sobre la futura absorción de CO2 en los océanos". Tellus B: Chemical and Physical Meteorology . 51 (3): 722–733. Bibcode :1999TellB..51..722M. doi :10.3402/tellusb.v51i3.16472.
- ^ Le Quere, C.; Rodenbeck, C.; Buitenhuis, ET; Conway, TJ; Langenfelds, R.; Gomez, A.; Labuschagne, C.; Ramonet, M.; Nakazawa, T.; Metzl, N.; Gillett, N.; Heimann, M. (2007). "Saturación del sumidero de CO2 del océano Austral debido al cambio climático reciente". Science . 316 (5832): 1735–1738. Bibcode :2007Sci...316.1735L. doi : 10.1126/science.1136188 . PMID 17510327. S2CID 34642281.
- ^ Azam, Farooq; Long, Richard A. (2001). "Microcosmos de nieve marina". Nature . 414 (6863): 495–498. doi :10.1038/35107174. PMID 11734832. S2CID 5091015.
- ^ abc Tanet, Lisa; Martini, Séverine; Casalot, Laurie; Tamburini, Christian (2020). "Reseñas y síntesis: Bioluminiscencia bacteriana: ecología e impacto en la bomba biológica de carbono". Biogeociencias . 17 (14): 3757–3778. Bibcode :2020BGeo...17.3757T. doi : 10.5194/bg-17-3757-2020 .
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Kiørboe, Thomas (2011). "Cómo se alimenta el zooplancton: mecanismos, rasgos y compensaciones". Biological Reviews . 86 (2): 311–339. doi :10.1111/j.1469-185X.2010.00148.x. PMID 20682007. S2CID 25218654.
- ^ Kiørboe, Thomas; Jackson, George A. (2001). "Nieve marina, columnas de solutos orgánicos y comportamiento quimiosensorial óptimo de las bacterias". Limnología y Oceanografía . 46 (6): 1309–1318. Bibcode :2001LimOc..46.1309K. doi : 10.4319/lo.2001.46.6.1309 . S2CID 86713938.
