Inhibidor de la 4-hidroxifenilpiruvato dioxigenasa
Los inhibidores de la 4-hidroxifenilpiruvato dioxigenasa ( HPPD ) son una clase de herbicidas que impiden el crecimiento de las plantas al bloquear la 4-hidroxifenilpiruvato dioxigenasa , una enzima de las plantas que descompone el aminoácido tirosina en moléculas que luego son utilizadas por las plantas para crear otras moléculas que las plantas necesitan. Este proceso de descomposición, o catabolismo , y la creación de nuevas moléculas a partir de los resultados, o biosíntesis , es algo que hacen todos los seres vivos. Los inhibidores de HPPD se comercializaron por primera vez en 1980, aunque su mecanismo de acción no se entendió hasta finales de la década de 1990. Originalmente se usaban principalmente en Japón en la producción de arroz, pero desde finales de la década de 1990 se han utilizado en Europa y América del Norte para el maíz, la soja y los cereales, y desde la década de 2000 han cobrado mayor importancia a medida que las malezas se han vuelto resistentes al glifosato y otros herbicidas. Se están desarrollando cultivos modificados genéticamente que incluyen resistencia a los inhibidores de HPPD. [1] Hay un fármaco farmacéutico en el mercado, la nitisinona , que originalmente se estaba desarrollando como herbicida como miembro de esta clase y se utiliza para tratar una enfermedad huérfana , la tirosinemia tipo I.
Los inhibidores de HPPD se pueden clasificar en tres estructuras químicas fundamentales : pirazolonas, tricetonas y dicetonitrilos. La clase de las tricetonas se basa en una sustancia química que ciertas plantas producen para su autodefensa llamada leptospermona ; la clase fue desarrollada por científicos de empresas que finalmente se convirtieron en parte de Syngenta . Bayer CropScience también ha estado activa en el desarrollo de nuevos inhibidores de HPPD.
Mecanismo de acción
El mecanismo de acción de los inhibidores de HPPD fue malinterpretado durante los primeros veinte años en que se vendieron estos productos, a partir de 1980. [2] Originalmente se pensó que eran inhibidores de la protoporfirinógeno oxidasa (protox). [3]
La 4-hidroxifenilpiruvato dioxigenasa (HPPD) es una enzima presente tanto en plantas como en animales, que cataliza el catabolismo del aminoácido tirosina . [4] Impedir la degradación de la tirosina tiene tres consecuencias negativas: el exceso de tirosina atrofia el crecimiento; la planta sufre daño oxidativo por falta de tocoferoles (vitamina E); y la clorofila se destruye por falta de carotenoides que la protegen. [2] Las plantas se tornan blancas sin deformación por una pérdida completa de la clorofila, lo que ha llevado a que compuestos de esta clase sean clasificados como "herbicidas blanqueadores", al igual que los inhibidores de protox. [2] [5] [6]
Más específicamente, la inhibición de HPPD previene la formación de un producto de degradación, el ácido homogentísico , que a su vez es un precursor clave para la biosíntesis de tocoferoles y plastoquinona . La plastoquinona es, a su vez, un cofactor crítico en la formación de carotenoides , que protegen la clorofila en las plantas de ser destruida por la luz solar. [4]
Esta clase de herbicidas representa uno de los últimos descubrimientos de un nuevo modo de acción de los herbicidas en la ola de descubrimientos que finalizó a fines de la década de 1990. [3] [7]
Resistencia en las malezas
Hasta 2011 se conocía [actualizar]muy poca resistencia : en 2010, el Amaranthus tuberculatus en dos lugares diferentes, Iowa e Illinois , desarrolló resistencia. [8] [9]
Productos y economía
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita ser ampliada . Puedes ayudar agregándole algo. ( Mayo 2014 ) |
A partir de 2009, los inhibidores de HPPD tenían tres estructuras químicas fundamentales : [2] [10]
- Pirazolonas : pirazolato (Sanbird, introducido por Sankyo, 1980); pirazoxifeno (Paicer, introducido por Ishihara, 1985); benzofenap (Yukawide, introducido por Mitsubishi Chemical Corp y Rhône-Poulenc Agro, 1987, a partir de 2009 vendido por Bayer CropScience como Taipan); pirasulfotol (Huskie e Infinity, introducidos por Bayer CropScience, 2007); y topramezona (Clio e Impact, introducidos por BASF, 2006)
- Tricetonas : sulcotriona (Mikado, introducida por Zeneca en 1990 y comercializada desde 2009 por Bayer CropScience); mesotriona (Callisto y Lumax, introducidas por Zeneca en 2002 y comercializadas desde 2009 por Syngenta); benzobicyclon (ShowAce, introducida por SDS Biotech y Sandoz Crop Protection (ahora Syngenta), 2001); tembotriona (Laudis introducida por Bayer CropScience en 2007)
- Dicetonitrilos: isoxaflutol (también conocido como IFT) (Balance y Merlin, introducidos por Rhône-Poulenc Agro, 1996 y a partir de 2009 vendidos por Bayer CropScience)
Uso agrícola
El pirazolato, el pirazoxifeno y el benzofenap se comercializaron por primera vez en el mercado del arroz japonés a partir de 1980, pero perdieron importancia cuando se introdujeron los herbicidas de sulfonilurea . En 1990, se introdujo la sulcotriona para el control de malezas postemergentes en el maíz. El isoxaflutol abrió el mercado de manera más amplia para los inhibidores de HPPD cuando se introdujo en 1996 para el maíz y la caña de azúcar, y para su uso como herbicida de preemergencia que podía controlar las malezas de hoja ancha como lo hacía la sulcotriona, pero también otras malezas graminosas. El benzobicyclon se introdujo en 2001 para el control de las malezas de hoja ancha y algunas juncias que son un problema en el arroz, que se habían vuelto resistentes a los herbicidas de sulfonilurea. La mesotriona se introdujo en 2002 y, al igual que la sulcotriona, es una tricetona, por lo que es eficaz contra las mismas malezas y cultivos, pero es más potente, lo que la hace más útil en mezclas con otros herbicidas, un factor importante para controlar completamente las malezas y prevenir el desarrollo de resistencia. Se ha convertido en el miembro más vendido de la clase HPPD. [2]
El topramezona se introdujo en 2006 para el maíz y la soja, y es el inhibidor más potente de HPPD, pero tiene serios problemas de transferencia, especialmente para la soja en los EE. UU., donde el tiempo mínimo desde la aplicación hasta la siembra es de 18 meses. El tembotriona se introdujo en 2007 para el maíz, y actúa contra las principales especies de gramíneas y, lo que es más importante, mata las malezas de hoja ancha, incluidas las malezas resistentes al glifosato, ALS y dicamba. Utilizado con protectores, no hay restricciones de rotación de cultivos. El pirasulfotole también se introdujo en 2007 para los cereales en América del Norte, y fue la primera nueva clase de herbicida en cereales en muchos años, y un avance importante contra las malezas que se habían vuelto resistentes a los herbicidas existentes. Permanece activo en el suelo durante la temporada de crecimiento y cuando se utiliza con protectores , no daña los cultivos y no hay restricciones de rotación de cultivos. [2]
Riesgos y toxicidades de los herbicidas
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita ser ampliada . Puedes ayudar agregándole algo. ( Mayo 2014 ) |
La tembotriona tiene una toxicidad aguda baja por vía oral, dérmica e inhalatoria (categoría de toxicidad III o IV). Es un sensibilizador dérmico pero no irritante dérmico ni ocular [11] : 3
Cultivos modificados genéticamente
Para hacer frente a la creciente resistencia a los herbicidas existentes, Bayer CropScience ha estado desarrollando varios cultivos modificados genéticamente resistentes a los inhibidores de HPPD: en una versión, los cultivos son resistentes tanto a los inhibidores de HPPD como al glifosato , y en colaboración con Syngenta , cultivos que son resistentes a los inhibidores de HPPD y al glufosinato . [12] [13]
La colaboración para desarrollar productos apilados resistentes al glifosato e inhibidores de HPPD se anunció por primera vez en 2007. [14]
Uso médico
En la tirosinemia de tipo I , una enzima diferente que interviene en la descomposición de la tirosina, la fumarilacetoacetato hidrolasa, sufre una mutación y no funciona, lo que provoca la acumulación de productos muy nocivos en el organismo. [15] La fumarilacetoacetato hidrolasa actúa sobre la tirosina después de que lo haga la HPPD, por lo que los científicos que trabajaban en la elaboración de estos inhibidores plantearon la hipótesis de que inhibir la HPPD y controlar la tirosina en la dieta podría tratar esta enfermedad. Se intentó realizar una serie de pequeños ensayos clínicos con uno de sus compuestos, la nitisinona , que tuvieron éxito, lo que llevó a que la nitisinona se comercializara como fármaco huérfano . [16] [17] [18]
Historia del descubrimiento de la clase de inhibidores de HPPD de las tricetonas
El origen de la familia de los inhibidores de la HPPD, las tricetonas, se remonta a la curiosidad de un biólogo sobre el control alelopático de las malas hierbas en el patio trasero de su casa. Esta curiosidad condujo al descubrimiento y desarrollo de la clase de herbicidas de las tricetonas. [19] La investigación del modo de acción de esta clase de compuestos condujo al descubrimiento de que se podía utilizar para tratar a pacientes con tirosinemia tipo 1, un tratamiento que se ha dicho que "transforma la historia natural de la tirosinemia". [20]
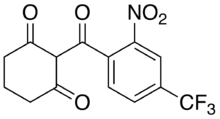
Todos los inhibidores herbicidas y farmacéuticos de la HPPD, incluidos la mesotriona (Callisto)( I ), [21] la sulcotriona (Mikado)( II ) [22] y la nitisinona (Orfadin)( III ) [23], tuvieron su origen común en la observación en 1977 de Reed Gray, un biólogo del Centro de Investigación Occidental (WRC) de Stauffer Chemical en California, de que pocas malezas emergían bajo las plantas de cepillo de botella ( Callistemon citrinus ) en el patio trasero de su casa.
 |  |  |
Para investigar este efecto, tomó tierra de debajo de estas plantas y la extrajo y fraccionó. Los extractos resultantes se aplicaron a las planicies de tierra que contenían pasto acuático ( Echinochloa crus-galli ) como especie indicadora a una tasa de aplicación muy alta de 100 libras por acre (112 kg/ha). Esta prueba produjo un efecto herbicida, por lo que los extractos se desarrollaron en una hoja cromatográfica preparativa de capa fina . Las mismas semillas de Echinochloa crus-galli se colocaron en esta hoja y germinaron. El ingrediente activo se identificó por los síntomas de blanqueamiento en la especie de prueba.
Se extrajo el área donde se observó la actividad herbicida y se envió el ingrediente activo aislado a Ken Cheng en el Centro de Investigación Occidental, quien, utilizando RMN de protones , IR y espectrometría de masas, identificó la estructura como la de la leptospermona ( IV ), que era un producto natural conocido [24] que se había derivado de los aceites volátiles al vapor de algunas plantas australianas, pero que nunca se había citado como poseedor de alguna actividad biológica.
 |
Se puso en contacto con un químico, Ron Rusay, del Centro de Investigación Occidental, quien sintetizó el compuesto de forma independiente y lo presentó para realizar más pruebas en invernadero. Estas pruebas demostraron que tenía una actividad herbicida modesta contra las malas hierbas a una tasa de aplicación muy alta de 100 libras por acre (112 kg/ha). Preparó una serie de análogos en los que se modificó el grupo alcanoilo y se obtuvo una patente para esta serie de compuestos. [25] Estos compuestos tenían una actividad herbicida débil similar a la encontrada con el compuesto principal. Debido a la débil actividad herbicida, no se continuó trabajando en otros análogos.
Poco después de esto, otro químico del WRC, Bill Michaely, sintetizó una aroil tricetona ( V ) como un subproducto inesperado al intentar sintetizar un análogo de setoxidim ( VI ) [26] .
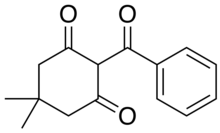 |  |
Si bien este compuesto no tenía ninguna actividad herbicida, sí mostró actividad en una prueba diseñada para mostrar la actividad antídoto contra otros herbicidas. Al intentar optimizar la actividad antídoto, se prepararon varios análogos sustituidos con arilo. Lo que se descubrió fue que aquellos compuestos con un sustituyente orto tenían actividad herbicida pero no actividad antídoto. Esta observación, junto con el conocimiento de la actividad herbicida de los análogos de leptospermona anteriores, fue fundamental para formular una idea de un toxóforo potencial para esta clase de herbicidas.
Un pequeño grupo de trabajo formado por David Lee, Bill Michaely y Don James preparó una serie de tricetonas sustituidas con sustituyentes cloro, bromo y metilo en posición orto . La actividad biológica siguió siendo modesta y el grupo de trabajo se disolvió al poco tiempo.
Una hipótesis de trabajo era que el ingrediente activo de estas tricetonas eran las tetrahidroxantenas ciclizadas ( VII ). Bill Michaely preparó varias de ellas, pero la actividad herbicida siguió siendo modesta y se interrumpieron todos los trabajos en esa área. No fue hasta que David Lee pudo demostrar que estos compuestos estaban en equilibrio con las 2-hidroxi-tricetonas ( VIII ) atrapando el intermediario con yoduro de metilo que se entendió la razón de la actividad biológica.
 |  |
David Lee tenía una sólida formación en relaciones cuantitativas estructura-actividad (QSAR) después de un año postdoctoral con los profesores Manfred Wolff y Peter Kollman, donde utilizó el sistema Prophet. [27] Al examinar las QSAR ( relaciones cuantitativas estructura-actividad ) de las tricetonas, David Lee vio una posible discrepancia en el análisis estructura-actividad existente. Aparte del patrón de sustitución 2-cloro-4-nitro, nunca se habían preparado otras tricetonas con sustituyentes atractores de electrones en la posición 4. Planteó la hipótesis de que la actividad de las tricetonas podría correlacionarse con la capacidad de los sustituyentes para atraer electrones. La actividad del análogo 2-cloro-4-nitro era un caso atípico, y se teorizó que tal vez el grupo nitro se estaba reduciendo in vivo . Luego se preparó el grupo 4-metilsulfonilo para probar esta hipótesis, y se preparó lo que se convertiría en el herbicida comercial Mikado ( II ). La perspectiva de mejorar la actividad biológica con nuevos patrones de sustitución aromática rejuveneció totalmente el trabajo sobre las tricetonas.
Un descubrimiento clave en la preparación de estos compuestos fue el hallazgo de Jim Heather en el grupo de Desarrollo de Procesos del WRC de que la cianhidrina de acetona era un buen catalizador para la preparación de los análogos de o-cloro. [28] El uso de este catalizador permitió por primera vez la producción de o-nitro tricetonas.
En ese momento se inició un gran esfuerzo de síntesis de análogos, bajo la coordinación de David Lee. Los químicos clave que participaron en este proyecto fueron Charles Carter, Bill Michaely, Hsiao-ling Chin, Nhan Nguyen y Chris Knudsen, aunque en un momento dado casi todos los químicos de síntesis del WRC trabajaron en este proyecto. [29] [30] [31] En un tiempo relativamente corto, se lograron avances importantes en la optimización de ciertas combinaciones de sustitución. SC-0051 (sulcotriona) se sintetizó y probó en septiembre-octubre de 1983, y SC-1296 (mesotriona) y SC-0735 (nitisinona) se sintetizaron y probaron a principios de 1984. Las tricetonas se sometieron a ensayos de campo universitarios generalizados en 1985. [32] La primera de las patentes de tricetonas se publicó en 1986. [33]
Con una larga historia de trabajo con herbicidas blanqueadores que inhiben la fitoeno desaturasa [34], incluido el herbicida comercial flurocloridona ( IX ), [35] hubo un considerable interés en encontrar que estos compuestos no inhiben la fitoeno desaturasa in vitro . El hecho de que los inhibidores de la fitoeno desaturasa típicamente tienen un log P alto , mientras que las tricetonas no, sugirió además un modo de acción diferente.
 |
Al principio, hubo cierta preocupación toxicológica por las lesiones en la córnea y en las patas que se observaron en ratas que habían recibido dosis repetidas de tricetona. Varios químicos y toxicólogos encontraron un artículo [36] que describía lesiones oculares muy similares, pero no en la piel, con inhibidores de la tirosina hidroxilasa . Linda Mutter, de la Sección de Toxicología del WRC, utilizó una prueba de tirosina en la orina de ratas tratadas y obtuvo resultados positivos. El análisis de tirosina en plasma confirmó además la acumulación de tirosina en las ratas tratadas. [37]
El trabajo sobre el modo de acción y la toxicología de las tricetonas adquirió un rango más amplio de interacciones cuando ICI compró Stauffer Chemical en junio de 1987. ICI luego separó los negocios farmacéutico y agroquímico como Zeneca y luego Syngenta se formó en 2000 mediante la fusión de Novartis Agribusiness y Zeneca Agrochemicals.
Como parte de los estudios toxicológicos , Martin Ellis, del Laboratorio Central de Toxicología del ICI, identificó la inhibición del catabolismo de la tirosina por parte de las tricetonas en el hígado de ratas y también descubrió que las tricetonas no inhibían la tirosina hidroxilasa . [38] Además, descubrió que la orina de ratas tratadas con III mostraba niveles elevados de p -hidroxifenilpiruvato y de ácido p -hidroxifenilláctico. Estos resultados sugirieron que la p -hidroxifenilpiruvato dioxigenasa (HPPD) era la enzima que se inhibía, hecho que fue confirmado por S. Lindstedt. [39] Pruebas posteriores establecieron que la HPPD era la enzima inhibida tanto en plantas como en mamíferos. [37]
Referencias
- ^ "Soja tolerante a herbicidas HPPD: nuevo tipo de OGM". Farm Progress . 2014-10-08 . Consultado el 2021-03-15 .
- ^ abcdef van Almsick, Andreas (2009). "Nuevos inhibidores de HPPD: un modo de acción comprobado como una nueva esperanza para resolver los problemas actuales de las malezas". Perspectivas sobre el manejo de plagas . 20 (1): 27–30. doi :10.1564/20feb09.
- ^ ab Cole, D.; Pallett, KE; Rodgers, M. (2000). "Descubrimiento de nuevos modos de acción para herbicidas y el impacto de la genómica". Pesticide Outlook . 12 (6): 223–9. doi :10.1039/B009272J.
- ^ ab Moran, GR (enero de 2005). "4-Hidroxifenilpiruvato dioxigenasa" (PDF) . Arch Biochem Biophys . 433 (1): 117–28. doi :10.1016/j.abb.2004.08.015. PMID 15581571.
- ^ "Inhibición de la síntesis de pigmentos (herbicidas blanqueadores)" (PDF) . LSUAgCenter.com . Consultado el 8 de septiembre de 2017 .
- ^ Wolfgang Kramer y Ulrich Schirmer, Compuestos modernos para la protección de cultivos (1)197-276(2012)
- ^ Duke, SO (abril de 2012). "Por qué no hay nuevos modos de acción de los herbicidas en los últimos años". Pest Management Science . 68 (4): 505–12. doi :10.1002/ps.2333. PMID 22190296.
- ^ Hausman, Nicholas E; Singh, Sukhvinder; Tranel, Patrick J; Riechers, Dean E; Kaundun, Shiv S; Polge, Nicholas D; Thomas, David A; Hager, Aaron G (26 de enero de 2011). "Resistencia a herbicidas inhibidores de HPPD en una población de amaranto acuático ( Amaranthus tuberculatus ) de Illinois, Estados Unidos". Pest Management Science . 67 (3). Society of Chemical Industry ( Wiley ): 258–261. doi :10.1002/ps.2100. ISSN 1526-498X. PMID 21308951. S2CID 31756104.
- ^ Syngenta (2011). "Conozca los hechos sobre la resistencia de las malezas a las HPPD" (PDF) .
- ^ George W. Ware y David M. Whitacre. Introducción a los herbicidas (2.ª edición) Archivado el 5 de mayo de 2014 en Wayback Machine. Extraído de The Pesticide Book, 6.ª edición*. (2004), publicado por MeisterPro Information Resources, una división de Meister Media Worldwide, Willoughby, Ohio
- ^ Hoja informativa sobre pesticidas de la EPA de EE. UU.: Tembotriona
- ^ Gil Gullickson para Crops.com 5 de diciembre de 2012 Algo viejo, algo nuevo con los herbicidas
- ^ Rhonda Brooks para Farm Journal, 12 de febrero de 2014. "Las empresas de semillas aceleran el ritmo de los sistemas de semillas con características herbicidas"
- ^ Nota de prensa de Bayer CropScience. 26 de noviembre de 2007 Bayer CropScience, Mertec y MS Technologies desarrollarán conjuntamente nuevos productos con características genéticas de la soja
- ^ Organización Nacional de Enfermedades Raras. Guía para médicos sobre tirosinemia tipo 1 Archivado el 11 de febrero de 2014 en Wayback Machine.
- ^ Lock, EA; et al. (agosto de 1998). "El descubrimiento del modo de acción de la 2-(2-nitro-4-trifluorometilbenzoil)-1,3-ciclohexanodiona (NTBC), su toxicología y desarrollo como fármaco". J Inherit Metab Dis . 21 (5): 498–506. doi :10.1023/A:1005458703363. PMID 9728330. S2CID 6717818.
- ^ "Descripción y nombres comerciales de Nitisinona (vía oral) - Mayo Clinic".
- ^ Sobi Orfadin (nitisinona) Archivado el 4 de mayo de 2014 en Wayback Machine.
- ^ Beaudegnies, R; et al. (junio de 2009). "Inhibidores herbicidas de la 4-hidroxifenilpiruvato dioxigenasa: una revisión de la historia de la química de las tricetonas desde la perspectiva de Syngenta". Bioorg Med Chem . 17 (12): 4134–52. doi :10.1016/j.bmc.2009.03.015. PMID 19349184.
- ^ McKieman, PJ (2006). "Nitisinona en el tratamiento de la tirosinemia hereditaria tipo 1". Drugs . 66 (6): 743–50. doi :10.2165/00003495-200666060-00002. PMID 16706549. S2CID 24239547.
- ^ Manual de protección de cultivos MeisterPro 2011, pág. 502
- ^ Manual de protección de cultivos MeisterPro 2011, pág. 632
- ^ Christopher G. Knudsen, David L. Lee, William J. Michaely, Hsiao-ling Chin, Nhan H. Nguyen, Ronald J. Rusay, Thomas H. Cromartie, Reed Gray, Byron H. Lake, Torquil EM Frasier y David Cartwright, Descubrimiento de la clase de tricetonas de herbicidas inhibidores de HPPD y su relación con las -tricetonas naturales, Allelopathy in Ecological Agriculture and Forestry (2000), págs. 101-111
- ^ Hellyer, RO (1968). "La presencia de β-tricetonas en los aceites volátiles al vapor de plantas mirtáceas australianas" . Aust. J. Chem . 21 (11): 2825–2828. doi :10.1071/CH9682825.
- ^ Reed A. Gray, Chien K. Tseng, Ronald J. Rusay, 1-Hidroxi-2-(alquilceto)-4,4,6,6-tetrametilciclohexen-3,5-dionas, US 4.202.840 (1980)
- ^ Manual de protección de cultivos MeisterPro 2011, pág. 618
- ^ Lee, DL, Kollman, PA, Marsh, FJ, Wolff, ME, Relaciones cuantitativas entre la estructura de esteroides y la unión a los supuestos receptores de progesterona, J. Med. Chem., 20 (1977) págs. 1139-46
- ^ James B. Heather, Pamela D. Milano, Proceso para la producción de compuestos de 1,3-dicarbonilo acilados, US 4.695.673 (1987)
- ^ (8) David L. Lee, Michael P. Prisbylla, Thomas H. Cromartie, Derek P. Dagarin, Stott W. Howard, W. Mclean Provan, Martin K. Ellis, Torquil Fraser, Linda C. Mutter. El descubrimiento y los requisitos estructurales de los inhibidores de la p -hidroxifenilpiruvato dioxigenasa. Weed Science, 45(5), págs. 601-609.
- ^ (9) David L. Lee, Christopher G. Knudsen, William J. Michaely, John B Tarr, Hsiao-Ling Chin, Nhan H. Nguyen, Charles G. Carter, Thomas H. Cromartie, Byron H. Lake, John M. Shribbs, Stott Howard, Sean Hauser, D. Dgarin, La síntesis y las relaciones estructura-actividad de los herbicidas Triketone HPPD, Control de insectos, malezas y hongos, Serie de simposios de la ACS N.º 774 2000), pág. 8-19
- ^ Lee, David L., Knudsen, Christopher G., Michaely, William J., Chin, Hsiao-Ling, Nguyen, Nhan H., Carter, Charles G., Cromartie, Thomas G., Lake, Byron H., Shribbs, John M., Frasier, Torquil EM, Las relaciones estructura-actividad de la clase de herbicidas de HPPD de tricetona, Pesticide Science 54:377-384 (1998)
- ^ (10) Evans, JO y Gunnell, RW (1986) Evaluación de SC-0774, SC-0051 y SC-5676 en maíz de campo. Informe de progreso de la investigación. Sociedad Occidental de Ciencias de las Malezas (EE. UU.), 130-131
- ^ Michaely, WJ, Kratz, GW, Ciertas 2-(benzoil2-sustituidas)-1,3-ciclohexanodionas y su uso como herbicidas, US 4.780.127 (1988)
- ^ Sandman, Gerhard, Schmidt, Arno, Linden, Harmut, Böger, Peter, (1991) Fitoeno desaturasa, el objetivo esencial de los herbicidas blanqueadores, Weed Science, 39:474-479
- ^ Manual de protección de cultivos MeisterPro 2011, pág. 428
- ^ Kolzumi, S., Nagatsu, T., Iinuma, H., Ohno, M., Takeuchi, T. y Umezawa, H. (1982). Inhibición de la fenilalanina hidroxilasa, una monooxigenasa que requiere pterina, por ouudenona y sus derivados, Journal of Antibiotics 35: 458.
- ^ ab (14) MP Prisbylla, BC Onisko, JM Shribbs, DO Adams, Y. Liu, MK Ellis, TR Hawkes, LC Mutter, El nuevo mecanismo de acción de las tricetonas herbicidas, Conferencia de protección de cultivos de Brighton – Malezas (1993.) 731-8
- ^ Ellis, MK, AC Whitfield, LA Gowans, TR Auton, WM Provan, EA Lock y LL Smith 1995, Inhibición de la 4-hidroxifenilpiruvato dioxigenasa por 2-(2-nitro-4-trifluorometilbenzoil)-ciclohexano-1,3-diona y 2-(2-cloro-4-metilsulfonilbenzoil)-ciclohexano-1,3-diona. Toxicol. Appl Pharmacol. 133:12-19
- ^ Lindsted, W. y B. Odelhög, 4-Hidroxifenilpiruvato dioxigenasa de hígado humano (1987) Methods Enzymol. 142;139-142
Lectura adicional
- Jhala, Amit J.; Kumar, Vipán; Yadav, Ramawatar; et al. (2023). "Herbicidas inhibidores de la 4-hidroxifenilpiruvato dioxigenasa (HPPD): pasado, presente y futuro". Tecnología de malezas . 37 : 1–14. doi : 10.1017/mojado.2022.79 .