Cuerpo carotídeo
| Cuerpo carotídeo | |
|---|---|
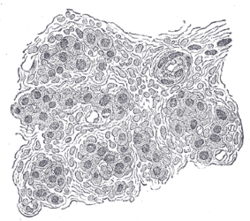 Sección de una parte del cuerpo carotídeo humano. Ampliada. Se ven numerosos vasos sanguíneos entre las células. | |
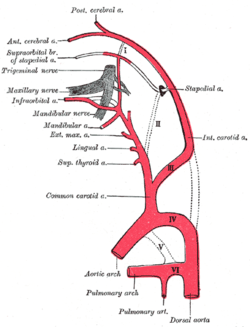 Diagrama que muestra los orígenes de las principales ramas de las arterias carótidas. | |
| Detalles | |
| Nervio | Rama del nervio glosofaríngeo al seno carotídeo |
| Identificadores | |
| latín | glomus carotídeo |
| Malla | D002344 |
| TA98 | A12.2.04.007 |
| TA2 | 3886 |
| FMA | 50095 |
| Terminología anatómica [editar en Wikidata] | |
El cuerpo carotídeo es un pequeño grupo de células quimiorreceptoras periféricas y células sustentaculares de soporte situadas en la bifurcación de cada arteria carótida común en su túnica externa . [1] [2]
El cuerpo carotídeo detecta los cambios en la composición de la sangre arterial que fluye a través de él, principalmente la presión parcial de oxígeno arterial , pero también de dióxido de carbono . También es sensible a los cambios en el pH de la sangre y la temperatura .
Estructura
El cuerpo carotídeo está situado en el aspecto posterior de la bifurcación de la arteria carótida común. [3]
El cuerpo carotídeo está formado por dos tipos de células, llamadas células glómicas : las células glómicas tipo I son quimiorreceptores periféricos , y las células glómicas tipo II son células de sostén sustentacular .
- Las células glómicas de tipo I se derivan de la cresta neural . [4] Liberan una variedad de neurotransmisores , entre ellos acetilcolina , ATP y dopamina , que desencadenan los EPSP en las neuronas sinapsis que conducen al centro respiratorio . Están inervadas por axones del nervio glosofaríngeo, que colectivamente se denominan nervio del seno carotídeo.
- Las células glómicas tipo II se parecen a las células gliales , expresan el marcador glial S100 y actúan como células de sostén.
Función
Esta sección necesita referencias médicas más confiables para su verificación o depende demasiado de fuentes primarias . ( octubre de 2019 ) |
El cuerpo carotídeo funciona como un sensor: responde a un estímulo, principalmente la presión parcial de O 2 , que es detectado por las células tipo I (glómicas), y desencadena un potencial de acción a través de las fibras aferentes del nervio glosofaríngeo , que transmite la información al sistema nervioso central.
Estímulo
Los quimiorreceptores periféricos del cuerpo carotídeo son sensibles principalmente a las disminuciones de la presión parcial de oxígeno (P O 2 ). Esto contrasta con los quimiorreceptores centrales del bulbo raquídeo , que son sensibles principalmente a los cambios de pH y P CO 2 (una disminución del pH y un aumento de P CO 2 ). Los quimiorreceptores del cuerpo carotídeo también son sensibles al pH y P CO 2 , pero solo de manera secundaria. Más específicamente, la sensibilidad de los quimiorreceptores del cuerpo carotídeo a la disminución de P O 2 es mayor cuando el pH disminuye y la P CO 2 aumenta.
La frecuencia de impulso de los cuerpos carotideos es particularmente sensible a los cambios en la PO2 arterial en el rango de 60 a 30 mmHg, un rango en el que la saturación de hemoglobina con oxígeno disminuye rápidamente. [5]
La producción de los cuerpos carotideos es baja a una presión parcial de oxígeno superior a unos 100 mmHg (13,3 k Pa ) (a un pH fisiológico normal), pero por debajo de 60 mmHg la actividad de las células de tipo I (glómicas) aumenta rápidamente debido a una disminución de la saturación de oxígeno de la hemoglobina por debajo del 90%.
Detección
El mecanismo para detectar reducciones en P O 2 aún no se ha identificado, puede haber múltiples mecanismos y podría variar entre especies. [6] Se ha demostrado que la detección de hipoxia depende del aumento de la generación de sulfuro de hidrógeno producido por la cistationina gamma-liasa , ya que la detección de hipoxia se reduce en ratones en los que esta enzima está inactivada o inhibida farmacológicamente. El proceso de detección implica la interacción de la cistationina gamma-liasa con la hemooxigenasa-2 y la producción de monóxido de carbono . [7] Sin embargo, algunos estudios muestran que la concentración fisiológica de sulfuro de hidrógeno puede no ser lo suficientemente fuerte como para desencadenar tales respuestas.
Otras teorías sugieren que puede involucrar sensores de oxígeno mitocondriales y los citocromos que contienen hemo que experimentan una reducción reversible de un electrón durante la fosforilación oxidativa. El hemo se une reversiblemente al O 2 con una afinidad similar a la del cuerpo carotídeo, lo que sugiere que las proteínas que contienen hemo pueden tener un papel en el O 2 , potencialmente este podría ser uno de los complejos involucrados en la fosforilación oxidativa. Esto conduce a aumentos en las especies reactivas de oxígeno y aumentos en Ca 2+ intracelular . Sin embargo, se desconoce si la hipoxia conduce a un aumento o disminución de las especies reactivas de oxígeno. El papel de las especies reactivas de oxígeno en la detección de hipoxia también está en duda. [8]
La enzima hemo-oxidasa dependiente del oxígeno también se ha propuesto como un sensor de hipoxia. En la normoxia, la hemo-oxigenasa genera monóxido de carbono (CO), el CO activa el canal de potasio activado por calcio de gran conductancia, BK. Las caídas de CO que se producen como consecuencia de la hipoxia conducirían al cierre de este canal de potasio y esto conduciría a la despolarización de la membrana y la consiguiente activación del cuerpo carotídeo. [9] También se ha propuesto un papel para la proteína quinasa activada por AMP (AMPK) como "sensor de energía" en la detección de hipoxia. Esta enzima se activa durante períodos de uso neto de energía y estrés metabólico, incluida la hipoxia. La AMPK tiene varios objetivos y parece que, en el cuerpo carotídeo, cuando la AMPK se activa por la hipoxia, conduce al cierre del canal de potasio descendente tanto de los canales tipo TASK sensibles al O2 como de los canales BK [10].
Se detecta un aumento de la PCO2 porque el CO2 se difunde en la célula, donde aumenta la concentración de ácido carbónico y, por lo tanto, de protones . Se desconoce el mecanismo preciso de detección del CO2 , pero se ha demostrado que el CO2 y el pH bajo inhiben una conductancia de potasio similar a la de TASK, lo que reduce la corriente de potasio. Esto conduce a la despolarización de la membrana celular, lo que conduce a la entrada de Ca2 + , la excitación de las células glómicas y la consiguiente liberación de neurotransmisores. [11]
La acidosis arterial (ya sea metabólica o por alteración de la PCO2 ) inhibe los transportadores ácido-base (p. ej. Na + -H + ) que elevan el pH intracelular , y activa los transportadores (p. ej. Cl −- HCO3− ) que lo disminuyen. Los cambios en la concentración de protones causados por la acidosis (o lo opuesto a la alcalosis ) dentro de la célula estimulan las mismas vías implicadas en la detección de la PCO2 .
Otro mecanismo es a través de los canales de potasio sensibles al oxígeno. Una disminución del oxígeno disuelto provoca el cierre de estos canales, lo que produce despolarización. Esto lleva a la liberación del neurotransmisor dopamina en el glosofaríngeo y el vago aferentes al área vasomotora.
Potencial de acción
Las células de tipo I (glómicas) de la carótida (y de los cuerpos aórticos) derivan del neuroectodermo y, por lo tanto, son eléctricamente excitables. Una disminución de la presión parcial de oxígeno, un aumento de la presión parcial de dióxido de carbono y una disminución del pH arterial pueden provocar la despolarización de la membrana celular , y afectan a esta mediante el bloqueo de las corrientes de potasio . Esta reducción del potencial de membrana abre canales de calcio dependientes del voltaje , lo que provoca un aumento de la concentración intracelular de calcio. Esto provoca la exocitosis de vesículas que contienen una variedad de neurotransmisores , entre ellos acetilcolina , noradrenalina , dopamina , adenosina , ATP , sustancia P y met-encefalina . Estos actúan sobre los receptores de las fibras nerviosas aferentes que se encuentran en aposición a la célula glómica para provocar un potencial de acción.
Relé
La retroalimentación del cuerpo carotídeo se envía a los centros cardiorrespiratorios en el bulbo raquídeo a través de las ramas aferentes del nervio glosofaríngeo . (Las fibras eferentes de los quimiorreceptores del cuerpo aórtico son transmitidas por el nervio vago ). Estos centros, a su vez, regulan la respiración y la presión arterial, y la hipoxia provoca un aumento de la ventilación.
Importancia clínica

Paraganglioma
Un paraganglioma es un tumor que puede afectar el cuerpo carotídeo y suele ser benigno . En raras ocasiones, un neuroblastoma maligno puede originarse en el cuerpo carotídeo.
Véase también
Lista de los distintos tipos de células del cuerpo humano adulto
Referencias
- ^ "Cuerpo carotídeo y seno carotídeo: información general". Protocolos de cabeza y cuello de Iowa. medicine.uiowa.edu . Consultado el 23 de octubre de 2019 .
- ^ Hall, John Edward (20 de mayo de 2015). Guyton y Hall, libro de texto de fisiología médica (13.ª ed.). Filadelfia, Pensilvania. ISBN 978-1-4557-7005-2.OCLC 900869748 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Kadasne, DK (2009). Kadasne's Textbook of Anatomy (1.ª ed.). Nueva Delhi: Jaypee Brothers Medical Publishers. pág. 916. ISBN 978-81-8448-455-7.OCLC 682534511 .
- ^ Gonzalez C, Almaraz L, Obeso A, Rigual R (1994). "Quimiorreceptores del cuerpo carotídeo: de estímulos naturales a descargas sensoriales". Physiol. Rev. 74 (4): 829–98. doi :10.1152/physrev.1994.74.4.829. PMID 7938227.
- ^ Hall, John Edward (20 de mayo de 2015). Guyton y Hall, libro de texto de fisiología médica (13.ª ed.). Filadelfia, Pensilvania. ISBN 978-1-4557-7005-2.OCLC 900869748 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Ward JP (2008). "Sensores de oxígeno en contexto". Biochim Biophys Acta . 1777 (1): 1–14. doi : 10.1016/j.bbabio.2007.10.010 . PMID 18036551.
- ^ Peng YJ, Nanduri J, Raghuraman G, Souvannakitti D, Gadalla MM, Kumar GK, Snyder SH, Prabhakar NR. (2010). El H2S media la detección de O2 en el cuerpo carotídeo PNAS 107 (23) 10719-10724. doi :10.1073/pnas.1005866107
- ^ González C, Sanz-Alfayate G, Agapito MT, Gómez-Niño A, Rocher A, Obeso A (2002). "Sensores de oxígeno en contexto". Respir Physiol Neurobiol . 132 (1): 17–41. doi :10.1016/S1569-9048(02)00047-2. PMID 12126693. S2CID 25674998.
- ^ Williams SE, Wootton P, Mason HS, Bould J, Iles DE, Riccardi D, Peers C, Kemp PJ (2004). "La hemoxigenasa-2 es un sensor de oxígeno para un canal de potasio sensible al calcio". Science . 306 (5704): 2093–7. Bibcode :2004Sci...306.2093W. doi : 10.1126/science.1105010 . PMID 15528406. S2CID 41811182.
- ^ Wyatt CN, Mustard KJ, Pearson SA, Dallas ML, Atkinson L, Kumar P, Peers C, Hardie DG, Evans AM (2007). "La proteína quinasa activada por AMP media la excitación del cuerpo carotídeo por hipoxia". J Biol Chem . 282 (11): 8092–8. doi : 10.1074/jbc.M608742200 . PMC 1832262 . PMID 17179156.
- ^ Buckler KJ, Williams BA, Honore E (2000). "Un canal de potasio de fondo similar a TASK sensible al oxígeno, al ácido y a los anestésicos en células quimiorreceptoras arteriales de rata". J. Physiol . 525 (1): 135–142. doi :10.1111/j.1469-7793.2000.00135.x. PMC 2269923 . PMID 10811732.

