Subunidad alfa-5 del receptor neuronal de acetilcolina
| Subunidad alfa-5 del receptor neuronal de acetilcolina | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | ARNm5 | ||||||
| Símbolos alternativos | ARNm5 | ||||||
| Gen NCBI | 1138 | ||||||
| OMI | 1188505 | ||||||
| Secuencia de referencia | Número nuevo_000745 | ||||||
| Protección unificada | P30532 | ||||||
| Otros datos | |||||||
| Lugar | Crónica 15 q25.1 | ||||||
| |||||||
La subunidad alfa-5 del receptor de acetilcolina neuronal , o receptor de acetilcolina nicotínico alfa-5 (α5 nAChR), también conocida como receptor α5, es un tipo de subunidad neuronal regulada por ligando del receptor de acetilcolina nicotínico implicada en la regulación del dolor codificada en humanos por el gen CHRNA5 . Este receptor se asocia comúnmente con la adicción a la nicotina , la inmunoterapia , el cáncer , el dolor y la atención .
Descripción general

Existen dos clases principales de receptores de acetilcolina : los receptores nicotínicos , que se unen a la nicotina exógena , y los receptores muscarínicos , que se unen a la muscarina exógena . Los receptores nicotínicos de acetilcolina (nAChR) se descubrieron inicialmente a través de la aplicación y unión de la nicotina, sin embargo, la acetilcolina endógena es el ligando que se une en condiciones fisiológicas normales. Los nAChR son receptores ionotrópicos de un solo canal que se encuentran en todo el cerebro y el cuerpo y que permiten que los cationes fluyan dentro y fuera de las células. Estos receptores constan de cinco subunidades transmembrana con el nAChR α5 definido por la presencia de la subunidad α5. El nAChR α5 se encuentra en varias áreas del cerebro, incluida la corteza , el hipocampo , el hipotálamo , el colículo inferior , la habénula medial , el bulbo olfatorio y el cuerpo estriado . [1] El α5 nAChR está involucrado en la modulación de la inflamación crónica y la lesión de los nervios periféricos . [2] La acetilcolina se une en la corteza, el hipocampo, el hipotálamo, el colículo inferior, el cuerpo estriado y el bulbo olfatorio. [3] CHRNA5 se encuentra en un grupo de genes en el cromosoma 15q24 junto con CHRNA3 y CHRNB4 . [4] Los receptores homopentaméricos con cinco sitios de unión de acetilcolina contienen dos subunidades a (a2-a4 o a6) y dos subunidades que no son a (B2 o B4). Las subunidades alfa5 tienden a ser la quinta que no se une directamente a la acetilcolina y actúan como subunidades auxiliares. Más bien, pueden ser importantes para la orientación y localización del receptor en la membrana celular . [4] Las subunidades alfa normalmente se ensamblan en conjuntos de nAChR que contienen alfa3B4 y alfa4-beta2. Estos receptores se han encontrado en neuronas dopaminérgicas del cuerpo estriado de roedores y están involucrados en la liberación de DA tras la estimulación con nicotina. Además de las neuronas DA, las subunidades alfa5 también se expresan en neuronas GABAérgicas del VTA y el cuerpo estriado. [4]
Desarrollo
La subunidad alfa5 es importante durante el desarrollo y la maduración de las neuronas piramidales prefrontales IV. La disfunción colinérgica durante el desarrollo causa déficits de atención observados en enfermedades como la esquizofrenia , los trastornos del desarrollo neurológico , el autismo y la epilepsia . La mayoría de las neuronas colinérgicas se desarrollan en el período perinatal en humanos. Los cambios madurativos que ocurren en las dendritas durante el desarrollo están ausentes en los ratones alfa5 -/-, lo que indica que la subunidad alfa5 es necesaria para la maduración adecuada de las células piramidales prefrontales . [5]
Adicción a la nicotina y abstinencia
La adicción a la nicotina está modulada por el sistema de recompensa de dopamina mesocorticolímbico que impulsa la naturaleza gratificante de la nicotina; el sistema mesocorticolímbico está involucrado en la autoestimulación y el procesamiento de una recompensa ambiental . [6] [7] Por ejemplo, este sistema está activo mientras se consumen alimentos altamente calóricos o mientras se juega. Tras la administración de nicotina, hay un aumento de la tasa de disparo mediada por las neuronas de dopamina del mesencéfalo dentro de este sistema. A través de la exposición continua, a menudo se produce dependencia a la que siguen síntomas de abstinencia como antojos, irritación, inquietud, alteraciones del sueño , aumento de peso, ansiedad y dificultad para concentrarse. [8] [9] Las subunidades implicadas en el síndrome de abstinencia incluyen α5, α2 y B4 dentro del complejo habenular epitalámico y sus proyecciones. [10] La habénula medial (MHb) y su proyección al núcleo interpeduncular (IPN) contienen una densa expresión de subunidades α5 nAChR. [11]

En vivoestudios
Los estudios han demostrado que la eliminación de las subunidades α5 nAChR de los ratones (α5 nAChR null) los hará menos sensibles a los efectos agudos de la nicotina. [12] Los ratones mostraron una disminución de la locomoción en una prueba de campo abierto y menos convulsiones inducidas por la nicotina. [11] Otros estudios han demostrado que los ratones α5 nAChR null muestran menos signos de dependencia y reducen los comportamientos similares a la ansiedad. [11] Debido a que los ratones knockout muestran menos aversión al aumento de la ingesta de nicotina, tienden a autoadministrarse en dosis mucho más altas que los ratones de tipo salvaje. Sin embargo, la reintroducción de la subunidad alfa 5 en la habénula medial en ratones knockout restableció los niveles normales de autoadministración de nicotina. Esto demuestra que la expresión de la subunidad alfa 5 en la habénula medial es suficiente para restablecer la aversión a la nicotina. [13] Por el contrario, la supresión selectiva de las subunidades α5 en la vía habénulo-interpeduncular en ratones de tipo salvaje no modificó los efectos estimulantes observados en los ratones knockout, lo que demuestra que la subunidad no es necesaria para la aversión a la nicotina y que otras áreas del cerebro pueden compensar este comportamiento. [12]
En un estudio de preferencia de lugar condicionado (CPP), los investigadores entrenaron a ratones para asociar la administración de nicotina con una cámara y la administración de solución salina en una cámara adyacente. Con dosis bajas de nicotina, los ratones knockout alfa5 y los ratones de tipo salvaje mostraron preferencia por la cámara de nicotina. Sin embargo, con dosis altas de nicotina, solo los ratones knockout alfa5 prefirieron la cámara de nicotina [13], lo que demuestra que los ratones knockout alfa5 aún experimentaban los aspectos gratificantes de la nicotina, pero no los comportamientos aversivos normales con la sobredosis de nicotina.
Los estudios de Tuesta et al. 2011 han demostrado que la curva dosis-respuesta es similar cuando se comparan ratones knockout con ratones de tipo salvaje; sin embargo, los ratones knockout consumieron mayores cantidades de nicotina, lo que dio como resultado que la parte descendente de la curva dosis-respuesta descendiera más lentamente en los ratones knockout. Se ha demostrado una mayor respuesta a la nicotina en la parte ascendente de la curva, lo que demuestra mayores propiedades gratificantes. [12]
Estudios humanos
La nicotina es consumida comúnmente por las personas por sus propiedades gratificantes que resultan en dependencia, adicción y abstinencia. [14] Estudios humanos han demostrado que las personas con un polimorfismo de un solo nucleótido (SNP) dentro del gen codificador α5 nAChR ( CHRNA5 , rs16969968) se correlaciona con un mayor riesgo de dependencia de la nicotina y placer junto con un tabaquismo más intenso. [11] [15] [16] [17] Este SNP en particular da como resultado una sustitución de ácido aspártico a asparagina en el residuo de aminoácido 398 (D398N). [12] El rs16969968 dentro de CHRNA5 causa una reducción en la función del receptor que está involucrada en producir síntomas de abstinencia . Los individuos con este SNP se encuentran comúnmente en aquellos de ascendencia europea; existe un riesgo aproximadamente 30% mayor de dependencia de la nicotina en individuos que portan una sola copia de la variante y aproximadamente un riesgo 50% mayor en individuos con dos copias. [12] Otros estudios han demostrado que las personas con este SNP desarrollan dependencia de la nicotina a una edad más temprana. [12] Los investigadores concluyen que menos efectos aversivos de la nicotina promoverían los efectos gratificantes o el impulso hedónico que harían que las personas pasaran del abuso de la nicotina a la dependencia. [11] [18] Además, las variantes de SNP dentro de rs16969968 en CHRNA5 se han asociado con comportamientos relacionados con el tabaquismo, como una mayor prevalencia de fumadores frente a no fumadores. [19]
Atención y cognición
La atención es un aspecto importante de la memoria que permite retener la información en la mente y mantener el foco en presencia de distracciones para lograr un comportamiento dirigido a un objetivo. La memoria de trabajo es un aspecto similar del aprendizaje , sin embargo, la principal diferencia entre los dos es que la memoria de trabajo también requiere la manipulación mental de la información. La estructura más comúnmente asociada con la atención es la corteza prefrontal que media el control de arriba hacia abajo de los procesos cognitivos complejos. [20] La acetilcolina es un neuromodulador que se estudia de cerca por su papel en el aprendizaje y la memoria; está involucrado en la adquisición, consolidación y recuerdo.
En vivoestudios
Los investigadores especulan que las neuronas piramidales de la capa VI en la corteza prefrontal son importantes para mantener la atención en tareas cognitivamente exigentes. Estas neuronas envían proyecciones de retroalimentación al tálamo y son altamente sensibles a la acetilcolina . Los estudios in vivo han demostrado que la presencia de subunidades alfa5 de nAChR en las neuronas piramidales de la capa VI en el PFC son importantes para la atención visual. [21] En experimentos de electrofisiología de cortes , los investigadores han demostrado que las subunidades alfa5 mejoran las corrientes en el PFC de un ratón adulto. In vivo, los investigadores utilizan una tarea de reacción en serie de cinco opciones. A los animales se les da al azar 1 de 5 estímulos luminosos, y necesitan codificar y recordar la ubicación del estímulo para recibir una recompensa. Los ratones transgénicos sin el gen que codifica las subunidades alfa5 mostraron un rendimiento deficiente en la tarea de reacción en serie de cinco opciones. Esto indica que los ratones nulos alfa5 tienen déficits de atención . [5] Curiosamente, la eliminación de las subunidades alfa5 en ratones da lugar a una regulación positiva de los receptores muscarínicos de acetilcolina como respuesta de compensación excitatoria a la disfunción de los circuitos . Debido a los efectos de mejora cognitiva de los agonistas del receptor alfa5 nAChR, es un objetivo común para los trastornos neurodegenerativos con déficits cognitivos junto con el TDAH. [22]
Estudios humanos
Debido a las limitaciones técnicas de los procedimientos invasivos, hay muchos menos estudios sobre el papel de la subunidad alfa5 del receptor nAChR y la cognición. En algunos estudios se ha realizado microdiálisis en sujetos mientras formulaban tareas de atención y se ha observado un aumento significativo del eflujo de acetilcolina. [5]
Aplicación clínica
El α5 nAChR media los efectos agudos del alcohol; una deleción en este gen afecta la ingesta de alcohol en condiciones estresantes. [23] El α5 nAChR también media los efectos a corto plazo de la nicotina. [24] Los estudios han demostrado que la eliminación de la subunidad alfa5 en ratones (inhibición del α5 nAChR) aumenta la ingesta de nicotina que se recupera reintroduciendo el gen. [25] Los investigadores también han demostrado que la eliminación de la subunidad α5 solo en la habénula medial aumenta la autoadministración de nicotina, lo que demuestra que esta subunidad es necesaria para la ingesta normal de nicotina y las anomalías dentro de esta subunidad pueden contribuir a las propiedades adictivas de la nicotina. [25] Además, la subunidad alfa5 nAChR está asociada con otras formas de adicción como la cocaína. [26] Otros estudios han demostrado que los ratones knock out α5 mostraron un rendimiento atencional deteriorado. [27] Durante la estimulación vagal de alta frecuencia, los ratones deficientes en el receptor α5-nAChR experimentan una alteración de la transmisión ganglionar parasimpática cardíaca. Los estudios in vivo también han identificado al receptor α5-nAChR como un posible tratamiento para la inflamación crónica y el dolor neuropático. [28] [29]
Ligandos
| Ligando | Estructura | Función | Usar |
|---|---|---|---|
| Acetilcolina |  | Agonista | Endógeno |
| Nicotina | 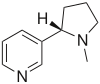 | Agonista | Droga recreativa Atención |
| Pozaniclina |  | Agonista parcial | Fármaco experimental para el TDAH, [30] la enfermedad de Alzheimer, [31] y el trastorno por consumo de tabaco [32] |
| α-Conotoxina MII [33] |  | Antagonista | |
| α-Conotoxina PnIA [33] |  | Antagonista | |
| GIC de α-conotoxina [33] |  | Antagonista | |
| α-Conotoxina TXIA [33] |  | Antagonista |
Mapa interactivo de rutas
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
- ^ El mapa interactivo de la ruta se puede editar en WikiPathways: "NicotineDopaminergic_WP1602".
Referencias
- ^ Brown RW, Collins AC, Lindstrom JM, Whiteaker P (octubre de 2007). "La eliminación de la subunidad alfa5 nicotínica reduce localmente la activación de agonistas de alta afinidad sin alterar el número de receptores nicotínicos". Journal of Neurochemistry . 103 (1): 204–215. doi : 10.1111/j.1471-4159.2007.04700.x . PMID 17573823. S2CID 28394031.
- ^ Bagdas D, AlSharari SD, Freitas K, Tracy M, Damaj MI (octubre de 2015). "El papel de los receptores nicotínicos de acetilcolina alfa5 en modelos de ratón de dolor inflamatorio crónico y neuropático". Farmacología bioquímica . Receptores nicotínicos de acetilcolina como objetivos terapéuticos: fronteras emergentes en investigación básica y ciencia clínica (satélite de la reunión de 2015 de la Society for Neuroscience) 14-15 de octubre, Chicago, IL, EE. UU. 97 (4): 590–600. doi :10.1016/j.bcp.2015.04.013. PMC 4600420. PMID 25931144 .
- ^ Brown RW, Collins AC, Lindstrom JM, Whiteaker P (octubre de 2007). "La eliminación de la subunidad alfa5 nicotínica reduce localmente la activación de agonistas de alta afinidad sin alterar el número de receptores nicotínicos". Journal of Neurochemistry . 103 (1): 204–215. doi : 10.1111/j.1471-4159.2007.04700.x . PMID 17573823. S2CID 28394031.
- ^ abc Greenbaum L, Lerer B (octubre de 2009). "Contribución diferencial de la variación genética en múltiples receptores colinérgicos nicotínicos cerebrales a la dependencia de la nicotina: progreso reciente y nuevas preguntas abiertas". Psiquiatría molecular . 14 (10): 912–945. doi : 10.1038/mp.2009.59 . PMID 19564872. S2CID 9769700.
- ^ abc Proulx E, Piva M, Tian MK, Bailey CD, Lambe EK (abril de 2014). "Receptores nicotínicos de acetilcolina en los circuitos de atención: el papel de las neuronas de la capa VI de la corteza prefrontal". Ciencias de la vida celular y molecular . 71 (7): 1225–1244. doi :10.1007/s00018-013-1481-3. PMC 3949016 . PMID 24122021.
- ^ de Kloet SF, Mansvelder HD, De Vries TJ (octubre de 2015). "Modulación colinérgica de las vías de la dopamina a través de los receptores nicotínicos de acetilcolina". Farmacología bioquímica . 97 (4): 425–438. doi :10.1016/j.bcp.2015.07.014. PMID 26208783.
- ^ Demeter E, Sarter M (enero de 2013). "Aprovechamiento del sistema colinérgico cortical para mejorar la atención". Neurofarmacología . 64 (1): 294–304. doi :10.1016/j.neuropharm.2012.06.060. PMC 3445745 . PMID 22796110.
- ^ Wang JC, Kapoor M, Goate AM (22 de septiembre de 2012). "La genética de la dependencia de sustancias". Revisión anual de genómica y genética humana . 13 (1): 241–261. doi :10.1146/annurev-genom-090711-163844. PMC 3474605 . PMID 22703173.
- ^ Wittenberg RE, Wolfman SL, De Biasi M, Dani JA (octubre de 2020). "Receptores nicotínicos de acetilcolina y adicción a la nicotina: una breve introducción". Neurofarmacología . 177 : 108256. doi :10.1016/j.neuropharm.2020.108256. PMC 7554201 . PMID 32738308.
- ^ Antolin-Fontes B, Ables JL, Görlich A, Ibañez-Tallon I (septiembre de 2015). "La vía habénulo-interpeduncular en la aversión y abstinencia a la nicotina". Neurofarmacología . 96 (Pt B): 213–222. doi :10.1016/j.neuropharm.2014.11.019. PMC 4452453 . PMID 25476971.
- ^ abcde De Biasi M, Dani JA (21 de julio de 2011). "Recompensa, adicción, abstinencia a la nicotina". Revisión anual de neurociencia . 34 (1): 105–130. doi :10.1146/annurev-neuro-061010-113734. PMC 3137256 . PMID 21438686.
- ^ abcdef Tuesta LM, Fowler CD, Kenny PJ (octubre de 2011). "Avances recientes en la comprensión de los mecanismos de señalización del receptor nicotínico que regulan la conducta de autoadministración de fármacos". Farmacología bioquímica . 82 (8): 984–995. doi :10.1016/j.bcp.2011.06.026. PMC 3163076 . PMID 21740894.
- ^ ab Stoker AK, Markou A (agosto de 2013). "Descifrando la neurobiología de la dependencia de la nicotina utilizando ratones modificados genéticamente". Current Opinion in Neurobiology . 23 (4): 493–499. doi :10.1016/j.conb.2013.02.013. PMC 3735838 . PMID 23545467.
- ^ De Biasi M, Dani JA (21 de julio de 2011). "Recompensa, adicción, abstinencia a la nicotina". Revista Anual de Neurociencia . 34 (1): 105–130. doi :10.1146/annurev-neuro-061010-113734. PMC 3137256 . PMID 21438686.
- ^ Improgo MR, Scofield MD, Tapper AR, Gardner PD (septiembre de 2010). "Del tabaquismo al cáncer de pulmón: la conexión CHRNA5/A3/B4". Oncogene . 29 (35): 4874–4884. doi :10.1038/onc.2010.256. PMC 3934347 . PMID 20581870.
- ^ Improgo MR, Scofield MD, Tapper AR, Gardner PD (octubre de 2010). "El grupo de genes del receptor nicotínico de acetilcolina CHRNA5/A3/B4: función dual en la adicción a la nicotina y el cáncer de pulmón". Progress in Neurobiology . 92 (2): 212–226. doi :10.1016/j.pneurobio.2010.05.003. PMC 2939268 . PMID 20685379.
- ^ Russo P, Cesario A, Rutella S, Veronesi G, Spaggiari L, Galetta D, et al. (31 de diciembre de 2010). "Impacto de la variabilidad genética en los receptores nicotínicos de acetilcolina en la adicción a la nicotina y el tratamiento para dejar de fumar". Química medicinal actual . 18 (1): 91–112. doi :10.2174/092986711793979715. PMID 21110812.
- ^ Greenbaum L, Lerer B (octubre de 2009). "Contribución diferencial de la variación genética en múltiples receptores colinérgicos nicotínicos cerebrales a la dependencia de la nicotina: progreso reciente y nuevas preguntas abiertas". Psiquiatría molecular . 14 (10): 912–945. doi : 10.1038/mp.2009.59 . PMID 19564872. S2CID 9769700.
- ^ Ware JJ, van den Bree M, Munafò MR (noviembre de 2012). "De hombres a ratones: CHRNA5/CHRNA3, comportamiento de fumar y enfermedad". Nicotine & Tobacco Research . 14 (11): 1291–1299. doi :10.1093/ntr/nts106. PMC 3482013 . PMID 22544838.
- ^ Bloem B, Poorthuis RB, Mansvelder HD (11 de marzo de 2014). "Modulación colinérgica de la corteza prefrontal medial: el papel de los receptores nicotínicos en la atención y la regulación de la actividad neuronal". Frontiers in Neural Circuits . 8 : 17. doi : 10.3389/fncir.2014.00017 . PMC 3949318 . PMID 24653678.
- ^ Bailey CD, De Biasi M, Fletcher PJ, Lambe EK (julio de 2010). "La subunidad alfa 5 del receptor nicotínico de acetilcolina desempeña un papel clave en los circuitos y la precisión de la atención". The Journal of Neuroscience . 30 (27): 9241–9252. doi :10.1523/jneurosci.2258-10.2010. PMC 3004929 . PMID 20610759.
- ^ Wallace TL, Ballard TM, Pouzet B, Riedel WJ, Wettstein JG (agosto de 2011). "Objetivos farmacológicos para la mejora cognitiva en trastornos neuropsiquiátricos" (PDF) . Farmacología, bioquímica y comportamiento . 99 (2): 130–145. doi :10.1016/j.pbb.2011.03.022. PMID 21463652. S2CID 25911863.
- ^ Dawson A, Wolstenholme JT, Roni MA, Campbell VC, Jackson A, Slater C, et al. (agosto de 2018). "La inactivación de la subunidad alfa 5 de los receptores nicotínicos de acetilcolina altera los efectos conductuales mediados por el etanol y la recompensa en ratones". Neurofarmacología . 138 : 341–348. doi :10.1016/j.neuropharm.2018.06.031. PMC 6400055 . PMID 29944862.
- ^ Salas R, Orr-Urtreger A, Broide RS, Beaudet A, Paylor R, De Biasi M (mayo de 2003). "La subunidad alfa 5 del receptor nicotínico de acetilcolina media los efectos a corto plazo de la nicotina in vivo". Farmacología molecular . 63 (5): 1059–1066. doi :10.1124/mol.63.5.1059. PMID 12695534. S2CID 97775995.
- ^ ab Fowler CD, Lu Q, Johnson PM, Marks MJ, Kenny PJ (marzo de 2011). "La señalización de la subunidad del receptor nicotínico α5 habenular controla la ingesta de nicotina". Nature . 471 (7340): 597–601. Bibcode :2011Natur.471..597F. doi :10.1038/nature09797. PMC 3079537 . PMID 21278726.
- ^ Forget B, Icick R, Robert J, Correia C, Prevost MS, Gielen M, et al. (febrero de 2021). "Las alteraciones en el gen de la subunidad alfa 5 del receptor nicotínico afectan de manera diferencial las etapas tempranas y tardías de la adicción a la cocaína: un estudio traslacional en ratas transgénicas y pacientes" (PDF) . Progress in Neurobiology . 197 : 101898. doi :10.1016/j.pneurobio.2020.101898. PMID 32841724. S2CID 221235364.
- ^ Bailey CD, De Biasi M, Fletcher PJ, Lambe EK (julio de 2010). "La subunidad alfa 5 del receptor nicotínico de acetilcolina desempeña un papel clave en los circuitos y la precisión de la atención". The Journal of Neuroscience . 30 (27): 9241–9252. doi :10.1523/jneurosci.2258-10.2010. PMC 3004929 . PMID 20610759.
- ^ Antolin-Fontes B, Ables JL, Görlich A, Ibañez-Tallon I (septiembre de 2015). "La vía habénulo-interpeduncular en la aversión y abstinencia a la nicotina". Neurofarmacología . 96 (Pt B): 213–222. doi :10.1016/j.neuropharm.2014.11.019. PMC 4452453 . PMID 25476971.
- ^ Decker MW, Meyer MD, Sullivan JP (octubre de 2001). "El potencial terapéutico de los agonistas del receptor nicotínico de acetilcolina para el control del dolor". Opinión de expertos sobre fármacos en investigación . 10 (10): 1819–1830. doi :10.1517/13543784.10.10.1819. PMID 11772288. S2CID 24924290.
- ^ "Estudio de seguridad y tolerabilidad de ABT-089 en adultos con trastorno por déficit de atención e hiperactividad (TDAH)". ClinicalTrials.gov .
- ^ "Estudio de la seguridad a largo plazo del ABT-089 para sujetos con enfermedad de Alzheimer de leve a moderada". ClinicalTrials.gov .
- ^ Sullivan JP, Donnelly-Roberts D, Briggs CA, Anderson DJ, Gopalakrishnan M, Xue IC, et al. (octubre de 1997). "ABT-089 [2-metil-3-(2-(S)-pirrolidinilmetoxi)piridina]: I. Un modulador de canal colinérgico potente y selectivo con propiedades neuroprotectoras". Revista de farmacología y terapéutica experimental . 283 (1): 235–246. PMID 9336329.
- ^ abcd Gotti C, Marks MJ, Millar NS, Wonnacott S (16 de septiembre de 2019). "Receptores nicotínicos de acetilcolina (versión 2019.4) en la base de datos de la Guía de farmacología de la IUPHAR/BPS". Guía de farmacología de la IUPHAR/BPS CITE . 2019 (4). doi : 10.2218/gtopdb/F76/2019.4 . ISSN 2633-1020. S2CID 203817110.