Regioselectividad
En química orgánica , la regioselectividad es la preferencia del enlace o ruptura química en una dirección sobre todas las demás direcciones posibles. [1] [2] A menudo se puede aplicar a cuál de las muchas posiciones posibles afectará un reactivo , como qué protón abstraerá una base fuerte de una molécula orgánica , o en qué lugar de un anillo de benceno sustituido se agregará un sustituyente adicional.
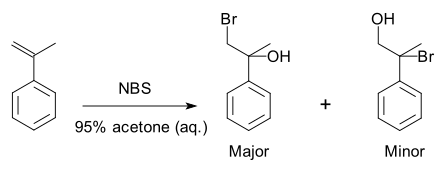
Un ejemplo específico es una reacción de formación de halohidrina con 2-propenilbenceno : [3]
Debido a la preferencia por la formación de un producto sobre otro, la reacción es selectiva. Esta reacción es regioselectiva porque genera selectivamente un isómero constitucional en lugar del otro.
Se han formulado varios ejemplos de regioselectividad como reglas para ciertas clases de compuestos bajo ciertas condiciones, muchas de las cuales tienen nombre. Entre las primeras que se presentan a los estudiantes de química están la regla de Markovnikov para la adición de ácidos próticos a alquenos y la regla de Fürst-Plattner para la adición de nucleófilos a derivados de ciclohexeno , especialmente derivados de epóxido . [4] [5]
La regioselectividad en las reacciones de cierre de anillo está sujeta a las reglas de Baldwin . Si hay dos o más orientaciones que pueden generarse durante una reacción, una de ellas es dominante (por ejemplo, adición Markovnikov/anti-Markovnikov a través de un doble enlace ).
La regioselectividad también se puede aplicar a reacciones específicas como la adición a ligandos pi .
La selectividad también ocurre en las inserciones de carbenos , por ejemplo en la reacción de Baeyer-Villiger . En esta reacción, un oxígeno se inserta regioselectivamente cerca de un grupo carbonilo adyacente. En las cetonas , esta inserción se dirige hacia el carbono que está más altamente sustituido (es decir, de acuerdo con la regla de Markovnikov). Por ejemplo, en un estudio que involucraba acetofenonas , este oxígeno se insertó preferentemente entre el carbonilo y el anillo aromático para dar ésteres aromáticos de acetilo en lugar de benzoatos de metilo . [6]
Véase también
- Quimioselectividad
- Criptorregioquímica
- Enantioselectividad
- Tautomería ceto-enólica
- Estereoselectividad
- La regla de Zaitsev
Referencias
- ^ March, Jerry (1985), Química orgánica avanzada: reacciones, mecanismos y estructura, 3.ª edición, Nueva York: Wiley, ISBN 9780471854722, OCLC 642506595
- ^ http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch06/ch6-0-1.html Regioselectividad y estereoselectividad
- ^ Regioselectividad en síntesis orgánica: preparación de la bromohidrina de alfa-metilestireno Brad Andersh, Kathryn N. Kilby, Meghan E. Turnis y Drew L. Murphy 102 Journal of Chemical Education • Vol. 85 No. 1 Enero de 2008
- ^ W. Markownikoff (1870). "Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren". Annalen der Pharmacie 153 (1): 228–259.
- ^ Fürst, A.; Plattner, PA Helv. Chim. Actas 1949, 32, 275
- ^ Palmer, Billy W.; Fry, Arthur (1970). "Variación del efecto isotópico del carbono 14 con sustituyentes y el mecanismo de oxidación del ácido m-cloroperbenzoico de acetofenonas para-sustituidas laeladas". Journal of the American Chemical Society . 92 (8): 2580–2581. doi :10.1021/ja00711a079.