Fosfofructoquinasa 2
| 6-fosfofructo-2-quinasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dímero de 6-fosfofructo-2-quinasa, corazón humano | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.7.1.105 | ||||||||
| N.º CAS | 78689-77-7 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa del hígado humano | |||||||||
| Identificadores | |||||||||
| Símbolo | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| Clan Pfam | CL0023 | ||||||||
| Interprofesional | IPR013079 | ||||||||
| PROSITIO | PDOC00158 | ||||||||
| SCOP2 | 1bif / ALCANCE / SUPFAM | ||||||||
| |||||||||
| 6-fosfofructo-2-quinasa/fructosa-bisfosfatasa-2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Estructura de PFK2. Se muestran el dominio quinasa (cian) y el dominio fosfatasa (verde). | |||||||||||
| Identificadores | |||||||||||
| Símbolo | 6PF2K | ||||||||||
| Pfam | PF01591 | ||||||||||
| Interprofesional | IPR013079 | ||||||||||
| PROSITIO | PDOC00158 | ||||||||||
| SCOP2 | 1bif / ALCANCE / SUPFAM | ||||||||||
| |||||||||||
| fructosa-bisfosfatasa-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | FBPasa-2 | ||||||||
| Pfam | PF00316 | ||||||||
| Interprofesional | IPR028343 | ||||||||
| PROSITIO | PDOC00114 | ||||||||
| |||||||||
La fosfofructoquinasa-2 ( 6-fosfofructo-2-quinasa , PFK-2 ) o fructosa bisfosfatasa-2 ( FBPasa-2 ), es una enzima indirectamente responsable de regular las tasas de glucólisis y gluconeogénesis en las células. Cataliza la formación y degradación de un regulador alostérico significativo, la fructosa-2,6-bisfosfato (Fru-2,6-P 2 ) a partir del sustrato fructosa-6-fosfato . La Fru-2,6-P 2 contribuye al paso determinante de la velocidad de la glucólisis, ya que activa la enzima fosfofructoquinasa 1 en la vía de la glucólisis e inhibe la fructosa-1,6-bisfosfatasa 1 en la gluconeogénesis. [1] Dado que la Fru-2,6-P 2 regula diferencialmente la glucólisis y la gluconeogénesis, puede actuar como una señal clave para cambiar entre las vías opuestas. [1] Debido a que la PFK-2 produce Fru-2,6-P 2 en respuesta a la señalización hormonal, el metabolismo puede controlarse de manera más sensible y eficiente para alinearse con las necesidades glucolíticas del organismo. [2] Esta enzima participa en el metabolismo de la fructosa y la manosa . La enzima es importante en la regulación del metabolismo hepático de carbohidratos y se encuentra en mayores cantidades en el hígado, el riñón y el corazón . En los mamíferos, varios genes a menudo codifican diferentes isoformas, cada una de las cuales difiere en su distribución tisular y actividad enzimática . [3] La familia descrita aquí tiene un parecido con las fosfofructoquinasas impulsadas por ATP; sin embargo, comparten poca similitud de secuencia , aunque algunos residuos parecen clave para su interacción con la fructosa 6-fosfato . [4]
La PFK-2 se conoce como la "enzima bifuncional" debido a su notable estructura: aunque ambas están ubicadas en un homodímero proteico , sus dos dominios actúan como enzimas que funcionan de forma independiente. [5] Un extremo actúa como dominio de quinasa (para PFK-2) mientras que el otro extremo actúa como dominio de fosfatasa (FBPasa-2). [6]
En los mamíferos, los mecanismos genéticos codifican diferentes isoformas de PFK-2 para satisfacer las necesidades específicas de cada tejido. Si bien la función general sigue siendo la misma, las isoformas presentan ligeras diferencias en las propiedades enzimáticas y están controladas por diferentes métodos de regulación; estas diferencias se analizan a continuación. [7]
Estructura
Los monómeros de la proteína bifuncional se dividen claramente en dos dominios funcionales. El dominio de la quinasa se encuentra en el extremo N-terminal. [8] Consiste en una lámina β central de seis cadenas, con cinco cadenas paralelas y una cadena de borde antiparalela, rodeada por siete hélices α. [6] El dominio contiene un pliegue de unión a nucleótidos (nbf) en el extremo C-terminal de la primera cadena β. [9] El dominio PFK-2 parece estar estrechamente relacionado con la superfamilia de proteínas de unión a mononucleótidos, incluida la adenilato ciclasa . [10]
Por otra parte, el dominio de la fosfatasa se encuentra en el extremo C-terminal. [11] Se asemeja a la familia de proteínas que incluyen las fosfoglicerato mutasas y las fosfatasas ácidas. [10] [12] El dominio tiene una estructura mixta α/β, con una lámina β central de seis cadenas, más un subdominio α-helicoidal adicional que cubre el presunto sitio activo de la molécula. [6] Finalmente, la región N-terminal modula las actividades de PFK-2 y FBPasa2, y estabiliza la forma dimérica de la enzima. [12] [13]
Si bien este núcleo catalítico central permanece conservado en todas las formas de PFK-2, existen ligeras variaciones estructurales en las isoformas como resultado de diferentes secuencias de aminoácidos o empalme alternativo. [14] Con algunas excepciones menores, el tamaño de las enzimas PFK-2 suele rondar los 55 kDa. [1]
Los investigadores plantean la hipótesis de que la estructura bifuncional única de esta enzima surgió de un evento de fusión genética entre una PFK-1 bacteriana primordial y una mutasa/fosfatasa primordial. [15]
Función
La función principal de esta enzima es sintetizar o degradar el regulador alostérico Fru-2,6-P 2 en respuesta a las necesidades glucolíticas de la célula u organismo, como se muestra en el diagrama adjunto.
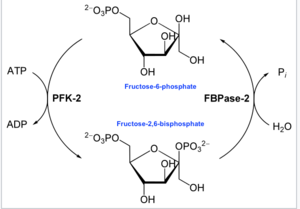
En enzimología , una 6-fosfofructo-2-quinasa ( EC 2.7.1.105) es una enzima que cataliza la reacción química :
- ATP + beta-D-fructosa 6-fosfato ADP + beta-D-fructosa 2,6-bisfosfato [16]
De esta manera, el dominio quinasa hidroliza el ATP para fosforilar el carbono 2 de la fructosa-6-fosfato, lo que produce Fru-2,6-P 2 y ADP . En la reacción se forma un intermediario de fosfohistidina. [17]
- En el otro extremo, el dominio de la fructosa-2,6-bisfosfato 2-fosfatasa ( EC 3.1.3.46) desfosforila Fru-2,6-P 2 con la adición de agua. Esta reacción química opuesta es:
- beta-D-fructosa 2,6-bisfosfato + H 2 O D-fructosa 6-fosfato + fosfato [18]
Debido a las funciones duales de la enzima, se puede clasificar en múltiples familias. A través de la categorización por la reacción de la quinasa, esta enzima pertenece a la familia de las transferasas , específicamente aquellas que transfieren grupos que contienen fósforo ( fosfotransferasas ) con un grupo alcohol como aceptor. [16] Por otro lado, la reacción de la fosfatasa es característica de la familia de las hidrolasas , específicamente aquellas que actúan sobre enlaces monoéster fosfóricos . [18]
Regulación
En casi todas las isoformas, la PFK-2 sufre una modificación covalente a través de la fosforilación/desfosforilación en función de la señalización hormonal de la célula. La fosforilación de un residuo específico puede provocar un cambio que estabilice la función del dominio de la quinasa o de la fosfatasa. Esta señal de regulación controla así si se sintetizará o degradará F-2,6-P 2. [19]
Además, la regulación alostérica de PFK2 es muy similar a la regulación de PFK1 . [20] Los altos niveles de AMP o grupo fosfato significan un estado de carga de energía baja y por lo tanto estimulan PFK2. Por otro lado, una alta concentración de fosfoenolpiruvato (PEP) y citrato significa que hay un alto nivel de precursor biosintético y por lo tanto inhibe PFK2. A diferencia de PFK1, PFK2 no se ve afectada por la concentración de ATP. [21]
Isoenzimas
Las isoenzimas proteicas son enzimas que catalizan la misma reacción pero están codificadas con diferentes secuencias de aminoácidos y, como tal, muestran ligeras diferencias en las características proteicas. En los seres humanos, los cuatro genes que codifican las proteínas de la fosfofructoquinasa 2 son PFKFB-1 , PFKFB2 , PFKFB3 y PFKFB4 . [5]
Hasta la fecha se han descrito múltiples isoformas de la proteína en mamíferos, y las diferencias aumentan por la transcripción de diferentes enzimas o por un empalme alternativo. [22] [23] [24] Si bien el núcleo estructural que cataliza la reacción PFK-2/FBPasa-2 está altamente conservado en todas las isoformas, las principales diferencias surgen de secuencias flanqueantes altamente variables en las terminales amino y carboxilo de las isoformas. [14] Debido a que estas áreas a menudo contienen sitios de fosforilación, los cambios en la composición de aminoácidos o en la longitud de la terminal pueden dar como resultado cinéticas y características enzimáticas muy diferentes. [1] [14] Cada variante difiere en su tejido primario de expresión, en la respuesta a la regulación de la proteína quinasa y en la relación de la actividad del dominio quinasa/fosfatasa. [25] Si bien pueden existir múltiples tipos de isoenzimas en un tejido, las isoenzimas se identifican por su expresión en el tejido primario y el tejido de descubrimiento a continuación. [26]
PFKB1: Hígado, músculo y feto
| 6-fosfofructo-2-quinasa: PFKB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa del hígado humano | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.7.1.105 | ||||||||
| N.º CAS | 78689-77-7 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
Ubicado en el cromosoma X, este gen es el más conocido de los cuatro genes, particularmente porque codifica la enzima hepática altamente investigada. [22] El empalme variable de ARNm de PFKB1 produce tres promotores diferentes (L, M y F) y, por lo tanto, tres variantes específicas de tejido que difieren en la regulación: [27]
- Tipo L: tejido hepático
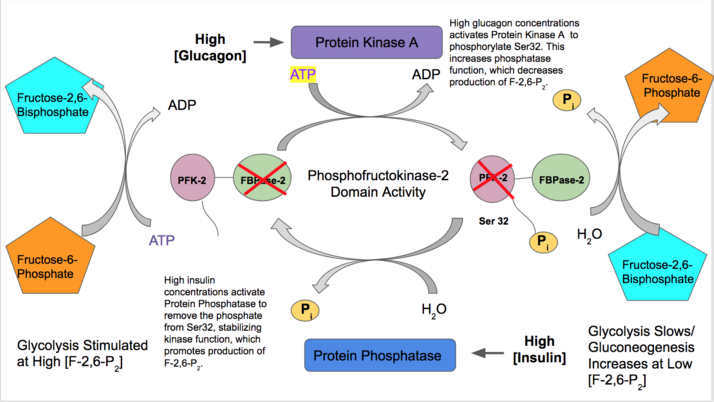
- La insulina activa la función hepática de la PFK-2 para indicar que hay una gran cantidad de glucosa en sangre disponible para la glucólisis. La insulina activa una proteína fosfatasa que desfosforila el complejo PFK-2 y provoca una actividad favorecida de la PFK-2. La PFK-2 aumenta entonces la producción de F-2,6-P 2. Como este producto activa alostéricamente la PFK-1, activa la glucólisis e inhibe la gluconeogénesis. [28]
- Por el contrario, el glucagón aumenta la actividad de la FBPasa-2. A bajas concentraciones de glucosa en sangre, el glucagón desencadena una cascada de señales de AMPc y, a su vez, la proteína quinasa A (PKA) fosforila la serina 32 cerca del extremo N. Esto inactiva la capacidad de la enzima bifuncional de actuar como quinasa y estabiliza la actividad de la fosfatasa. Por lo tanto, el glucagón disminuye las concentraciones de F-2,6-P 2, reduce las tasas de glucólisis y estimula la vía de la gluconeogénesis. [29] [30]
- Tipo M: tejido muscular esquelético; Tipo F: fibroblastos y tejido fetal [31]
- A diferencia de la mayoría de los demás tejidos con PFK-2, la PFK-2 en el músculo esquelético y el tejido fetal está regulada únicamente por las concentraciones de fructosa-6-fosfato. Dentro de su primer exón, no hay sitios reguladores que requieran fosforilación/desfosforilación para provocar un cambio en la función. Las altas concentraciones de F-6-P activarán la función de la quinasa y aumentarán las tasas de glucólisis, mientras que las bajas concentraciones de F-6-P estabilizarán la acción de la fosfatasa. [27]
| 6-fosfofructo-2-quinasa: PFKB2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Dímero de 6-fosfofructo-2-quinasa, tejido cardíaco humano | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.7.1.105 | ||||||||
| N.º CAS | 78689-77-7 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
PFKB2: Cardíaco (tipo H)
El gen PFKB2 se encuentra en el cromosoma 1. [32] Cuando circulan mayores concentraciones de adrenalina y/o hormona insulina, se activa una vía de la proteína quinasa A que fosforila la serina 466 o la serina 483 en el extremo C. [3] Alternativamente, la proteína quinasa B también puede fosforilar estos sitios reguladores, que son parte del dominio FBPasa-2. [33] Cuando se fosforila este residuo de serina, se inactiva la función de la FBPasa-2 y se estabiliza una mayor actividad de PFK-2. [27]
PFKB3: Cerebro, placenta e inducible
PFKB3 se encuentra en el cromosoma 10 y transcribe dos isoformas principales, tipo inducible y tipo ubicuo. [34] Estas formas difieren en el empalme alternativo del exón 15 en su extremo C. [35] Sin embargo, son similares en que para ambas, el glucagón activa una vía de AMP cíclico; esto da como resultado que la proteína quinasa A, la proteína quinasa C o la proteína quinasa activada por AMP fosforilen un residuo regulador en la serina 461 en el extremo C para estabilizar la función de la quinasa PFK-2. [36] Además, ambas isoformas transcritas a partir de este gen se destacan por tener una tasa particularmente alta y dominante de actividad de quinasa como lo indica una relación de actividad quinasa/fosfatasa de 700 (mientras que las isoenzimas del hígado, el corazón y los testículos respectivamente tienen relaciones PFK-2/FBPase-2 de 1,5, 80 y 4). [37] Por lo tanto, PFKB3 en particular produce consistentemente grandes cantidades de F-2,6-P 2 y mantiene altas tasas de glucólisis. [37] [38]
- Tipo I: Inducible
- El nombre de esta isoforma se debe a su mayor expresión en respuesta al estrés hipóxico; su formación es inducida por la falta de oxígeno. Este tipo se expresa en gran medida en células de rápida proliferación, especialmente en células tumorales. [39]
- Tipo U: Ubicuo; [40] también conocido como placentario [41] o cerebral [42] [43]
- Aunque se descubrió por separado en los tejidos de la placenta, los islotes β pancreáticos o el cerebro, las diversas isoformas parecen idénticas. [21] Todos los tejidos en los que se descubrió requieren una gran cantidad de energía para funcionar, lo que puede explicar la ventaja de PFKB3 de una relación de actividad quinasa-fosfatasa tan alta. [37] [44]
- La isoforma cerebral en particular tiene regiones N- y C-terminales tan largas que este tipo es casi dos veces más grande que el PFK-2 típico, con alrededor de 110 kDa. [45]
PFKB4: Testículo (tipo T)
El gen PFKB4, ubicado en el cromosoma 3, expresa PFK-2 en el tejido testicular humano. [46] Las enzimas PFK-2 codificadas por PFK-4 son comparables a la enzima hepática en tamaño, alrededor de 54 kDa, y al igual que el tejido muscular, no contienen un sitio de fosforilación de proteína quinasa. [40] Si bien menos investigaciones han aclarado los mecanismos de regulación para esta isoforma, los estudios han confirmado que la modificación de múltiples factores de transcripción en la región flanqueante 5' regula la cantidad de expresión de PFK-2 en el tejido testicular en desarrollo. [26] Esta isoforma ha sido particularmente implicada como modificada e hiperexpresada para la supervivencia de las células del cáncer de próstata. [47]
Importancia clínica
Debido a que esta familia de enzimas mantiene las tasas de glucólisis y gluconeogénesis, presenta un gran potencial para la acción terapéutica para el control del metabolismo, particularmente en la diabetes y las células cancerosas. [6] [25] Los datos también demuestran que todos los genes PFK-2 (aunque la respuesta del gen PFKB3 sigue siendo la más drástica) se activaron por limitaciones en el oxígeno. [48] Se encontró que el control de la actividad PFK-2/FBP-ase2 estaba vinculado al funcionamiento del corazón, particularmente para la isquemia , y el control contra la hipoxia . [49] Los investigadores plantean la hipótesis de que esta característica de respuesta de los genes PFK-2 puede ser una fuerte adaptación fisiológica evolutiva. [48] Sin embargo, muchos tipos de células cancerosas humanas (incluyendo leucemia, cáncer de pulmón, mama, colon, páncreas y ovario) demuestran sobreexpresión de PFK3 y/o PFK4; este cambio en el metabolismo probablemente juega un papel en el efecto Warburg . [25] [50]
Por último, el gen Pfkfb2 que codifica la proteína PFK2/FBPase2 está vinculado a la predisposición a la esquizofrenia . [51]
Referencias
- ^ abcd Kurland IJ, Pilkis SJ (junio de 1995). "Control covalente de la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa: perspectivas sobre la autorregulación de una enzima bifuncional". Protein Science . 4 (6): 1023–37. doi :10.1002/pro.5560040601. PMC 2143155 . PMID 7549867.
- ^ Lenzen S (mayo de 2014). "Una nueva visión de la glicólisis y la regulación de la glucoquinasa: historia y estado actual". The Journal of Biological Chemistry . 289 (18): 12189–94. doi : 10.1074/jbc.R114.557314 . PMC 4007419 . PMID 24637025.
- ^ ab Heine-Suñer D, Díaz-Guillén MA, Lange AJ, Rodríguez de Córdoba S (mayo de 1998). "Secuencia y estructura del gen de la isoforma cardíaca de 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa humana (PFKFB2)". Revista europea de bioquímica . 254 (1): 103–10. doi : 10.1046/j.1432-1327.1998.2540103.x . PMID 9652401.
- ^ Wang X, Deng Z, Kemp RG (septiembre de 1998). "Un residuo esencial de metionina involucrado en la unión del sustrato por fosfofructoquinasas". Biochem. Biophys. Res. Commun . 250 (2): 466–8. doi :10.1006/bbrc.1998.9311. PMID 9753654.
- ^ ab Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L (agosto de 2004). "6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa: comparación directa con una enzima bifuncional que controla la glucólisis". The Biochemical Journal . 381 (Pt 3): 561–79. doi :10.1042/BJ20040752. PMC 1133864 . PMID 15170386.
- ^ abcd Hasemann CA, Istvan ES, Uyeda K, Deisenhofer J (septiembre de 1996). "La estructura cristalina de la enzima bifuncional 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa revela homologías de dominios distintas". Structure . 4 (9): 1017–29. doi : 10.1016/S0969-2126(96)00109-8 . PMID 8805587.
- ^ Atsumi T, Nishio T, Niwa H, Takeuchi J, Bando H, Shimizu C, Yoshioka N, Bucala R, Koike T (diciembre de 2005). "Expresión de isoformas inducibles 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa / PFKFB3 en adipocitos y su papel potencial en la regulación glucolítica". Diabetes . 54 (12): 3349–57. doi : 10.2337/diabetes.54.12.3349 . PMID 16306349.
- ^ Kurland I, Chapman B, Lee YH, Pilkis S (agosto de 1995). "Reingeniería evolutiva del sitio activo de la fosfofructoquinasa: ARG-104 no estabiliza el estado de transición en la 6-fosfofructo-2-quinasa". Comunicaciones de investigación bioquímica y biofísica . 213 (2): 663–72. doi :10.1006/bbrc.1995.2183. PMID 7646523.
- ^ Walker JE, Saraste M, Runswick MJ, Gay NJ (1982). "Secuencias distantemente relacionadas en las subunidades alfa y beta de la ATP sintasa, miosina, quinasas y otras enzimas que requieren ATP y un pliegue de unión de nucleótidos común". The EMBO Journal . 1 (8): 945–51. doi :10.1002/j.1460-2075.1982.tb01276.x. PMC 553140 . PMID 6329717.
- ^ ab Jedrzejas MJ (2000). "Estructura, función y evolución de las fosfoglicerato mutasas: comparación con la fructosa-2,6-bisfosfatasa, la fosfatasa ácida y la fosfatasa alcalina". Progreso en biofísica y biología molecular . 73 (2–4): 263–87. doi : 10.1016/S0079-6107(00)00007-9 . PMID 10958932.
- ^ Li L, Lin K, Pilkis J, Correia JJ, Pilkis SJ (octubre de 1992). "6-fosfofructo-2-quinasa hepática/fructosa-2,6-bisfosfatasa. El papel de los residuos básicos del bucle de superficie en la unión del sustrato al dominio de la fructosa-2,6-bisfosfatasa". The Journal of Biological Chemistry . 267 (30): 21588–94. doi : 10.1016/S0021-9258(19)36651-7 . PMID 1328239.
- ^ ab Stryer L, Berg JM, Tymoczko JL (2008). "El equilibrio entre la glucólisis y la gluconeogénesis en el hígado es sensible a la concentración de glucosa en sangre". Bioquímica (hojas sueltas) . San Francisco: WH Freeman. págs. 466–467. ISBN 978-1-4292-3502-0.
- ^ Tominaga N, Minami Y, Sakakibara R, Uyeda K (julio de 1993). "Importancia del extremo amino terminal de la fructosa-6-fosfato, 2-quinasa:fructosa-2,6-bisfosfatasa de testículos de rata". The Journal of Biological Chemistry . 268 (21): 15951–7. doi : 10.1016/S0021-9258(18)82344-4 . PMID 8393455.
- ^ abc El-Maghrabi MR, Noto F, Wu N, Manes N (septiembre de 2001). "6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa: estructura adecuada a las necesidades, en una familia de enzimas específicas de tejido". Current Opinion in Clinical Nutrition and Metabolic Care . 4 (5): 411–8. doi :10.1097/00075197-200109000-00012. PMID 11568503. S2CID 6638455.
- ^ Bazan JF, Fletterick RJ, Pilkis SJ (diciembre de 1989). "Evolución de una enzima bifuncional: 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (24): 9642–6. Bibcode :1989PNAS...86.9642B. doi : 10.1073/pnas.86.24.9642 . PMC 298557 . PMID 2557623.
- ^ ab "Entrada de ENZIMA 2.7.1.105". enzima.expasy.org . Consultado el 24 de marzo de 2018 .
- ^ "6-fosfofructo-2-quinasa (IPR013079)". InterPro . EMBL-EBI . Consultado el 25 de marzo de 2018 .
- ^ ab "Entrada de ENZIMA 3.1.3.46". enzima.expasy.org . Consultado el 25 de marzo de 2018 .
- ^ Okar DA, Manzano A, Navarro-Sabatè A, Riera L, Bartrons R, Lange AJ (enero de 2001). "PFK-2/FBPase-2: creador y disyuntor del biofactor esencial fructosa-2,6-bisfosfato". Tendencias en Ciencias Bioquímicas . 26 (1): 30–5. doi :10.1016/S0968-0004(00)01699-6. PMID 11165514.
- ^ Van Schaftingen E, Hers HG (agosto de 1981). "Fosfofructoquinasa 2: la enzima que forma fructosa 2,6-bisfosfato a partir de fructosa 6-fosfato y ATP". Comunicaciones de investigación bioquímica y biofísica . 101 (3): 1078–84. doi :10.1016/0006-291X(81)91859-3. PMID 6458291.
- ^ ab Ros S, Schulze A (febrero de 2013). "Equilibrio del flujo glucolítico: el papel de las 6-fosfofructo-2-quinasas/fructosa 2,6-bisfosfatasas en el metabolismo del cáncer". Cancer & Metabolism . 1 (1): 8. doi : 10.1186/2049-3002-1-8 . PMC 4178209 . PMID 24280138.
- ^ ab Darville MI, Crepin KM, Hue L, Rousseau GG (septiembre de 1989). "Secuencia flanqueante 5' y estructura de un gen que codifica la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa de rata". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (17): 6543–7. Bibcode :1989PNAS...86.6543D. doi : 10.1073/pnas.86.17.6543 . PMC 297880 . PMID 2549541.
- ^ Tsuchiya Y, Uyeda K (mayo de 1994). "Arnm y estructura genética de la fructosa 6-P,2-quinasa:fructosa 2,6-bisfosfatasa de corazón bovino". Archivos de bioquímica y biofísica . 310 (2): 467–74. doi :10.1006/abbi.1994.1194. PMID 8179334.
- ^ Sakata J, Abe Y, Uyeda K (agosto de 1991). "Clonación molecular del ADN y expresión y caracterización de la fructosa-6-fosfato,2-quinasa:fructosa-2,6-bisfosfatasa de los testículos de rata". The Journal of Biological Chemistry . 266 (24): 15764–70. doi : 10.1016/S0021-9258(18)98475-9 . PMID 1651918.
- ^ abc Novellasdemunt L, Tato I, Navarro-Sabate A, Ruiz-Meana M, Méndez-Lucas A, Perales JC, García-Dorado D, Ventura F, Bartrons R, Rosa JL (abril de 2013). "Activación dependiente de Akt de la isoenzima 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa (PFKFB2) del corazón por aminoácidos". La Revista de Química Biológica . 288 (15): 10640–51. doi : 10.1074/jbc.M113.455998 . PMC 3624444 . PMID 23457334.
- ^ ab Gómez M, Manzano A, Navarro-Sabaté A, Duran J, Obach M, Perales JC, Bartrons R (enero de 2005). "Expresión específica del gen pfkfb4 en células germinales de espermatogonias y análisis de su región flanqueante 5'". Cartas FEBS . 579 (2): 357–62. Código Bib : 2005FEBSL.579..357G. doi :10.1016/j.febslet.2004.11.096. PMID 15642344. S2CID 33170865.
- ^ abc Salway JG (2017). Metabolismo de un vistazo . Wiley-Blackwell. ISBN 978-0-470-67471-0.
- ^ Hue L, Jinete MH, Rousseau GG (1990). "Fructosa-2,6-bifosfato en tejidos extrahepáticos". En Pilkis SJ (ed.). Fructosa-2,6-bifosfato . Boca Ratón, Florida: CRC Press. págs. 173-193. ISBN 978-0-8493-4795-5.
- ^ Pilkis SJ, el-Maghrabi MR, Claus TH (1988). "Regulación hormonal de la gluconeogénesis y la glucólisis hepáticas". Revisión anual de bioquímica . 57 : 755–83. doi :10.1146/annurev.bi.57.070188.003543. PMID 3052289.
- ^ Marker AJ, Colosia AD, Tauler A, Solomon DH, Cayre Y, Lange AJ, el-Maghrabi MR, Pilkis SJ (abril de 1989). "Regulación de glucocorticoides de la expresión del gen hepático 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa". La Revista de Química Biológica . 264 (12): 7000–4. doi : 10.1016/S0021-9258(18)83531-1 . PMID 2540168.
- ^ Cosin-Roger J, Vernia S, Alvarez MS, Cucarella C, Boscá L, Martin-Sanz P, Fernández-Alvarez AJ, Casado M (febrero de 2013). "Identificación de una nueva variante de ARNm de Pfkfb1 en hígado fetal de rata". Comunicaciones de investigación bioquímica y biofísica . 431 (1): 36–40. doi :10.1016/j.bbrc.2012.12.109. hdl : 11336/19538 . PMID 23291237.
- ^ Darville MI, Chikri M, Lebeau E, Hue L, Rousseau GG (agosto de 1991). "Un gen de rata que codifica la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa del corazón". FEBS Letters . 288 (1–2): 91–4. Bibcode :1991FEBSL.288...91D. doi : 10.1016/0014-5793(91)81009-W . PMID 1652483. S2CID 34116121.
- ^ Marsin AS, Bertrand L, Rider MH, Deprez J, Beauloye C, Vincent MF, Van den Berghe G, Carling D, Hue L (octubre de 2000). "La fosforilación y activación de la PFK-2 cardíaca por AMPK tiene un papel en la estimulación de la glucólisis durante la isquemia". Current Biology . 10 (20): 1247–55. Bibcode :2000CBio...10.1247M. doi : 10.1016/S0960-9822(00)00742-9 . PMID 11069105. S2CID 7920767.
- ^ Riera L, Manzano A, Navarro-Sabaté A, Perales JC, Bartrons R (abril de 2002). "La insulina induce la expresión del gen PFKFB3 en células de adenocarcinoma de colon humano HT29". Biochimica et Biophysica Acta (BBA) - Investigación de células moleculares . 1589 (2): 89–92. doi : 10.1016/S0167-4889(02)00169-6 . PMID 12007784.
- ^ Marsin AS, Bouzin C, Bertrand L, Hue L (agosto de 2002). "La estimulación de la glucólisis por hipoxia en monocitos activados está mediada por la proteína quinasa activada por AMP y la 6-fosfofructo-2-quinasa inducible". The Journal of Biological Chemistry . 277 (34): 30778–83. doi : 10.1074/jbc.M205213200 . PMID 12065600.
- ^ abc Sakakibara R, Kato M, Okamura N, Nakagawa T, Komada Y, Tominaga N, Shimojo M, Fukasawa M (julio de 1997). "Caracterización de una fructosa-6-fosfato, 2-quinasa / fructosa-2,6-bisfosfatasa placentaria humana". Revista de Bioquímica . 122 (1): 122–8. doi : 10.1093/oxfordjournals.jbchem.a021719. PMID 9276680.
- ^ Manes NP, El-Maghrabi MR (junio de 2005). "La actividad quinasa de la 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa del cerebro humano está regulada a través de la inhibición por fosfoenolpiruvato". Archivos de bioquímica y biofísica . 438 (2): 125–36. doi :10.1016/j.abb.2005.04.011. PMID 15896703.
- ^ Chesney J, Mitchell R, Benigni F, Bacher M, Spiegel L, Al-Abed Y, Han JH, Metz C, Bucala R (marzo de 1999). "Un producto génico inducible para la 6-fosfofructo-2-quinasa con un elemento de inestabilidad rico en AU: papel en la glicólisis de células tumorales y el efecto Warburg". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 96 (6): 3047–52. Bibcode :1999PNAS...96.3047C. doi : 10.1073/pnas.96.6.3047 . PMC 15892 . PMID 10077634.
- ^ ab Manzano A, Rosa JL, Ventura F, Pérez JX, Nadal M, Estivill X, Ambrosio S, Gil J, Bartrons R (1998). "Clonación molecular, expresión y localización cromosómica de un gen humano de 6-fosfofructo-2-quinasa / fructosa-2, 6-bisfosfatasa (PFKFB3)" . Citogenética y genética celular . 83 (3–4): 214–7. doi :10.1159/000015181. PMID 10072580. S2CID 23221556.
- ^ Sakai A, Kato M, Fukasawa M, Ishiguro M, Furuya E, Sakakibara R (marzo de 1996). "Clonación de ADNc que codifica una nueva isozima de fructosa 6-fosfato, 2-quinasa / fructosa 2,6-bisfosfatasa de placenta humana". Revista de Bioquímica . 119 (3): 506–11. doi : 10.1093/oxfordjournals.jbchem.a021270. PMID 8830046.
- ^ Ventura F, Ambrosio S, Bartrons R, el-Maghrabi MR, Lange AJ, Pilkis SJ (abril de 1995). "Clonación y expresión de un núcleo catalítico de cerebro bovino 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa". Comunicaciones de investigación bioquímica y biofísica . 209 (3): 1140–8. doi :10.1006/bbrc.1995.1616. PMID 7733968.
- ^ Bando H, Atsumi T, Nishio T, Niwa H, Mishima S, Shimizu C, Yoshioka N, Bucala R, Koike T (agosto de 2005). "Fosforilación de la familia de reguladores glicolíticos 6-fosfofructo-2-quinasa / fructosa 2,6-bisfosfatasa / PFKFB3 en el cáncer humano". Investigación clínica del cáncer . 11 (16): 5784–92. doi : 10.1158/1078-0432.CCR-05-0149 . PMID 16115917.
- ^ Riera L, Obach M, Navarro-Sabaté A, Duran J, Perales JC, Viñals F, Rosa JL, Ventura F, Bartrons R (agosto de 2003). "Regulación de la ubicua 6-fosfofructo-2-quinasa por la vía proteolítica ubiquitina-proteosoma durante la diferenciación de células miógenas C2C12". Cartas FEBS . 550 (1–3): 23–9. Código Bib : 2003FEBSL.550...23R. doi : 10.1016/S0014-5793(03)00808-1 . PMID 12935880. S2CID 41726316.
- ^ Ventura F, Rosa JL, Ambrosio S, Pilkis SJ, Bartrons R (septiembre de 1992). "6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa de cerebro bovino. Evidencia de una isozima neuronal específica". The Journal of Biological Chemistry . 267 (25): 17939–43. doi : 10.1016/S0021-9258(19)37133-9 . hdl : 2445/177133 . PMID 1325453.
- ^ Manzano A, Pérez JX, Nadal M, Estivill X, Lange A, Bartrons R (marzo de 1999). "Clonación, expresión y localización cromosómica de un gen de 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa de testículo humano". Gen. 229 (1–2): 83–9. doi :10.1016/S0378-1119(99)00037-2. PMID 10095107.
- ^ Ros S, Santos CR, Moco S, Baenke F, Kelly G, Howell M, Zamboni N, Schulze A (abril de 2012). "La evaluación metabólica funcional identifica a la 6-fosfofructo-2-quinasa/fructosa-2,6-bifosfatasa 4 como un importante regulador de la supervivencia de las células del cáncer de próstata". Cancer Discovery . 2 (4): 328–43. doi : 10.1158/2159-8290.CD-11-0234 . PMID 22576210.
- ^ ab Minchenko, O., Opentanova, I., y Caro, J. (2003). Regulación hipóxica de la expresión de la familia de genes 6-fosfofructo-2-quinasa/fructosa-2, 6-bisfosfatasa (PFKFB-1–4) in vivo. FEBS Letters , 554 (3), 264-270.
- ^ Wang Q, Donthi RV, Wang J, Lange AJ, Watson LJ, Jones SP, Epstein PN (junio de 2008). "La 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa deficiente en fosfatasa cardíaca aumenta la glucólisis, la hipertrofia y la resistencia de los miocitos a la hipoxia". American Journal of Physiology. Fisiología cardíaca y circulatoria . 294 (6): H2889–97. doi :10.1152/ajpheart.91501.2007. PMC 4239994. PMID 18456722 .
- ^ Minchenko OH, Opentanova IL, Ogura T, Minchenko DO, Komisarenko SV, Caro J, Esumi H (2005). "Expresión y capacidad de respuesta a la hipoxia de 6-fosfofructo-2-quinasa / fructosa-2,6-bisfosfatasa 4 en líneas celulares malignas de glándula mamaria". Acta Biochimica Polonica . 52 (4): 881–8. doi : 10.18388/abp.2005_3402 . PMID 16025159.
- ^ Stone WS, Faraone SV, Su J, Tarbox SI, Van Eerdewegh P, Tsuang MT (mayo de 2004). "Evidencia de vínculo entre enzimas reguladoras en la glucólisis y la esquizofrenia en una muestra multiplex". American Journal of Medical Genetics. Parte B, Genética neuropsiquiátrica . 127B (1): 5–10. doi : 10.1002/ajmg.b.20132 . PMID 15108172. S2CID 2420843.
- Van Schaftingen E, Hers HG (1981). "Fosfofructoquinasa 2: la enzima que forma fructosa 2,6-bisfosfato a partir de fructosa 6-fosfato y ATP". Biochem. Biophys. Res. Commun . 101 (3): 1078–84. doi :10.1016/0006-291X(81)91859-3. PMID 6458291.
Enlaces externos
- Fructosa+2,6-bisfosfatasa en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- 6-fosfofructoquinasa de Arabidopsis thaliana en genome.jp
Este artículo incorpora texto de dominio público Pfam e InterPro IPR013079

