Difracción de electrones en gases
La difracción de electrones en gases ( GED ) es una de las aplicaciones de las técnicas de difracción de electrones . [1] El objetivo de este método es la determinación de la estructura de las moléculas gaseosas, es decir, la disposición geométrica de los átomos a partir de los cuales se construye una molécula. La GED es uno de los dos métodos experimentales (además de la espectroscopia de microondas) para determinar la estructura de moléculas libres, no distorsionadas por fuerzas intermoleculares, que son omnipresentes en el estado sólido y líquido. La determinación de estructuras moleculares precisas [2] mediante estudios de GED es fundamental para comprender la química estructural . [3] [1]
Introducción
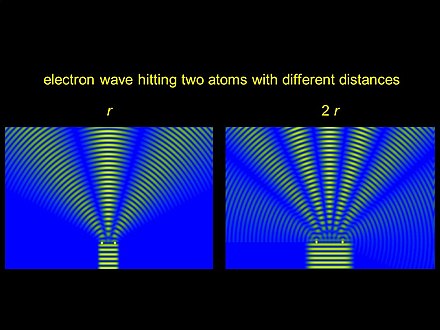
La difracción se produce porque la longitud de onda de los electrones acelerados por un potencial de unos pocos miles de voltios es del mismo orden de magnitud que las distancias internucleares en las moléculas. El principio es el mismo que el de otros métodos de difracción de electrones como LEED y RHEED , pero el patrón de difracción obtenible es considerablemente más débil que los de LEED y RHEED porque la densidad del objetivo es aproximadamente mil veces menor. Como la orientación de las moléculas objetivo en relación con los haces de electrones es aleatoria, la información de distancia internuclear obtenida es unidimensional. Por lo tanto, solo las moléculas relativamente simples pueden caracterizarse estructuralmente por completo mediante difracción de electrones en la fase gaseosa. Es posible combinar información obtenida de otras fuentes, como espectros rotacionales , espectroscopia de RMN o cálculos mecánico-cuánticos de alta calidad con datos de difracción de electrones, si estos últimos no son suficientes para determinar la estructura de la molécula por completo.
La intensidad total de dispersión en GED se da como una función de la transferencia de momento , que se define como la diferencia entre el vector de onda del haz de electrones incidente y el del haz de electrones disperso y tiene la dimensión recíproca de longitud . [4] La intensidad total de dispersión se compone de dos partes: la intensidad de dispersión atómica y la intensidad de dispersión molecular. La primera disminuye monótonamente y no contiene información sobre la estructura molecular. La última tiene modulaciones sinusoidales como resultado de la interferencia de las ondas esféricas de dispersión generadas por la dispersión de los átomos incluidos en la molécula objetivo. Las interferencias reflejan las distribuciones de los átomos que componen las moléculas, por lo que la estructura molecular se determina a partir de esta parte.

Experimento


La figura 1 muestra un dibujo y una fotografía de un aparato de difracción de electrones. El esquema 1 muestra el procedimiento esquemático de un experimento de difracción de electrones. Se genera un haz de electrones rápido en un cañón de electrones, que entra en una cámara de difracción normalmente a un vacío de 10 −7 mbar. El haz de electrones incide en una corriente perpendicular de una muestra gaseosa que emana de una boquilla de un diámetro pequeño (normalmente 0,2 mm). En este punto, los electrones se dispersan. La mayor parte de la muestra se condensa inmediatamente y se congela sobre la superficie de una trampa fría mantenida a -196 °C ( nitrógeno líquido ). Los electrones dispersos se detectan en la superficie de un detector adecuado a una distancia bien definida hasta el punto de dispersión.


El patrón de dispersión consiste en anillos concéntricos difusos (ver Figura 2). La pronunciada caída de intensidad se puede compensar haciendo pasar los electrones a través de un sector de rotación rápida (Figura 3). Esto se corta de tal manera que los electrones con ángulos de dispersión pequeños están más sombreados que aquellos con ángulos de dispersión más amplios. El detector puede ser una placa fotográfica , una placa de formación de imágenes de electrones (técnica habitual en la actualidad) u otros dispositivos sensibles a la posición, como detectores de píxeles híbridos (técnica futura).
Las intensidades generadas a partir de la lectura de las placas o del procesamiento de datos de intensidad de otros detectores se corrigen luego para el efecto sectorial. Inicialmente son una función de la distancia entre la posición del haz primario y la intensidad, y luego se convierten en una función del ángulo de dispersión. La denominada intensidad atómica y el fondo experimental se restan para obtener las intensidades experimentales finales de dispersión molecular en función de s (el cambio de momento ).
Estos datos se procesan luego mediante un software de ajuste adecuado como UNEX para refinar un modelo adecuado para el compuesto y obtener información estructural precisa en términos de longitudes de enlace, ángulos y ángulos de torsión.
Teoría
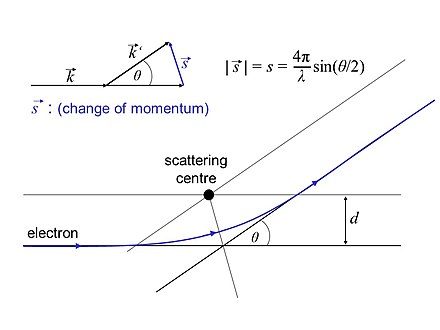
La GED se puede describir mediante la teoría de dispersión. El resultado, si se aplica a gases con moléculas orientadas aleatoriamente, se presenta a continuación de forma resumida: [5] [4]
La dispersión se produce en cada átomo individual ( ), pero también en pares (también llamado dispersión molecular) ( ), o triples ( ), de átomos.
es la variable de dispersión o cambio del momento del electrón , y su valor absoluto se define como
siendo la longitud de onda del electrón definida anteriormente y siendo el ángulo de dispersión.
Las contribuciones de dispersión mencionadas anteriormente se suman a la dispersión total.
donde es la intensidad de fondo experimental, que es necesaria para describir el experimento completamente.
La contribución de la dispersión de átomos individuales se denomina dispersión atómica y es fácil de calcular:
donde , es la distancia entre el punto de dispersión y el detector, es la intensidad del haz de electrones primario y es la amplitud de dispersión del átomo i -ésimo. En esencia, se trata de una suma de las contribuciones de dispersión de todos los átomos independientemente de la estructura molecular. es la contribución principal y se obtiene fácilmente si se conoce la composición atómica del gas (fórmula de suma).
La contribución más interesante es la dispersión molecular, porque contiene información sobre la distancia entre todos los pares de átomos de una molécula (enlazados o no enlazados):
siendo el parámetro de principal interés: la distancia atómica entre dos átomos, siendo la amplitud cuadrática media de la vibración entre los dos átomos, la constante de anarmonicidad (que corrige la descripción de la vibración por desviaciones de un modelo puramente armónico), y es un factor de fase, que se vuelve importante si está involucrado un par de átomos con carga nuclear muy diferente.
La primera parte es similar a la dispersión atómica, pero contiene dos factores de dispersión de los átomos involucrados. La suma se realiza sobre todos los pares de átomos.
es insignificante en la mayoría de los casos y no se describe aquí con más detalle. Se determina principalmente ajustando y restando funciones suaves para tener en cuenta la contribución de fondo.
Por lo tanto, lo que interesa es la intensidad de dispersión molecular, que se obtiene calculando todas las demás contribuciones y restándolas de la función de dispersión total medida experimentalmente.
Resultados
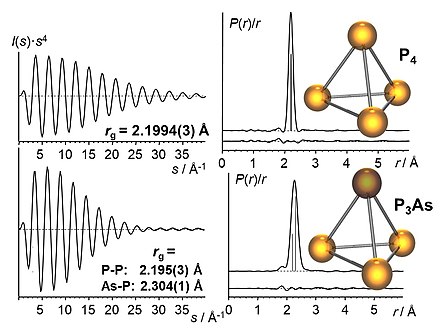
La figura 5 muestra dos ejemplos típicos de resultados. Las curvas de intensidad de dispersión molecular se utilizan para refinar un modelo estructural mediante un programa de ajuste de mínimos cuadrados . Esto produce información estructural precisa. La transformación de Fourier de las curvas de intensidad de dispersión molecular proporciona las curvas de distribución radial (RDC). Estas representan la probabilidad de encontrar una cierta distancia entre dos núcleos de una molécula. Las curvas debajo de la RDC representan la diferencia entre el experimento y el modelo, es decir, la calidad del ajuste.
El ejemplo muy simple de la Figura 5 muestra los resultados para el fósforo blanco evaporado , P 4 . Es una molécula perfectamente tetraédrica y, por lo tanto, tiene solo una distancia PP. Esto hace que la curva de intensidad de dispersión molecular sea muy simple; una curva sinusoidal que se amortigua debido a la vibración molecular. La curva de distribución radial (RDC) muestra un máximo en 2,1994 Å con un error de mínimos cuadrados de 0,0003 Å, representado como 2,1994(3) Å. El ancho del pico representa la vibración molecular y es el resultado de la transformación de Fourier de la parte de amortiguamiento. Este ancho de pico significa que la distancia PP varía por esta vibración dentro de un cierto rango dado como una amplitud vibracional u , en este ejemplo u T (P‒P) = 0,0560(5) Å.
La molécula P 3 As, un poco más complicada , tiene dos distancias diferentes, PP y P-As. Debido a que sus contribuciones se superponen en la RDC, el pico es más amplio (lo que también se observa en una amortiguación más rápida en la dispersión molecular). La determinación de estos dos parámetros independientes es más difícil y da como resultado valores de parámetros menos precisos que para P 4 .
A continuación se ofrecen algunos otros ejemplos seleccionados de contribuciones importantes a la química estructural de las moléculas:
- Estructura del diborano B 2 H 6 [6]
- Estructura de la trisililamina planar [7]
- Determinaciones de las estructuras del fósforo elemental gaseoso P 4 y del binario P 3 As [8]
- Determinación de la estructura de C 60 [9] y C 70 [10]
- Estructura del tetranitrometano [11]
- Ausencia de simetría local C 3 en el iluro de fosfonio más simple H 2 C=PMe 3 [12] y en aminofosfanos como P(NMe 2)3 e iluros H 2 C=P(NMe 2 ) 3 [13]
- Determinación de los efectos de la interacción de dispersión intramolecular de Londres sobre las estructuras en fase gaseosa y en estado sólido de dímeros diamantoides [14]
Campo de golf
- http://molwiki.org/wiki/Main_Page—Una [ enlace muerto permanente ] enciclopedia libre, centrada principalmente en la estructura y dinámica molecular.
- La historia de la difracción de electrones en fase gaseosa (GED) en Noruega [15]
Referencias
- ^ ab Rankin, David WH (2 de enero de 2013). Métodos estructurales en química inorgánica molecular . Morrison, Carole A., 1972-, Mitzel, Norbert W., 1966-. Chichester, West Sussex, Reino Unido. ISBN 978-1-118-46288-1.OCLC 810442747 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Estructuras moleculares precisas: su determinación e importancia . Domenicano, Aldo., Hargittai, István. [Chester, Inglaterra]: Unión Internacional de Cristalografía. 1992. ISBN 0-19-855556-3.OCLC 26264763 .
{{cite book}}: Mantenimiento de CS1: otros ( enlace ) - ^ Wells, AF (Alexander Frank), 1912- (12 de julio de 2012). Química inorgánica estructural (Quinta edición). Oxford. ISBN 978-0-19-965763-6.OCLC 801026482 .
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ ab Bonham, RA (1974). Dispersión de electrones de alta energía . Van Nostrand Reinhold.
- ^ Hargittai, I. (1988). Aplicaciones estereoquímicas de la difracción de electrones en fase gaseosa, parte A: la técnica de difracción de electrones . Weinheim: VCH Verlagsgesellschaft. ISBN 0-89573-337-4.
- ^ Hedberg, Kenneth; Schomaker, Verner (abril de 1951). "Una nueva investigación de las estructuras del diborano y el etano mediante difracción de electrones 1,2". Revista de la Sociedad Química Americana . 73 (4): 1482–1487. doi :10.1021/ja01148a022. ISSN 0002-7863.
- ^ Hedberg, Kenneth (1955-12-01). "La estructura molecular de la trisililamina (SiH3)3N1,2". Revista de la Sociedad Química Americana . 77 (24): 6491–6492. doi :10.1021/ja01629a015. ISSN 0002-7863.
- ^ Cossairt, Brandi M.; Cummins, Christopher C.; Head, Ashley R.; Lichtenberger, Dennis L.; Berger, Raphael JF; Hayes, Stuart A.; Mitzel, Norbert W.; Wu, Gang (23 de junio de 2010). "Sobre las estructuras moleculares y electrónicas de AsP3 y P4". Revista de la Sociedad Química Americana . 132 (24): 8459–8465. doi :10.1021/ja102580d. ISSN 0002-7863. PMID 20515032.
- ^ Hedberg, K.; Hedberg, L.; Bethune, DS; Brown, CA; Dorn, HC; Johnson, RD; De Vries, M. (18 de octubre de 1991). "Longitudes de enlace en moléculas libres de buckminsterfullereno, C60, a partir de difracción de electrones en fase gaseosa". Science . 254 (5030): 410–412. Bibcode :1991Sci...254..410H. doi :10.1126/science.254.5030.410. ISSN 0036-8075. PMID 17742230. S2CID 25860557.
- ^ Hedberg, Kenneth; Hedberg, Lise; Bühl, Michael; Bethune, Donald S.; Brown, CA; Johnson, Robert D. (1997-06-01). "Estructura molecular de moléculas libres del fulereno C70 a partir de difracción de electrones en fase gaseosa". Journal of the American Chemical Society . 119 (23): 5314–5320. doi :10.1021/ja970110e. ISSN 0002-7863.
- ^ Vishnevskiy, Yury V.; Tikhonov, Denis S.; Schwabedissen, Jan; Stammler, Hans-Georg; Moll, Richard; Krumm, Burkhard; Klapötke, Thomas M.; Mitzel, Norbert W. (1 de agosto de 2017). "Tetranitrometano: una pesadilla de flexibilidad molecular en los estados gaseoso y sólido". Angewandte Chemie International Edition . 56 (32): 9619–9623. doi :10.1002/anie.201704396. PMID 28557111.
- ^ Mitzel, Norbert W.; Brown, Daniel H.; Parsons, Simon; Brain, Paul T.; Pulham, Colin R.; Rankin, David WH (1998). "Diferencias entre las estructuras moleculares en fase gaseosa y en estado sólido del iluro de fosfonio más simple, Me3P=CH2". Angewandte Chemie International Edition . 37 (12): 1670–1672. doi :10.1002/(SICI)1521-3773(19980703)37:12<1670::AID-ANIE1670>3.0.CO;2-S. ISSN 1521-3773. PMID 29711513.
- ^ Mitzel, Norbert W.; Smart, Bruce A.; Dreihäupl, Karl-Heinz; Rankin, David WH; Schmidbaur, Hubert (enero de 1996). "Baja simetría en esqueletos P(NR 2 ) 3 y fragmentos relacionados: un fenómeno inherente". Revista de la Sociedad Química Americana . 118 (50): 12673–12682. doi :10.1021/ja9621861. ISSN 0002-7863.
- ^ Fokin, Andrey A.; Zhuk, Tatyana S.; Blomeyer, Sebastian; Pérez, Cristóbal; Chernish, Lesya V.; Pashenko, Alexander E.; Antony, Jens; Vishnevskiy, Yury V.; Berger, Raphael JF; Grimme, Stefan; Logemann, Christian (2017-11-22). "Efectos de la interacción de dispersión intramolecular de Londres en las estructuras en fase gaseosa y en estado sólido de los dímeros diamantoides". Journal of the American Chemical Society . 139 (46): 16696–16707. doi :10.1021/jacs.7b07884. ISSN 0002-7863. PMID 29037036.
- ^ Kveseth, Kari (agosto de 2019). "La historia de la difracción de electrones en fase gaseosa (GED) en Noruega". Química estructural . 30 (4): 1505–1516. doi :10.1007/s11224-019-01309-w. ISSN 1040-0400. S2CID 146084935.














![{\displaystyle I_{\text{m}}(s)={\frac {K^{2}}{R^{2}}}I_{0}\sum _{i=1}^{N}\sum _{j=1,i\neq j}^{N}|f_{i}(s)|\,|f_{j}(s)|{\frac {\sin[s(r_{ij}-\kappa s^{2})]}{sr_{ij}}}e^{-{\frac {1}{2}}l_{ij}s^{2}}\cos[\eta _{i}(s)-\eta _{i}(s)],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a131cb24e812d7b7f71bbb5a180e8f2d79acae0b)



