Cromatografía líquida-espectrometría de masas
 Sistema LCMS con trampa de iones y interfaz ESI | |
| Acrónimo | Sistema de medición de masas líquidas (LCMS) |
|---|---|
| Clasificación | Cromatografía Espectrometría de masas |
| Analitos | moléculas orgánicas biomoléculas |
| Fabricantes | Agilent Bruker PerkinElmer SCIEX Shimadzu Scientific Thermo Fisher Scientific Waters Corporation |
| Otras técnicas | |
| Relacionado | Cromatografía de gases-espectrometría de masas |
La cromatografía líquida-espectrometría de masas ( LC-MS ) es una técnica de química analítica que combina las capacidades de separación física de la cromatografía líquida (o HPLC ) con las capacidades de análisis de masas de la espectrometría de masas (MS). Los sistemas de cromatografía acoplada-MS son populares en el análisis químico porque las capacidades individuales de cada técnica se mejoran sinérgicamente. Mientras que la cromatografía líquida separa mezclas con múltiples componentes, la espectrometría de masas proporciona información espectral que puede ayudar a identificar (o confirmar la identidad sospechada de) cada componente separado. [1] La MS no solo es sensible, sino que proporciona una detección selectiva, aliviando la necesidad de una separación cromatográfica completa. [2] La LC-MS también es apropiada para la metabolómica debido a su buena cobertura de una amplia gama de productos químicos. [3] Esta técnica en tándem se puede utilizar para analizar compuestos bioquímicos, orgánicos e inorgánicos que se encuentran comúnmente en muestras complejas de origen ambiental y biológico. Por lo tanto, la LC-MS se puede aplicar en una amplia gama de sectores, incluidos la biotecnología , la monitorización ambiental, el procesamiento de alimentos y las industrias farmacéutica , agroquímica y cosmética . [4] [5] Desde principios de la década de 2000, la LC-MS (o más específicamente, LC- MS/MS ) también ha comenzado a usarse en aplicaciones clínicas. [6]
Además de los dispositivos de cromatografía líquida y espectrometría de masas, un sistema LC-MS contiene una interfaz que transfiere de manera eficiente los componentes separados de la columna LC a la fuente de iones MS. [5] [7] La interfaz es necesaria porque los dispositivos LC y MS son fundamentalmente incompatibles. Si bien la fase móvil en un sistema LC es un líquido presurizado, los analizadores MS comúnmente operan bajo alto vacío. Por lo tanto, no es posible bombear directamente el eluido de la columna LC a la fuente MS. En general, la interfaz es una parte mecánicamente simple del sistema LC-MS que transfiere la cantidad máxima de analito, elimina una porción significativa de la fase móvil utilizada en LC y preserva la identidad química de los productos cromatográficos (químicamente inertes). Como requisito, la interfaz no debe interferir con la eficiencia ionizante y las condiciones de vacío del sistema MS. [5] En la actualidad, las interfaces LC-MS más utilizadas se basan en estrategias de ionización a presión atmosférica (API), como la ionización por electrospray (ESI), la ionización química a presión atmosférica (APCI) y la fotoionización a presión atmosférica (APPI). Estas interfaces se pusieron a disposición en la década de 1990, después de un proceso de investigación y desarrollo de dos décadas. [8] [7]
Historia
El acoplamiento de la cromatografía con MS es una estrategia de análisis químico bien desarrollada que data de la década de 1950. La cromatografía de gases (GC)-MS se introdujo originalmente en 1952, cuando AT James y AJP Martin intentaban desarrollar técnicas de separación en tándem-análisis de masas. [9] En GC, los analitos se eluyen de la columna de separación como un gas y la conexión con fuentes de iones de ionización electrónica ( EI ) o ionización química ( CI ) en el sistema MS fue un desafío técnicamente más simple. Debido a esto, el desarrollo de sistemas GC-MS fue más rápido que LC-MS y dichos sistemas se comercializaron por primera vez en la década de 1970. [7] El desarrollo de sistemas LC-MS tomó más tiempo que GC-MS y estuvo directamente relacionado con el desarrollo de interfaces adecuadas. Victor Talrose y sus colaboradores en Rusia comenzaron el desarrollo de LC-MS a fines de la década de 1960, [10] [11] cuando utilizaron por primera vez capilares para conectar una columna LC a una fuente EI. [12] [8] McLafferty y sus colaboradores investigaron una estrategia similar en 1973, quienes acoplaron la columna LC a una fuente CI, [13] lo que permitió un mayor flujo de líquido hacia la fuente. Esta fue la primera y más obvia forma de acoplar LC con MS, y se la conoció como la interfaz de entrada capilar. Esta interfaz pionera para LC-MS tenía las mismas capacidades de análisis de GC-MS y estaba limitada a analitos bastante volátiles y compuestos no polares con baja masa molecular (por debajo de 400 Da). En la interfaz de entrada capilar, la evaporación de la fase móvil dentro del capilar era uno de los principales problemas. Durante los primeros años de desarrollo de LC-MS, se propusieron alternativas en línea y fuera de línea como alternativas de acoplamiento. En general, el acoplamiento fuera de línea implicaba la recolección de fracciones, la evaporación del solvente y la transferencia de analitos al MS usando sondas. El proceso de tratamiento de analitos fuera de línea consumía mucho tiempo y existía un riesgo inherente de contaminación de la muestra. Rápidamente, se comprendió que el análisis de mezclas complejas requeriría el desarrollo de una solución de acoplamiento en línea totalmente automatizada en LC-MS. [8]
La clave del éxito y la adopción generalizada de la cromatografía de líquidos y espectrometría de masas como herramienta analítica de rutina reside en la interfaz y la fuente de iones entre la cromatografía de líquidos y la espectrometría de masas basada en vacío. Las siguientes interfaces fueron puntos de apoyo en el camino hacia las interfaces de ionización a presión atmosférica modernas y se describen por su interés histórico.
Interfaz de banda móvil
La interfaz de banda móvil (MBI) fue desarrollada por McFadden et al. en 1977 y comercializada por Finnigan. [14] Esta interfaz consistía en una banda móvil sin fin sobre la que se depositaba el efluente de la columna LC en una banda. En la banda, el disolvente se evaporaba calentando suavemente y agotando eficientemente los vapores del disolvente a presión reducida en dos cámaras de vacío. Después de retirar la fase líquida, la banda pasaba sobre un calentador que desorbía instantáneamente los analitos en la fuente de iones MS. Una de las ventajas significativas de la MBI era su compatibilidad con una amplia gama de condiciones cromatográficas. [8] La MBI se utilizó con éxito para aplicaciones LC-MS entre 1978 y 1990 porque permitía el acoplamiento de dispositivos LC a MS utilizando fuentes de iones EI, CI y bombardeo de átomos rápidos (FAB). Los sistemas MS más comunes conectados por interfaces MBI a columnas LC eran instrumentos de sector magnético y cuadrupolo . Las interfaces MBI para LC-MS permitieron que la MS se aplicara ampliamente en el análisis de fármacos, pesticidas, esteroides, alcaloides e hidrocarburos aromáticos policíclicos . Esta interfaz ya no se utiliza debido a su complejidad mecánica y las dificultades asociadas con la renovación (o limpieza) de la banda, así como su incapacidad para manejar biomoléculas muy lábiles.
Interfaz de introducción directa de líquido
La interfaz de introducción directa de líquido (DLI) se desarrolló en 1980. Esta interfaz tenía como objetivo resolver el problema de la evaporación de líquido dentro de la interfaz de entrada del capilar. En la DLI, una pequeña porción del flujo de LC se forzaba a través de una pequeña abertura o diafragma (normalmente de 10 μm de diámetro) para formar un chorro de líquido compuesto de pequeñas gotas que posteriormente se secaban en una cámara de desolvatación. [11] Los analitos se ionizaban utilizando una fuente de ionización química asistida por disolvente, donde los disolventes de LC actuaban como gases reactivos. Para utilizar esta interfaz, era necesario dividir el flujo que salía de la columna de LC porque solo una pequeña porción del efluente (10 a 50 μl/min de 1 ml/min) podía introducirse en la fuente sin aumentar demasiado la presión de vacío del sistema MS. Alternativamente, Henion en la Universidad de Cornell tuvo éxito con el uso de métodos de LC de microdiámetro para que se pudiera utilizar todo el flujo (bajo) del LC. Uno de los principales problemas operativos de la interfaz DLI era la frecuente obstrucción de los orificios del diafragma. La interfaz DLI se utilizó entre 1982 y 1985 para el análisis de pesticidas, corticosteroides, metabolitos en orina de caballo, eritromicina y vitamina B 12 . Sin embargo, esta interfaz fue reemplazada por la interfaz de termopulverización , que eliminó las limitaciones de caudal y los problemas con la obstrucción de los diafragmas. [5] [8]
Un dispositivo relacionado fue la interfaz de haz de partículas (PBI), desarrollada por Willoughby y Browner en 1984. [15] Las interfaces de haz de partículas asumieron las amplias aplicaciones de MBI para LC-MS en 1988. [8] [16] La PBI funcionaba utilizando un nebulizador de gas helio para rociar el eluyente en el vacío, secando las gotitas y bombeando el vapor de disolvente (utilizando un separador de chorro) mientras la corriente de partículas secas monodispersas que contenían el analito entraba en la fuente. [11] El secado de las gotitas fuera del volumen de la fuente y el uso de un separador de chorro para bombear el vapor de disolvente permitían que las partículas entraran y se vaporizaran en una fuente de EI de baja presión. Al igual que con la MBI, la capacidad de generar espectros de EI que se pueden buscar en la biblioteca fue una clara ventaja para muchas aplicaciones. Comercializado por Hewlett Packard , y más tarde por VG y Extrel, disfrutó de un éxito moderado, pero fue reemplazado en gran medida por las interfaces de presión atmosférica como la electropulverización y la APCI, que proporcionan una gama más amplia de cobertura y aplicaciones de compuestos.
Interfaz de termopulverización
La interfaz de termopulverización (TSP) fue desarrollada en 1980 por Marvin Vestal y sus colaboradores en la Universidad de Houston. [17] Fue comercializada por Vestec y varios de los principales fabricantes de espectrómetros de masas. La interfaz fue el resultado de un proyecto de investigación a largo plazo destinado a encontrar una interfaz LC-MS capaz de manejar altas velocidades de flujo (1 ml/min) y evitar la división del flujo en las interfaces DLI. La interfaz TSP estaba compuesta por una sonda calentada, una cámara de desolvatación y un skimmer de enfoque de iones. El efluente de LC pasaba a través de la sonda calentada y emergía como un chorro de vapor y pequeñas gotas que fluían hacia la cámara de desolvatación a baja presión. Inicialmente operada con un filamento o descarga como fuente de iones (actuando así como una fuente de CI para el analito vaporizado), pronto se descubrió que también se observaban iones cuando el filamento o la descarga estaban apagados. Esto podría atribuirse a la emisión directa de iones de las gotitas de líquido a medida que se evaporaban en un proceso relacionado con la ionización por electrospray o la evaporación de iones, o a la ionización química de las moléculas de analito vaporizadas a partir de iones tampón (como acetato de amonio). El hecho de que se observaran iones con carga múltiple de algunos analitos más grandes sugiere que la emisión directa de iones de analito estaba ocurriendo al menos en algunas condiciones. [11] La interfaz pudo manejar hasta 2 ml/min de eluido de la columna LC y lo introduciría eficientemente en el sistema de vacío MS. TSP también fue más adecuado para aplicaciones LC-MS que involucran cromatografía líquida de fase inversa (RT-LC). Con el tiempo, la complejidad mecánica de TSP se simplificó y esta interfaz se hizo popular como la primera interfaz LC-MS ideal para aplicaciones farmacéuticas que comprenden el análisis de medicamentos , metabolitos, conjugados, nucleósidos , péptidos , productos naturales y pesticidas . La introducción de TSP marcó una mejora significativa para los sistemas LC-MS y fue la interfaz más ampliamente aplicada hasta principios de la década de 1990, cuando comenzó a ser reemplazada por interfaces que involucraban ionización por presión atmosférica (API). [5] [7] [16]
Interfaces basadas en FAB
Las primeras interfaces de bombardeo de átomos rápidos ( FAB ) y de flujo continuo-FAB (CF-FAB) se desarrollaron en 1985 y 1986 respectivamente. [16] Ambas interfaces eran similares, pero diferían en que la primera utilizaba una sonda de frita porosa como canal de conexión, mientras que CF-FAB utilizaba una punta de sonda. De estas, la CF-FAB tuvo más éxito como interfaz LC-MS y fue útil para analizar compuestos no volátiles y térmicamente lábiles. En estas interfaces, el efluente LC pasaba a través de los canales de frita o CF-FAB para formar una película líquida uniforme en la punta. Allí, el líquido era bombardeado con haces de iones o átomos de alta energía (átomos rápidos). Para un funcionamiento estable, las interfaces basadas en FAB podían manejar caudales de líquido de solo 1 a 15 μl y también estaban restringidas a columnas de microcalibre y capilares. Para poder utilizarlos en fuentes de ionización FAB MS, los analitos de interés debían mezclarse con una matriz (por ejemplo, glicerol) que podía añadirse antes o después de la separación en la columna LC. Las interfaces basadas en FAB se utilizaron ampliamente para caracterizar péptidos, pero perdieron su aplicabilidad con la llegada de las interfaces basadas en electrospray en 1988. [5] [8]
Cromatografía líquida
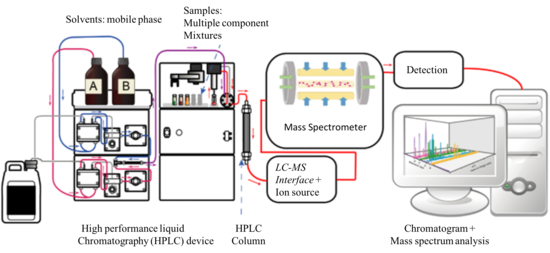
La cromatografía líquida es un método de separación física en el que los componentes de una mezcla líquida se distribuyen entre dos fases inmiscibles, es decir, estacionaria y móvil. La práctica de la LC se puede dividir en cinco categorías, es decir, cromatografía de adsorción , cromatografía de partición , cromatografía de intercambio iónico , cromatografía de exclusión por tamaño y cromatografía de afinidad . Entre estas, la variante más utilizada es el modo de fase inversa (RP) de la técnica de cromatografía de partición, que hace uso de una fase estacionaria no polar (hidrófoba) y una fase móvil polar. En aplicaciones comunes, la fase móvil es una mezcla de agua y otros disolventes polares (p. ej., metanol, isopropanol y acetonitrilo), y la matriz estacionaria se prepara uniendo grupos alquilo de cadena larga (p. ej., n-octadecilo o C 18 ) a las superficies externas e internas de partículas de sílice porosas de 5 μm de diámetro con forma irregular o esférica. [5]
En la HPLC, normalmente se inyectan 20 μl de la muestra de interés en la corriente de fase móvil suministrada por una bomba de alta presión. La fase móvil que contiene los analitos permea a través del lecho de la fase estacionaria en una dirección definida. Los componentes de la mezcla se separan dependiendo de su afinidad química con las fases móvil y estacionaria. La separación se produce después de repetidos pasos de sorción y desorción que ocurren cuando el líquido interactúa con el lecho estacionario. [8] El disolvente líquido (fase móvil) se suministra a alta presión (hasta 400 bar o 5800 psi) en una columna empaquetada que contiene la fase estacionaria. La alta presión es necesaria para lograr un caudal constante para experimentos de cromatografía reproducibles. Dependiendo de la partición entre las fases móvil y estacionaria, los componentes de la muestra fluirán fuera de la columna en diferentes momentos. [16] La columna es el componente más importante del sistema LC y está diseñada para soportar la alta presión del líquido. Las columnas de LC convencionales tienen una longitud de 100 a 300 mm con un diámetro exterior de 6,4 mm (1/4 de pulgada) y un diámetro interno de 3,0 a 4,6 mm. Para aplicaciones que involucran LC-MS, la longitud de las columnas de cromatografía puede ser más corta (30 a 50 mm) con partículas de relleno de 3 a 5 μm de diámetro. Además del modelo convencional, otras columnas de LC son los modelos de diámetro estrecho, microcapilar, microcapilar y nano-LC. Estas columnas tienen diámetros internos más pequeños, permiten una separación más eficiente y manejan flujos de líquido por debajo de 1 ml/min (el caudal convencional). [8] Para mejorar la eficiencia de separación y la resolución de pico, se puede utilizar cromatografía líquida de ultra rendimiento (UHPLC) en lugar de HPLC. Esta variante de LC utiliza columnas llenas de partículas de sílice más pequeñas (~1,7 μm de diámetro) y requiere presiones operativas más altas en el rango de 310 000 a 775 000 torr (6000 a 15 000 psi, 400 a 1034 bar). [5]
Espectrometría de masas

La espectrometría de masas (MS) es una técnica analítica que mide la relación masa-carga ( m/z) de partículas cargadas (iones). Aunque hay muchos tipos diferentes de espectrómetros de masas, todos ellos utilizan campos eléctricos o magnéticos para manipular el movimiento de iones producidos a partir de un analito de interés y determinar su m/z. [18] Los componentes básicos de un espectrómetro de masas son la fuente de iones , el analizador de masas , el detector y los sistemas de datos y vacío. La fuente de iones es donde los componentes de una muestra introducida en un sistema MS se ionizan por medio de haces de electrones , haces de fotones ( luces UV ), rayos láser o descarga de corona . En el caso de la ionización por electrospray, la fuente de iones mueve iones que existen en solución líquida a la fase gaseosa. La fuente de iones convierte y fragmenta las moléculas de muestra neutras en iones en fase gaseosa que se envían al analizador de masas. Mientras que el analizador de masas aplica los campos eléctricos y magnéticos para clasificar los iones según sus masas, el detector mide y amplifica la corriente de iones para calcular las abundancias de cada ion resuelto en masa. Para generar un espectro de masas que el ojo humano pueda reconocer fácilmente, el sistema de datos registra, procesa, almacena y muestra los datos en una computadora. [5]
El espectro de masas se puede utilizar para determinar la masa de los analitos, su composición elemental e isotópica, o para dilucidar la estructura química de la muestra. [5] La MS es un experimento que debe realizarse en fase gaseosa y al vacío (1,33 * 10 −2 a 1,33 * 10 −6 pascal). Por lo tanto, el desarrollo de dispositivos que faciliten la transición de muestras a mayor presión y en fase condensada (sólida o líquida) a un sistema de vacío ha sido esencial para desarrollar la MS como una herramienta potente para la identificación y cuantificación de compuestos orgánicos como los péptidos. [19] La MS es ahora de uso muy común en laboratorios analíticos que estudian las propiedades físicas, químicas o biológicas de una gran variedad de compuestos. Entre los muchos tipos diferentes de analizadores de masas, los que encuentran aplicación en los sistemas LC-MS son los analizadores cuadrupolo , de tiempo de vuelo (TOF) , de trampas de iones y los analizadores híbridos cuadrupolo-TOF (QTOF) . [7]
Interfaces
La interfaz entre una técnica de fase líquida (HPLC) con un eluato que fluye continuamente y una técnica de fase gaseosa realizada en vacío fue difícil durante mucho tiempo. La llegada de la ionización por electrospray cambió esto. Actualmente, las interfaces LC-MS más comunes son la ionización por electrospray (ESI), la ionización química a presión atmosférica (APCI) y la fotoionización a presión atmosférica (APPI). Estas son fuentes de iones MS más nuevas que facilitan la transición de un entorno de alta presión (HPLC) a las condiciones de alto vacío necesarias en el analizador MS. [20] [7] Aunque estas interfaces se describen individualmente, también pueden estar disponibles comercialmente como fuentes de iones duales ESI/APCI, ESI/APPI o APCI/APPI. [8] En el pasado se utilizaban varias técnicas de deposición y secado (por ejemplo, cintas móviles), pero la más común de ellas era la deposición MALDI fuera de línea . [21] [22] Un nuevo enfoque aún en desarrollo, llamado interfaz LC-MS de EI directa, combina un sistema nano HPLC y un espectrómetro de masas equipado con ionización electrónica. [23] [24]
Ionización por electrospray (ESI)
La interfaz ESI para sistemas LC-MS fue desarrollada por Fenn y colaboradores en 1988. [25] Esta fuente de iones/interfaz se puede utilizar para el análisis de moléculas moderadamente polares e incluso muy polares (por ejemplo, metabolitos, xenobióticos, péptidos, nucleótidos, polisacáridos). El eluato líquido que sale de la columna LC se dirige a un capilar de metal mantenido a 3 a 5 kV y se nebuliza mediante un flujo coaxial de gas de alta velocidad en la punta del capilar, creando una fina pulverización de gotas cargadas frente a la entrada de la cámara de vacío. Para evitar la contaminación del sistema de vacío por tampones y sales, este capilar suele estar ubicado perpendicularmente a la entrada del sistema MS, en algunos casos con una contracorriente de nitrógeno seco frente a la entrada a través de la cual los iones son dirigidos por el campo eléctrico. En algunas fuentes, la evaporación rápida de las gotas y, por lo tanto, la emisión máxima de iones se logra mezclando una corriente adicional de gas caliente con la columna de pulverización frente a la entrada de vacío. En otras fuentes, las gotitas pasan a través de un tubo capilar calentado a medida que entran al vacío, lo que promueve la evaporación de las gotitas y la emisión de iones. Estos métodos para aumentar la evaporación de las gotitas ahora permiten el uso de caudales de líquido de 1 a 2 ml/min y, al mismo tiempo, lograr una ionización eficiente [26] y una alta sensibilidad. Por lo tanto, si bien el uso de columnas de microcalibre de 1 a 3 mm y caudales más bajos de 50 a 200 μl/min se consideraba comúnmente necesario para un funcionamiento óptimo, esta limitación ya no es tan importante y ahora se puede emplear de manera ventajosa la mayor capacidad de columna de las columnas de mayor calibre con sistemas LC-MS ESI. Se pueden crear iones con carga positiva y negativa cambiando las polaridades, y es posible adquirir espectros alternativos de modo positivo y negativo rápidamente dentro de la misma ejecución de LC. Si bien la mayoría de las moléculas grandes (mayores de 1500–2000 MW) producen iones con carga múltiple en la fuente ESI, la mayoría de las moléculas más pequeñas producen iones con carga simple. [7]
Ionización química a presión atmosférica (APCI)
El desarrollo de la interfaz APCI para LC-MS comenzó con Horning y colaboradores a principios de 1973. [27] Sin embargo, su aplicación comercial se introdujo a principios de la década de 1990 después de que Henion y colaboradores mejoraran la interfaz LC-APCI-MS en 1986. [8] La fuente de iones/interfaz APCI se puede utilizar para analizar moléculas pequeñas, neutrales, relativamente no polares y térmicamente estables (por ejemplo, esteroides, lípidos y vitaminas liposolubles). Estos compuestos no se ionizan bien utilizando ESI. Además, APCI también puede manejar corrientes de fase móvil que contienen agentes tampón. El líquido del sistema LC se bombea a través de un capilar y también hay nebulización en la punta, donde se produce una descarga de corona. Primero, el gas ionizante que rodea la interfaz y el solvente de la fase móvil están sujetos a ionización química en la fuente de iones. Más tarde, estos iones reaccionan con el analito y transfieren su carga. Los iones de muestra pasan luego a través de pequeños orificios de separación por medio de lentes de enfoque de iones. Una vez dentro de la región de alto vacío, los iones se someten a análisis de masa. Esta interfaz puede funcionar en modos de carga positiva y negativa y se producen principalmente iones con carga simple. [7] La fuente de iones APCI también puede manejar caudales entre 500 y 2000 μl/min y se puede conectar directamente a columnas convencionales de 4,6 mm de diámetro interior. [16]
Fotoionización a presión atmosférica (APPI)
La interfaz APPI para LC-MS fue desarrollada simultáneamente por Bruins y Syage en 2000. [28] [8] APPI es otra fuente de iones/interfaz LC-MS para el análisis de compuestos neutros que no se pueden ionizar utilizando ESI. [7] Esta interfaz es similar a la fuente de iones APCI, pero en lugar de una descarga de corona, la ionización se produce mediante el uso de fotones que provienen de una lámpara de descarga. En el modo APPI directo, los iones moleculares de analito con una sola carga se forman por la absorción de un fotón y la expulsión de un electrón. En el modo APPI dopante, se agrega un compuesto fácilmente ionizable (Dopante) a la fase móvil o al gas nebulizador para promover una reacción de intercambio de carga entre el ion molecular dopante y el analito. La muestra ionizada se transfiere posteriormente al analizador de masas a alto vacío a medida que pasa a través de pequeños separadores de orificios. [8]
Aplicaciones
El acoplamiento de los sistemas MS con LC es atractivo porque la cromatografía líquida puede separar mezclas naturales delicadas y complejas, cuya composición química necesita estar bien establecida (por ejemplo, fluidos biológicos, muestras ambientales y medicamentos). Además, LC-MS tiene aplicaciones en el análisis de residuos explosivos volátiles. [29] Hoy en día, LC-MS se ha convertido en una de las técnicas de análisis químico más utilizadas porque más del 85% de los compuestos químicos naturales son polares y térmicamente lábiles y GC-MS no puede procesar estas muestras. [5] Como ejemplo, HPLC-MS se considera la técnica analítica líder para laboratorios proteómicos y farmacéuticos. [7] [5] Otras aplicaciones importantes de LC-MS incluyen el análisis de alimentos, pesticidas y fenoles vegetales . [8]
Farmacocinética
La LC-MS se utiliza ampliamente en el campo del bioanálisis y está especialmente involucrada en estudios farmacocinéticos de productos farmacéuticos. Los estudios farmacocinéticos son necesarios para determinar la rapidez con la que un fármaco se eliminará de los órganos corporales y del flujo sanguíneo hepático. Los analizadores MS son útiles en estos estudios debido a su menor tiempo de análisis y mayor sensibilidad y especificidad en comparación con los detectores UV comúnmente conectados a los sistemas HPLC. Una ventaja importante es el uso de MS-MS en tándem , donde el detector puede programarse para seleccionar ciertos iones para fragmentar. La cantidad medida es la suma de fragmentos de moléculas elegidos por el operador. Siempre que no haya interferencias o supresión de iones en LC-MS , la separación LC puede ser bastante rápida. [30]
Proteómica/metabolómica
La LC-MS se utiliza en proteómica como un método para detectar e identificar los componentes de una mezcla compleja. El enfoque de proteómica ascendente LC-MS generalmente implica la digestión y desnaturalización de proteasas utilizando tripsina como proteasa, urea para desnaturalizar la estructura terciaria y yodoacetamida para modificar los residuos de cisteína. Después de la digestión, la LC-MS se utiliza para la huella de masa de péptidos , o la LC-MS/MS ( MS en tándem ) se utiliza para derivar las secuencias de péptidos individuales. [31] La LC-MS/MS se utiliza más comúnmente para el análisis proteómico de muestras complejas donde las masas de péptidos pueden superponerse incluso con una espectrometría de masas de alta resolución. Las muestras de biología compleja (p. ej., suero humano) se pueden analizar en sistemas LC-MS/MS modernos, que pueden identificar más de 1000 proteínas. Sin embargo, este alto nivel de identificación de proteínas solo es posible después de separar la muestra por medio de gel SDS-PAGE o HPLC-SCX. [30] Recientemente, la LC-MS/MS se ha aplicado a la búsqueda de biomarcadores peptídicos. Algunos ejemplos son el reciente descubrimiento y validación de biomarcadores peptídicos para cuatro patógenos bacterianos importantes del tracto respiratorio ( Staphylococcus aureus , Moraxella catarrhalis , Haemophilus influenzae y Streptococcus pneumoniae ) y el virus SARS-CoV-2. [32] [33]
La LC-MS ha surgido como una de las técnicas más utilizadas en el perfil global de metabolitos del tejido biológico (por ejemplo, plasma sanguíneo, suero, orina). [34] La LC-MS también se utiliza para el análisis de productos naturales y el perfil de metabolitos secundarios en plantas. [35] En este sentido, los sistemas basados en MS son útiles para adquirir información más detallada sobre el amplio espectro de compuestos de muestras biológicas complejas. La LC-resonancia magnética nuclear ( RMN ) también se utiliza en la metabolómica de las plantas, pero esta técnica solo puede detectar y cuantificar los metabolitos más abundantes. La LC-MS ha sido útil para avanzar en el campo de la metabolómica de las plantas, que tiene como objetivo estudiar el sistema vegetal a nivel molecular proporcionando una caracterización no sesgada del metaboloma de la planta en respuesta a su entorno. [36] La primera aplicación de LC-MS en la metabolómica de plantas fue la detección de una amplia gama de metabolitos altamente polares, oligosacáridos , aminoácidos , aminoazúcares y nucleótidos de azúcar de los tejidos del floema de Cucurbita maxima . [37] Otro ejemplo de LC-MS en la metabolómica de plantas es la separación e identificación eficiente de glucosa , sacarosa , rafinosa , estaquiosa y verbascosa de extractos de hojas de Arabidopsis thaliana . [38]
Desarrollo de fármacos
La LC-MS se utiliza con frecuencia en el desarrollo de fármacos porque permite confirmar rápidamente el peso molecular y la identificación de la estructura. Estas características aceleran el proceso de generación, prueba y validación de un descubrimiento a partir de una amplia gama de productos con aplicación potencial. Las aplicaciones de LC-MS para el desarrollo de fármacos son métodos altamente automatizados que se utilizan para el mapeo de péptidos, el mapeo de glicoproteínas , la lipodómica, la desreplicación de productos naturales, el cribado de bioafinidad, el cribado de fármacos in vivo , el cribado de estabilidad metabólica, la identificación de metabolitos, la identificación de impurezas, el bioanálisis cuantitativo y el control de calidad. [39]
Véase también
- Cromatografía de gases-espectrometría de masas
- Electroforesis capilar-espectrometría de masas
- Espectrometría de movilidad iónica – espectrometría de masas
Referencias
- ^ de Hoffmann, Edmond; Stroobant, Vincent (2002). Espectrometría de masas (principios y aplicaciones) (2.ª ed.). Wiley. págs. 157-158. ISBN 0-471-48566-7.
- ^ Pitt, James J (febrero de 2009). "Principios y aplicaciones de la cromatografía líquida-espectrometría de masas en bioquímica clínica". Clin Biochem Rev . 30 (1): 19–34. PMC 2643089 . PMID 19224008.
- ^ Zhou, Bin; Xiao, Jun Feng; Tuli, Leepika; Ressom, Habtom W (febrero de 2012). "Metabolómica basada en LC-MS". Mol. Biosyst . 8 (2): 470–481. doi :10.1039/c1mb05350g. PMC 3699692. PMID 22041788 .
- ^ Chaimbault, Patrick (1 de enero de 2014). "El arte moderno de la identificación de sustancias naturales en plantas enteras". En Jacob, Claus; Kirsch, Gilbert; Slusarenko, Alan; Winyard, Paul G.; Burkholz, Torsten (eds.). Avances recientes en productos vegetales y microbianos con actividad redox . Springer Netherlands. págs. 31–94. doi :10.1007/978-94-017-8953-0_3. ISBN . 9789401789523.
- ^ abcdefghijkl Dass, Chhabil (1 de enero de 2007). "Técnicas de separación con guiones". Fundamentos de la espectrometría de masas contemporánea . John Wiley & Sons, Inc., págs. 151-194. doi :10.1002/9780470118498.ch5. ISBN 9780470118498.
- ^ Seger, Christoph; Salzmann, Linda (1 de agosto de 2020). "Después de otra década: la LC-MS/MS se convirtió en una rutina en el diagnóstico clínico". Bioquímica clínica . Avances y aplicaciones de la espectrometría de masas en medicina de laboratorio. 82 : 2–11. doi : 10.1016/j.clinbiochem.2020.03.004 . ISSN 0009-9120. PMID 32188572. S2CID 213186669.
- ^ abcdefghij Pitt, James J (12 de marzo de 2017). "Principios y aplicaciones de la cromatografía líquida-espectrometría de masas en bioquímica clínica". The Clinical Biochemist Reviews . 30 (1): 19–34. ISSN 0159-8090. PMC 2643089 . PMID 19224008.
- ^ abcdefghijklmn Niessen, Wilfried MA (2006). Cromatografía líquida: espectrometría de masas, tercera edición . Boca Ratón: CRC Taylor & Francis. págs. 50–90. ISBN 9780824740825.OCLC 232370223 .
- ^ James, AT; Martin, AJP (1952-03-01). "Cromatografía de partición gas-líquido: separación y microestimación de ácidos grasos volátiles desde ácido fórmico hasta ácido dodecanoico". Revista bioquímica . 50 (5): 679–690. doi :10.1042/bj0500679. ISSN 0264-6021. PMC 1197726 . PMID 14934673.
- ^ Tal'roze, V. L; Karpov, GV; Gordetskii, IG; Skurat, VE (1968). "Sistemas capilares para la introducción de mezclas líquidas en un espectrómetro de masas analítico". Russ. J. Phys. Chem . 42 : 1658–1664.
- ^ abcd Arpino, Patrick (2006). "Historia del desarrollo y la interconexión de LC-MS". Enciclopedia de espectrometría de masas . Vol. 8. Elsevier. ISBN 978-0080438474.
- ^ Tal'roze, VL; Gorodetskii, IG; Zolotoy, NB; Karpov, GV; Skurat, VE; Maslennikova, V.Ya. (1978). "Sistema capilar para la introducción continua de líquidos volátiles en espectrometría de masas analítica y su aplicación". Adv. Mass Spectrom . 7 : 858.
- ^ Baldwin, MA; McLafferty, FW (1973). "Interfaz I de cromatografía líquida-espectrometría de masas: La introducción directa de soluciones líquidas en un espectrómetro de masas de ionización química". Espectrometría de masas orgánica . 7 (9): 1111–1112. doi :10.1002/oms.1210070913. ISSN 0030-493X.
- ^ Pullen, Franl (2010). "La fascinante historia del desarrollo de la cromatografía líquida-espectrometría de masas; una perspectiva personal". Chromatography Today (febrero/marzo): 4-6.
- ^ de Koster, Chris G.; Schoenmakers, Peter J. (2020). "Capítulo 3.1 - Historia de la cromatografía líquida-espectrometría de masas". En Tranchida, Peter Q.; Mondello, Luigi (eds.). Combinaciones de cromatografía capilar con espectrometría de masas . Elsevier. págs. 279–295. ISBN 978-0-12-809638-3.
- ^ abcde Ardrey, Robert E. (1 de enero de 2003). "Introducción". Cromatografía líquida – Espectrometría de masas: una introducción . Técnicas analíticas en las ciencias (AnTS). John Wiley & Sons, Ltd., págs. 1–5. doi :10.1002/0470867299.ch1. ISBN 9780470867297.
- ^ Blakley, CR; Carmody, JJ; Vestal, ML (1980). "Una nueva técnica de ionización suave para espectrometría de masas de muestras complejas". J. Am. Chem. Soc . 102 : 5931–5933. doi :10.1021/ja00538a050.
- ^ Roberts, Gordon (2013). Roberts, Gordon C. K (ed.). Enciclopedia de biofísica - Springer . doi :10.1007/978-3-642-16712-6. ISBN 978-3-642-16711-9.S2CID44856071 .
- ^ Sharp, Thomas R. (1 de enero de 2009). "Espectrometría de masas". En Nassar, Ala F.; Collegiateessor, Paul F. Hollenberg; VP, JoAnn Scatina (eds.). Drug Metabolism Handbook . John Wiley & Sons, Inc. págs. 167–227. doi :10.1002/9780470439265.ch8. ISBN 9780470439265.
- ^ Arpino, Patrick (1992). "Cromatografía líquida combinada y espectrometría de masas. Parte III. Aplicaciones de la termopulverización". Reseñas de espectrometría de masas . 11 (1): 3–40. Bibcode :1992MSRv...11....3A. doi :10.1002/mas.1280110103.
- ^ Arpino, Patrick (1989). "Cromatografía líquida combinada y espectrometría de masas. Parte I. Acoplamiento mediante una interfaz de banda móvil". Mass Spectrometry Reviews . 8 (1): 35–55. Bibcode :1989MSRv....8...35A. doi :10.1002/mas.1280080103.
- ^ Murray, Kermit K. (1997). "Acoplamiento de la desorción/ionización láser asistida por matriz a las separaciones de líquidos". Mass Spectrometry Reviews . 16 (5): 283–299. Bibcode :1997MSRv...16..283M. doi :10.1002/(SICI)1098-2787(1997)16:5<283::AID-MAS3>3.0.CO;2-D.
- ^ Cappiello, Aquiles; Famiglini, Giorgio; Palma, Pierangela; Pierini, Elisabetta; Termopoli, Verónica; Trufelli, Helga (1 de diciembre de 2008). "Superación de los efectos de la matriz en cromatografía líquida-espectrometría de masas". Química Analítica . 80 (23): 9343–9348. doi :10.1021/ac8018312. ISSN 0003-2700. PMID 19551950.
- ^ Cappiello, Achille; Famiglini, Giorgio; Mangani, Filippo; Palma, Pierangela (1 de marzo de 2002). "Un enfoque simple para acoplar la cromatografía líquida y la espectrometría de masas por ionización electrónica". Revista de la Sociedad Americana de Espectrometría de Masas . 13 (3): 265–273. doi : 10.1016/S1044-0305(01)00363-4 . ISSN 1044-0305. PMID 11908806.
- ^ Fenn, JB; Mann, M.; Meng, CK; Wong, SF; Whitehouse, CM (6 de octubre de 1989). "Ionización por electrospray para espectrometría de masas de biomoléculas grandes". Science . 246 (4926): 64–71. Bibcode :1989Sci...246...64F. CiteSeerX 10.1.1.522.9458 . doi :10.1126/science.2675315. ISSN 0036-8075. PMID 2675315.
- ^ Covey, Tom (30 de agosto de 2022). "¿Adónde se han ido todos los iones después de tanto tiempo? Los espectrómetros de masas de cuadrupolo en tándem con sensibilidad a la ionización a presión atmosférica han aumentado desde mediados de los años 70. Una perspectiva". Comunicaciones rápidas en espectrometría de masas : e9354. doi : 10.1002/rcm.9354 . ISSN 0951-4198. PMID 35830299. S2CID 250491726.
- ^ Horning, EC; Horning, MG; Carroll, DI; Dzidic, I.; Stillwell, RN (1973-05-01). "Nuevo sistema de detección de picogramos basado en un espectrómetro de masas con una fuente de ionización externa a presión atmosférica". Química analítica . 45 (6): 936–943. doi :10.1021/ac60328a035. ISSN 0003-2700.
- ^ Robb, null; Covey, null; Bruins, null (1 de agosto de 2000). "Fotoionización a presión atmosférica: un método de ionización para cromatografía líquida-espectrometría de masas". Química analítica . 72 (15): 3653–3659. doi :10.1021/ac0001636. ISSN 1520-6882. PMID 10952556.
- ^ Widmer, Leo; Watson, Stuart; Schlatter, Konrad; Crowson, Andrew (2002). "Desarrollo de un método LC/MS para el análisis de trazas de triperóxido de triacetona (TATP)". The Analyst . 127 (12): 1627–1632. Bibcode :2002Ana...127.1627W. doi :10.1039/b208350g. ISSN 0003-2654. PMID 12537371.
- ^ ab Sudhakar, P.; Latha, P.; Reddy, PV (5 de abril de 2016). Fenotipado de plantas cultivadas para determinar características fisiológicas y bioquímicas. Academic Press. ISBN 9780128041109.
- ^ Wysocki VH, Resing KA, Zhang Q, Cheng G (2005). "Espectrometría de masas de péptidos y proteínas". Métodos . 35 (3): 211–22. doi :10.1016/j.ymeth.2004.08.013. PMID 15722218.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Karlsson, Roger; Thorsell, Annika; Gomila, Margarita; Salvà-Serra, Francisco; Jakobsson, Hedvig E.; Gonzales-Siles, Lucia; Jaén-Luchoro, Daniel; Skovbjerg, Susann; Fuchs, Johannes; Karlsson, Anders; Boulund, Fredrik (1 de marzo de 2020). "Descubrimiento de biomarcadores peptídicos únicos de especies de patógenos bacterianos mediante proteotipado basado en espectrometría de masas en tándem". Proteómica molecular y celular . 19 (3): 518–528. doi : 10.1074/mcp.RA119.001667 . ISSN 1535-9476. PMC 7050107 . PMID 31941798.
- ^ Van Puyvelde, B; Van Uytfanghe, K; Tytgat, O; Van Oudenhove, L; Gabriels, R; Bouwmeester, R; Daled, S; Van Den Bossche, T; Ramasamy, P; Verhelst, S; De Clerck, L; Corveleyn, L; Willems, S; Debunne, N; Wynendaele, E; De Spiegeleer, B; Judak, P; Roels, K; De Wilde, L; Van Eenoo, P; Reyes, T; Cherlet, M; Dumont, E; Debyser, G; t'Kindt, R; Sandra, K; Gupta, S; Drouin, N; Daños, A; Hankemeier, T; Jones, DJL; Gupta, P; Carril, D; Carril, CS; El Ouadi, S; Vicentet, JB; Morrice, N; Oehrle, S; Tanna, N; Silvester, S; Hannam, S; Sigloch, FC; Bhangu-Uhlmann, A; Claereboudt, J; Anderson, NL; Razavi, M; Degroeve, S; Cuypers, L; Stove, C; Lagrou, K; Martens, GA; Deforce, D; Martens, L; Vissers, JPC; Dhaenens, M (28 de junio de 2021). "Cov-MS: un ensayo de plantilla basado en la comunidad para la detección de proteínas basada en espectrometría de masas en el SARS" -Pacientes con COVID-2". JACS Au . 1 (6): 750–765. doi :10.1021/jacsau.1c00048. PMC 8230961 . PMID 34254058.
- ^ Gika, Helen G.; Theodoridis, Georgios A.; Plumb, Robert S.; Wilson, Ian D. (enero de 2014). "Práctica actual de cromatografía líquida-espectrometría de masas en metabolómica y metabonómica". Revista de análisis farmacéutico y biomédico . 87 : 12–25. doi :10.1016/j.jpba.2013.06.032. ISSN 0731-7085. PMID 23916607.
- ^ Stobiecki, M.; Skirycz, A.; Kerhoas, L.; Kachlicki, P.; Muth, D.; Einhorn, J.; Mueller-Roeber, B. (2006). "Perfil de conjugados glucosídicos fenólicos en hojas de Arabidopsis thaliana usando LC/MS". Metabolómica . 2 (4): 197–219. doi :10.1007/s11306-006-0031-5. S2CID 39140266.
- ^ Jorge, Tiago F.; Rodrigues, João A.; Caldana, Camila; Schmidt, Romy; van Dongen, Joost T.; Thomas-Oates, Jane ; António, Carla (1 de septiembre de 2016). "Metabolómica vegetal basada en espectrometría de masas: respuestas de los metabolitos al estrés abiótico". Reseñas de espectrometría de masas . 35 (5): 620–649. Código Bib : 2016MSRv...35..620J. doi :10.1002/mas.21449. ISSN 1098-2787. PMID 25589422. S2CID 206232111.
- ^ Tolstikov, Vladimir V.; Fiehn, Oliver (2002). "Análisis de compuestos altamente polares de origen vegetal: combinación de cromatografía de interacción hidrofílica y espectrometría de masas con trampa de iones por electrospray". Analytical Biochemistry . 301 (2): 298–307. doi :10.1006/abio.2001.5513. PMID 11814300. S2CID 3156968.
- ^ Antonio, Carla; Larson, Tony; Gilday, Alison; Graham, Ian; Bergström, Ed; Thomas-Oates, Jane (2008). "Análisis de metabolitos relacionados con carbohidratos del tejido foliar de Arabidopsis thaliana mediante cromatografía de interacción hidrófila/espectrometría de masas por electrospray". Rapid Communications in Mass Spectrometry . 22 (9): 1399–1407. Bibcode :2008RCMS...22.1399A. doi :10.1002/rcm.3519. PMID 18384194.
- ^ Lee, Mike S.; Kerns, Edward H. (1999). "Aplicaciones de LC/MS en el desarrollo de fármacos". Mass Spectrometry Reviews . 18 (3–4): 187–279. Bibcode :1999MSRv...18..187L. doi :10.1002/(SICI)1098-2787(1999)18:3/4<187::AID-MAS2>3.0.CO;2-K. PMID 10568041.
Lectura adicional
- Thurman, EM; Ferrer, Imma (2003). Cromatografía líquida/espectrometría de masas, MS/MS y MS de tiempo de vuelo: análisis de contaminantes emergentes . Columbus, OH: American Chemical Society. ISBN 978-0-8412-3825-1.
- Ferrer, Imma; Thurman, EM (2009). Cromatografía líquida-espectrometría de masas de tiempo de vuelo: principios, herramientas y aplicaciones para un análisis de masas preciso . Nueva York, NJ: Wiley. ISBN 978-0-470-13797-0.
- McMaster, Marvin C. (2005). LC/MS: una guía práctica para el usuario . Nueva York: John Wiley. ISBN 978-0-471-65531-2.
- Yergey, Alfred L. (1990). Cromatografía líquida/espectrometría de masas: técnicas y aplicaciones . Nueva York: Plenum Press. ISBN 978-0-306-43186-9.