Microscopía electrónica criogénica
Se ha sugerido que la criomicroscopía electrónica de transmisión se fusione en este artículo. ( Discutir ) Propuesto desde julio de 2024. |

La microscopía electrónica criogénica ( crio-EM ) es una técnica de criomicroscopía aplicada a muestras enfriadas a temperaturas criogénicas . En el caso de las muestras biológicas, la estructura se preserva mediante su inclusión en un entorno de hielo vítreo . Se aplica una solución acuosa de muestra a una malla de rejilla y se congela por inmersión en etano líquido o una mezcla de etano líquido y propano . [1] Si bien el desarrollo de la técnica comenzó en la década de 1970, los avances recientes en tecnología de detectores y algoritmos de software han permitido la determinación de estructuras biomoleculares con una resolución cercana a la atómica. [2] Esto ha atraído una amplia atención al enfoque como una alternativa a la cristalografía de rayos X o la espectroscopia de RMN para la determinación de la estructura macromolecular sin la necesidad de cristalización. [3]
En 2017, el Premio Nobel de Química fue otorgado a Jacques Dubochet , Joachim Frank y Richard Henderson "por desarrollar la criomicroscopía electrónica para la determinación de la estructura de alta resolución de biomoléculas en solución". [4] Nature Methods también nombró a la criomicroscopía electrónica como el "Método del año" en 2015. [5]
Historia
Desarrollo temprano
En la década de 1960, el uso de la microscopía electrónica de transmisión para los métodos de determinación de la estructura era limitado debido al daño por radiación causado por los haces de electrones de alta energía. Los científicos plantearon la hipótesis de que examinar las muestras a bajas temperaturas reduciría el daño por radiación inducido por el haz. [6] Tanto el helio líquido (−269 °C o 4 K o −452,2 °F ) como el nitrógeno líquido (−195,79 °C o 77 K o −320 °F) se consideraban criógenos. En 1980, Erwin Knapek y Jacques Dubochet publicaron comentarios sobre el daño por haz a temperaturas criogénicas y compartieron las siguientes observaciones:
Se descubrió que los cristales delgados montados sobre una película de carbono eran entre 30 y 300 veces más resistentes al haz a 4 K que a temperatura ambiente... La mayoría de nuestros resultados se pueden explicar asumiendo que la crioprotección en la región de 4 K depende en gran medida de la temperatura. [7]
Sin embargo, estos resultados no fueron reproducibles y se publicaron correcciones en Nature solo dos años después informando que la resistencia del haz era menos significativa de lo que se había previsto inicialmente. La protección obtenida a 4 K era más cercana a "diez veces para muestras estándar de L- valina ", [8] de lo que se había indicado anteriormente.
En 1981, Alasdair McDowall y Jacques Dubochet, científicos del Laboratorio Europeo de Biología Molecular , informaron sobre la primera implementación exitosa de crio-EM. [9] McDowall y Dubochet vitrificaron agua pura en una película delgada rociándola sobre una película de carbono hidrófilo que se sumergió rápidamente en criógeno ( propano líquido o etano líquido enfriado a 77 K). La capa delgada de hielo amorfo tenía menos de 1 μm de espesor y un patrón de difracción de electrones confirmó la presencia de hielo amorfo/vítreo. En 1984, el grupo de Dubochet demostró el poder de la crio-EM en biología estructural con el análisis del adenovirus tipo 2 vitrificado , el bacteriófago T4 , el virus del bosque Semliki , el bacteriófago CbK y el virus de la estomatitis vesicular . [10]
Avances recientes
La década de 2010 estuvo marcada por avances drásticos en las cámaras electrónicas. En particular, las mejoras realizadas en los detectores directos de electrones han llevado a una "revolución de la resolución" [11], que ha empujado la barrera de la resolución por debajo del límite crucial de ~2-3 Å para determinar la posición y la orientación de los aminoácidos. [12]
Henderson ( MRC Laboratory of Molecular Biology , Cambridge, Reino Unido) formó un consorcio con ingenieros del Rutherford Appleton Laboratory y científicos de la Max Planck Society para financiar y desarrollar un primer prototipo. Luego, el consorcio unió fuerzas con el fabricante de microscopios electrónicos FEI para lanzar y comercializar el nuevo diseño. Casi al mismo tiempo, Gatan Inc. de Pleasanton, California, presentó un detector similar diseñado por Peter Denes ( Lawrence Berkeley National Laboratory ) y David Agard ( University of California, San Francisco ). Nguyen-Huu Xuong desarrolló un tercer tipo de cámara en la empresa Direct Electron ( San Diego, California ). [11]
Más recientemente, los avances en el uso de estructuras de imágenes basadas en proteínas están ayudando a resolver los problemas de sesgo de orientación de la muestra y límite de tamaño. Las proteínas más pequeñas de ~50 kDa generalmente tienen una relación señal-ruido (SNR) demasiado baja para poder resolver partículas de proteína en la imagen, lo que hace que la reconstrucción 3D sea difícil o imposible. [13] La SNR de proteínas más pequeñas se puede mejorar uniéndolas a una estructura de imágenes. El grupo de Yeates en UCLA pudo crear una imagen más clara de tres variantes de KRAS (aproximadamente de 19 kDa de tamaño) utilizando una estructura de imágenes rígida y usando DARPins como dominios de unión modulares entre la estructura y la proteína de interés. [14]
Premio Nobel de Química 2017
En reconocimiento al impacto que la crio-EM ha tenido en la bioquímica, tres científicos, Jacques Dubochet , Joachim Frank y Richard Henderson , recibieron el Premio Nobel de Química "por desarrollar la microscopía crioelectrónica para la determinación de la estructura de alta resolución de biomoléculas en solución". [4]
Comparaciones con la cristalografía de rayos X
Tradicionalmente, la cristalografía de rayos X ha sido la técnica más popular para determinar las estructuras 3D de las moléculas biológicas. [15] Sin embargo, las mejoras mencionadas anteriormente en crio-EM han aumentado su popularidad como herramienta para examinar los detalles de las moléculas biológicas. Desde 2010, los depósitos anuales de estructuras crio-EM han superado a la cristalografía de rayos X. [16] Aunque la cristalografía de rayos X tiene drásticamente más depósitos totales debido a una historia de décadas más larga, se proyecta que los depósitos totales de los dos métodos eclipsarán alrededor de 2035. [16]
La resolución de la cristalografía de rayos X está limitada por la homogeneidad de los cristales [17], y lograr que moléculas biológicas con condiciones de cristalización ideales desconocidas alcancen un estado cristalino puede llevar mucho tiempo, y en casos extremos puede llevar meses o incluso años [18] . Por el contrario, la preparación de muestras en crio-EM puede requerir varias rondas de selección y optimización para superar problemas como la agregación de proteínas y las orientaciones preferidas [19] [20] , pero no requiere que la muestra forme un cristal, sino que las muestras para crio-EM se congelan instantáneamente y se examinan en sus estados casi nativos [21] .
Según Proteopedia , la resolución media alcanzada por cristalografía de rayos X (al 19 de mayo de 2019) en el Protein Data Bank es de 2,05 Å , [17] y la resolución más alta alcanzada registrada (al 30 de septiembre de 2022) es de 0,48 Å. [22] A partir de 2020, la mayoría de las estructuras de proteínas determinadas por crio-EM tienen una resolución más baja de 3-4 Å. [23] Sin embargo, a partir de 2020, la mejor resolución crio-EM se ha registrado en 1,22 Å, [20] lo que la convierte en un competidor en resolución en algunos casos.
Crio-TEM y crio-ET correlativos
En 2019, se utilizaron técnicas correlativas de crio-TEM y crio-ET para observar nanotubos de efecto túnel (TNT) en células neuronales. [24]
Criomicroscopía electrónica de barrido
La criomicroscopía electrónica de barrido (cryoSEM) es una técnica de microscopía electrónica de barrido que utiliza la platina fría de un microscopio electrónico de barrido en una cámara criogénica.
Microscopía electrónica de transmisión criogénica
La microscopía electrónica de transmisión criogénica (crio-TEM) es una técnica de microscopía electrónica de transmisión que se utiliza en biología estructural y ciencia de los materiales . Coloquialmente, el término "microscopía electrónica criogénica" o su abreviatura "crio-EM" se refiere a la microscopía electrónica de transmisión criogénica por defecto, ya que la gran mayoría de la crio-EM se realiza en microscopios electrónicos de transmisión, en lugar de microscopios electrónicos de barrido.
Centros
A finales de noviembre de 2021, el Instituto Federal de Tecnología , la Universidad de Lausana y la Universidad de Ginebra inauguraron el Centro Dubochet de Imagenología (DCI) con el fin de aplicar y seguir desarrollando la crio-EM. [25] Menos de un mes después de la primera identificación de la variante ómicron del SARS-CoV-2 , los investigadores del DCI pudieron definir su estructura, identificar las mutaciones cruciales para eludir las vacunas individuales y aportar información para nuevos enfoques terapéuticos. [26]
La Instalación Crio-EM Nacional Danesa, también conocida como EMBION, se inauguró el 1 de diciembre de 2016. EMBION es un consorcio de crio-EM entre universidades danesas (la Universidad de Aarhus es la anfitriona y la Universidad de Copenhague la coanfitriona).

Métodos avanzados
- Tomografía electrónica criogénica (crio-ET), una aplicación especializada en la que se toman muchas imágenes de muestras individuales en varios ángulos de inclinación, lo que da como resultado una reconstrucción 3D de una sola muestra. [27]
- Cristalografía electrónica , método para determinar la disposición de los átomos en sólidos utilizando un TEM
- MicroED , [28] método para determinar la estructura de proteínas , péptidos , moléculas orgánicas y compuestos inorgánicos utilizando difracción de electrones de cristales 3D [29] [30] [31]
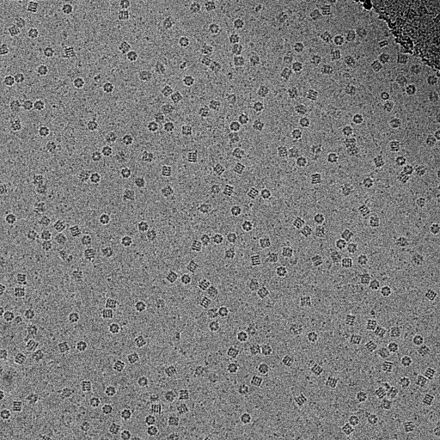
- Análisis de partículas individuales mediante crio-EM, un método de promediado para determinar la estructura de proteínas a partir de muestras monodispersas. [32]
- Estructura de la alcohol oxidasa de Pichia pastoris mediante crio-microscopía electrónica
- Imagen crio-EM de una célula ARMAN intacta de una biopelícula de Iron Mountain. El ancho de la imagen es de 576 nm.
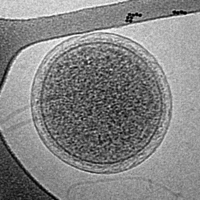
- Imagen crio-EM del virus marino gigante CroV
(la barra de escala representa 200 nm) [33]
Véase también
Referencias
- ^ Tivol WF, Briegel A, Jensen GJ (octubre de 2008). "Un criógeno mejorado para la congelación por inmersión". Microscopía y microanálisis . 14 (5): 375–379. Bibcode :2008MiMic..14..375T. doi :10.1017/S1431927608080781. PMC 3058946 . PMID 18793481.
- ^ Cheng Y, Grigorieff N, Penczek PA, Walz T (abril de 2015). "Una introducción a la criomicroscopía electrónica de partículas individuales". Cell . 161 (3): 438–449. doi :10.1016/j.cell.2015.03.050. PMC 4409659 . PMID 25910204.
- ^ Stoddart C (1 de marzo de 2022). "Biología estructural: cómo las proteínas consiguieron su primer plano". Revista Knowable . doi : 10.1146/knowable-022822-1 . S2CID : 247206999. Consultado el 25 de marzo de 2022 .
- ^ ab "El Premio Nobel de Química 2017". NobelPrize.org . Consultado el 30 de septiembre de 2022 .
- ^ Doerr A (enero de 2017). "Tomografía crioelectrónica". Nature Methods . 14 (1): 34. doi :10.1038/nmeth.4115. ISSN 1548-7091. S2CID 27162203.
- ^ Dubochet J, Knapek E (abril de 2018). "Altibajos en la criomicroscopía electrónica temprana". PLOS Biology . 16 (4): e2005550. doi : 10.1371/journal.pbio.2005550 . PMC 5929567 . PMID 29672565.
- ^ Knapek E, Dubochet J (agosto de 1980). "El daño causado por el haz a la materia orgánica se reduce considerablemente en la microscopía crioelectrónica". Journal of Molecular Biology . 141 (2): 147–161. doi :10.1016/0022-2836(80)90382-4. PMID 7441748.
- ^ Newmark P (30 de septiembre de 1982). "Microscopía de criotransmisión. Desvanecimiento de esperanzas". Nature . 299 (5882): 386–387. Bibcode :1982Natur.299..386N. doi : 10.1038/299386c0 .
- ^ Dubochet J, McDowall AW (diciembre de 1981). "Vitrificación de agua pura para microscopía electrónica". Journal of Microscopy . 124 (3): 3–4. doi : 10.1111/j.1365-2818.1981.tb02483.x .
- ^ Adrian M, Dubochet J, Lepault J, McDowall AW (marzo de 1984). "Microscopía crioelectrónica de virus". Nature . 308 (5954): 32–36. Bibcode :1984Natur.308...32A. doi :10.1038/308032a0. PMID 6322001. S2CID 4319199.
- ^ por Kühlbrandt, Werner (28 de marzo de 2014). "La revolución de la resolución". Science . 343 (6178): 1443–1444. Bibcode :2014Sci...343.1443K. doi :10.1126/science.1251652. ISSN 0036-8075. PMID 24675944. S2CID 35524447.
- ^ Kuster, Daniel J.; Liu, Chengyu; Fang, Zheng; Ponder, Jay W.; Marshall, Garland R. (20 de abril de 2015). "Estructuras cristalinas de alta resolución de hélices de proteínas reconciliadas con enlaces de hidrógeno de tres centros y electrostática multipolar". PLOS ONE . 10 (4): e0123146. Bibcode :2015PLoSO..1023146K. doi : 10.1371/journal.pone.0123146 . ISSN 1932-6203. PMC 4403875 . PMID 25894612.
- ^ Herzik, Mark A.; Wu, Mengyu; Lander, Gabriel C. (4 de marzo de 2019). "Determinación de la estructura en alta resolución de complejos sub-100 kDa utilizando crio-EM convencional". Nature Communications . 10 (1): 1032. Bibcode :2019NatCo..10.1032H. doi :10.1038/s41467-019-08991-8. ISSN 2041-1723. PMC 6399227 . PMID 30833564.
- ^ Castells-Graells R, Meador K, Arbing MA, Sawaya MR, Gee M, Cascio D, et al. (septiembre de 2023). "Determinación de la estructura mediante crioelectrometría de pequeñas proteínas terapéuticas con una resolución de 3 Å utilizando un andamio de imágenes rígido". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 120 (37): e2305494120. Bibcode :2023PNAS..12005494C. doi :10.1073/pnas.2305494120. PMC 10500258 . PMID 37669364.
- ^ Smyth MS, Martin JH (febrero de 2000). "Cristalografía de rayos X". Patología molecular . 53 (1): 8–14. doi :10.1136/mp.53.1.8. PMC 1186895 . PMID 10884915.
- ^ ab Chiu, Wah; Schmid, Michael F.; Pintilie, Grigore D.; Lawson, Catherine L. (enero de 2021). "Evolución de la estandarización y difusión de estructuras y datos crio-EM de forma conjunta por la comunidad, PDB y EMDB". Journal of Biological Chemistry . 296 : 100560. doi : 10.1016/j.jbc.2021.100560 . ISSN 0021-9258. PMC 8050867 . PMID 33744287.
- ^ ab "Resolución - Proteopedia, la vida en 3D". proteopedia.org . Consultado el 27 de octubre de 2020 .
- ^ Callaway E (febrero de 2020). "La crio-EM revolucionaria se está apoderando de la biología estructural". Nature . 578 (7794): 201. Bibcode :2020Natur.578..201C. doi : 10.1038/d41586-020-00341-9 . PMID 32047310.
- ^ Lyumkis, Dmitry (29 de marzo de 2019). "Desafíos y oportunidades en el análisis crio-EM de partículas individuales". Revista de química biológica . 294 (13): 5181–5197. doi : 10.1074/jbc.rev118.005602 . ISSN 0021-9258. PMC 6442032 . PMID 30804214.
- ^ ab Nakane T, Kotecha A, Sente A, McMullan G, Masiulis S, Brown PM, et al. (noviembre de 2020). "Crio-EM de partículas individuales con resolución atómica". Nature . 587 (7832): 152–156. Bibcode :2020Natur.587..152N. doi :10.1038/s41586-020-2829-0. PMC 7611073 . PMID 33087931.
- ^ Wang HW, Wang JW (enero de 2017). "Cómo se complementan entre sí la criomicroscopía electrónica y la cristalografía de rayos X". Protein Science . 26 (1): 32–39. doi :10.1002/pro.3022. PMC 5192981 . PMID 27543495.
- ^ Schmidt A, Teeter M, Weckert E, Lamzin VS (abril de 2011). "Estructura cristalina de la pequeña proteína crambina a una resolución de 0,48 Å". Acta Crystallographica. Sección F, Biología estructural y cristalización. Comunicaciones . 67 (parte 4): 424–428. doi :10.1107/S1744309110052607. PMC 3080141. PMID 21505232 .
- ^ Yip KM, Fischer N, Paknia E, Chari A, Stark H (noviembre de 2020). "Determinación de la estructura de proteínas con resolución atómica mediante crio-EM". Nature . 587 (7832): 157–161. Bibcode :2020Natur.587..157Y. doi :10.1038/s41586-020-2833-4. PMID 33087927. S2CID 224823207.
- ^ Sartori-Rupp A, Cordero Cervantes D, Pepe A, Gousset K, Delage E, Corroyer-Dulmont S, et al. (enero de 2019). "La criomicroscopía electrónica correlativa revela la estructura de los TNT en las células neuronales". Nature Communications . 10 (1): 342. Bibcode :2019NatCo..10..342S. doi :10.1038/s41467-018-08178-7. PMC 6341166 . PMID 30664666.
- ^ "Inauguración del Centro de Imagenología Dubochet (DCI) en los campus de la UNIGE, la UNIL y la EPFL". unige.ch . 2021-11-30 . Consultado el 2022-04-30 .
- ^ "Los científicos descubren los misterios de la variante ómicron con microscopios". swissinfo.ch . 2021-12-30 . Consultado el 2022-04-30 .
- ^ Bäuerlein, Felix JB; Baumeister, Wolfgang (1 de octubre de 2021). "Hacia la proteómica visual en alta resolución". Revista de biología molecular . De la secuencia de proteínas a la estructura a toda velocidad: cómo el plegamiento alfa afecta a la biología. 433 (20): 167187. doi : 10.1016/j.jmb.2021.167187 . ISSN 0022-2836. PMID 34384780.
- ^ Nannenga BL, Shi D, Leslie AG, Gonen T (septiembre de 2014). "Determinación de estructura de alta resolución mediante recopilación de datos de rotación continua en MicroED". Nature Methods . 11 (9): 927–930. doi :10.1038/nmeth.3043. PMC 4149488 . PMID 25086503.
- ^ Jones CG, Martynowycz MW, Hattne J, Fulton TJ, Stoltz BM, Rodriguez JA, et al. (noviembre de 2018). "El método CryoEM MicroED como una herramienta poderosa para la determinación de la estructura de moléculas pequeñas". ACS Central Science . 4 (11): 1587–1592. doi :10.1021/acscentsci.8b00760. PMC 6276044 . PMID 30555912.
- ^ de la Cruz MJ, Hattne J, Shi D, Seidler P, Rodriguez J, Reyes FE, et al. (febrero de 2017). "Estructuras de resolución atómica a partir de cristales de proteína fragmentados con el método cryoEM MicroED". Nature Methods . 14 (4): 399–402. doi :10.1038/nmeth.4178. PMC 5376236 . PMID 28192420.
- ^ Gruene T, Wennmacher JT, Zaubitzer C, Holstein JJ, Heidler J, Fecteau-Lefebvre A, et al. (diciembre de 2018). "Determinación rápida de la estructura de compuestos moleculares microcristalinos mediante difracción de electrones". Angewandte Chemie . 57 (50): 16313–16317. doi :10.1002/anie.201811318. PMC 6468266 . PMID 30325568.
- ^ Cheng Y (agosto de 2018). "Crio-EM de partículas individuales: ¿cómo llegó aquí y adónde irá?". Science . 361 (6405): 876–880. Bibcode :2018Sci...361..876C. doi :10.1126/science.aat4346. PMC 6460916 . PMID 30166484.
- ^ Xiao, C., Fischer, MG, Bolotaulo, DM, Ulloa-Rondeau, N., Avila, GA y Suttle, CA (2017) "La reconstrucción crio-EM de la cápside del virus Cafeteria roenbergensis sugiere una nueva vía de ensamblaje para virus gigantes". Scientific Reports , 7 : 5484. doi :10.1038/s41598-017-05824-w.

![Imagen crio-EM del virus marino gigante CroV (la barra de escala representa 200 nm)[33]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/CroV_TEM_(cropped).jpg/440px-CroV_TEM_(cropped).jpg)