ARN polimerasa II
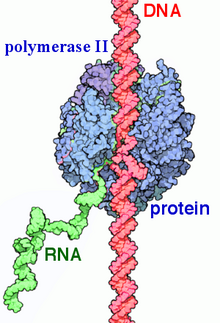
La ARN polimerasa II ( RNAP II y Pol II ) es un complejo multiproteico que transcribe el ADN en precursores del ARN mensajero (ARNm) y la mayoría de los ARN nucleares pequeños (snRNA) y microARN . [1] [2] Es una de las tres enzimas ARN polimerasa que se encuentran en el núcleo de las células eucariotas . [3] Un complejo de 550 kDa de 12 subunidades, la ARN polimerasa II es el tipo de ARN polimerasa más estudiado . Se requiere una amplia gama de factores de transcripción para que se una a los promotores de genes aguas arriba y comience la transcripción.
Descubrimiento

Los primeros estudios sugirieron un mínimo de dos ARN polimerasas: una que sintetizaba ARNr en el nucléolo y otra que sintetizaba otro ARN en el nucleoplasma , parte del núcleo pero fuera del nucléolo. [5] En 1969, los bioquímicos Robert G. Roeder y William Rutter descubrieron que hay un total de tres ARN polimerasas nucleares distintas , una ARN polimerasa adicional que era responsable de la transcripción de algún tipo de ARN en el nucleoplasma. [6] El hallazgo se obtuvo mediante el uso de cromatografía de intercambio iónico a través de perlas de Sephadex recubiertas con DEAE . La técnica separó las enzimas por el orden de las eluciones correspondientes, Ι,Ι,ΙΙΙ, aumentando la concentración de sulfato de amonio. Las enzimas se nombraron según el orden de las eluciones, ARN polimerasa I , ARN polimerasa II, ARN polimerasa IΙI . [3] Este descubrimiento demostró que había una enzima adicional presente en el nucleoplasma, que permitía la diferenciación entre la ARN polimerasa II y la ARN polimerasa III. [7]
La ARN polimerasa II (RNAP2) sufre una pausa transcripcional regulada durante la elongación temprana. Varios estudios han demostrado que la interrupción de la elongación de la transcripción está implicada en el cáncer , la neurodegeneración , la latencia del VIH, etc. [8]
Subunidades

La ARN polimerasa II del núcleo eucariota se purificó por primera vez mediante ensayos de transcripción. [10] La enzima purificada tiene típicamente entre 10 y 12 subunidades (12 en humanos y levaduras) y es incapaz de reconocer promotores específicos. [11] Se conocen muchas interacciones subunidad-subunidad. [12]
- Subunidad RPB1 de la ARN polimerasa II dirigida por ADN : una enzima que en los humanos está codificada por el gen POLR2A y en la levadura está codificada por RPO21. RPB1 es la subunidad más grande de la ARN polimerasa II. Contiene un dominio carboxiterminal (CTD) compuesto por hasta 52 repeticiones de heptapéptidos (YSPTSPS) que son esenciales para la actividad de la polimerasa. [13] El CTD fue descubierto por primera vez en el laboratorio de CJ Ingles en la Universidad de Toronto y por JL Corden en la Universidad Johns Hopkins . En combinación con varias otras subunidades de la polimerasa, la subunidad RPB1 forma el dominio de unión al ADN de la polimerasa, un surco en el que la plantilla de ADN se transcribe en ARN. [14] Interactúa fuertemente con RPB8. [12]
- RPB2 ( POLR2B ): la segunda subunidad más grande que, en combinación con al menos otras dos subunidades de la polimerasa, forma una estructura dentro de la polimerasa que mantiene el contacto en el sitio activo de la enzima entre la plantilla de ADN y el ARN recién sintetizado. [15]
- RPB3 ( POLR2C ): la tercera subunidad más grande. Existe como un heterodímero con otra subunidad de la polimerasa, POLR2J , formando un subconjunto central. RPB3 interactúa fuertemente con RPB1-5, 7, 10–12. [12]
- La subunidad B4 de la ARN polimerasa II (RPB4) , codificada por el gen POLR2D [16], es la cuarta subunidad más grande y puede tener una función protectora contra el estrés.
- RPB5 – En los seres humanos está codificado por el gen POLR2E . Dos moléculas de esta subunidad están presentes en cada ARN polimerasa II. [17] RPB5 interactúa fuertemente con RPB1, RPB3 y RPB6. [12]
- RPB6 ( POLR2F ) : forma una estructura con al menos otras dos subunidades que estabilizan la polimerasa transcriptora en la plantilla de ADN. [18]
- RPB7 : codificado por POLR2G y puede desempeñar un papel en la regulación de la función de la polimerasa. [19] RPB7 interactúa fuertemente con RPB1 y RPB5. [12]
- RPB8 ( POLR2H ) : interactúa con las subunidades RPB1-3, 5 y 7. [12]
- RPB9 – El surco en el que la plantilla de ADN se transcribe en ARN está compuesto por RPB9 ( POLR2I ) y RPB1.
- RPB10 – producto del gen POLR2L . Interactúa con RPB1-3 y 5, y fuertemente con RPB3. [12]
- RPB11 : la subunidad RPB11 está compuesta por tres subunidades en los humanos: POLR2J (RPB11-a), POLR2J2 (RPB11-b) y POLR2J3 [20] (RPB11-c).
- RPB12 – También interactúa con RPB3 RPB12 ( POLR2K ). [12]
Asamblea
RPB3 está involucrado en el ensamblaje de la ARN polimerasa II. [21] Un subcomplejo de RPB2 y RPB3 aparece poco después de la síntesis de subunidades. [21] Este complejo posteriormente interactúa con RPB1. [21] RPB3, RPB5 y RPB7 interactúan entre sí para formar homodímeros, y RPB3 y RPB5 juntos pueden contactar con todas las demás subunidades de RPB, excepto RPB9. [12] Solo RPB1 se une fuertemente a RPB5. [12] La subunidad RPB1 también contacta con RPB7, RPB10 y más débilmente pero de manera más eficiente con RPB8. [12] Una vez que RPB1 ingresa al complejo, otras subunidades como RPB5 y RPB7 pueden ingresar, donde RPB5 se une a RPB6 y RPB8 y RPB3 trae RPB10, RPB 11 y RPB12. [12] RPB4 y RPB9 pueden ingresar una vez que la mayor parte del complejo está ensamblado. RPB4 forma un complejo con RPB7. [12]
Cinética
Las enzimas pueden catalizar hasta varios millones de reacciones por segundo. Las velocidades enzimáticas dependen de las condiciones de la solución y la concentración del sustrato. Al igual que otras enzimas, POLR2 tiene una curva de saturación y una velocidad máxima ( V max ). Tiene una K m (concentración de sustrato requerida para la mitad de V max ) y una k cat (la cantidad de moléculas de sustrato manejadas por un sitio activo por segundo). La constante de especificidad está dada por k cat / K m . El máximo teórico para la constante de especificidad es el límite de difusión de aproximadamente 10 8 a 10 9 ( M −1 s −1 ), donde cada colisión de la enzima con su sustrato resulta en catálisis. En la levadura, la mutación en el dominio Trigger-Loop de la subunidad más grande puede cambiar la cinética de la enzima. [22]
La ARN polimerasa bacteriana, pariente de la ARN polimerasa II, cambia entre estados inactivados y activados mediante la translocación de un lado a otro a lo largo del ADN. [23] Las concentraciones de [NTP] eq = 10 μM GTP, 10 μM UTP, 5 μM ATP y 2,5 μM CTP, producen una tasa de elongación media, número de recambio, de ~1 pb (NTP) −1 para la ARN polimerasa bacteriana, pariente de la ARN polimerasa II. [23]

La ARN polimerasa II sufre una pausa cotranscripcional extensa durante la elongación de la transcripción. [24] [25] Esta pausa es especialmente pronunciada en los nucleosomas, y surge en parte a través de la polimerasa que entra en un estado de retroceso transcripcionalmente incompetente. [24] La duración de estas pausas varía de segundos a minutos o más, y la salida de pausas de larga duración puede ser promovida por factores de elongación como TFIIS. [26] A su vez, la tasa de transcripción influye en si las histonas de los nucleosomas transcritos son expulsadas de la cromatina o reinsertadas detrás de la polimerasa que transcribe. [27]
Alfa-amanitina
La ARN polimerasa II es inhibida por la α-amanitina [28] y otras amatoxinas . La α-amanitina es una sustancia altamente venenosa que se encuentra en muchos hongos. [5] El veneno del hongo tiene diferentes efectos en cada una de las ARN polimerasas: I, II, III. La ARN polimerasa I no responde en absoluto a la sustancia y funcionará normalmente, mientras que la ARN polimerasa III tiene una sensibilidad moderada. Sin embargo, la ARN polimerasa II es inhibida por completo por la toxina. La alfa-amanitina inhibe la ARN polimerasa II mediante fuertes interacciones en las regiones clave de la enzima, como el "embudo", la "hendidura" y la " hélice-α " de la subunidad RPB-1. [29]
Holoenzima
La holoenzima ARN polimerasa II es una forma de ARN polimerasa II eucariota que se recluta en los promotores de genes codificadores de proteínas en células vivas. [11] Consiste en la ARN polimerasa II, un subconjunto de factores de transcripción generales y proteínas reguladoras conocidas como proteínas SRB.
Una parte del ensamblaje de la holoenzima se denomina complejo de preiniciación , porque su ensamblaje tiene lugar en el promotor del gen antes del inicio de la transcripción . El complejo mediador actúa como un puente entre la ARN polimerasa II y los factores de transcripción.
Control por estructura de la cromatina
Este es un esquema de un ejemplo de mecanismo de células de levadura mediante el cual la estructura de la cromatina y la modificación postraduccional de las histonas ayudan a regular y registrar la transcripción de genes por la ARN polimerasa II.
Esta vía da ejemplos de regulación en estos puntos de la transcripción:
- Preiniciación (promoción por Bre1, modificación de histonas)
- Iniciación (promoción por TFIIH, modificación de Pol II y promoción por COMPASS, modificación de histonas)
- Elongación (promoción por Set2, modificación de histonas)
Se refiere a diversas etapas del proceso como pasos regulatorios. No se ha demostrado que se utilicen para la regulación, pero es muy probable que así sea.
Los promotores de elongación de ARN Pol II se pueden resumir en tres clases.
- Factores que afectan el arresto dependientes de fármacos o secuencias (diversas proteínas interferentes)
- Factores orientados a la estructura de la cromatina (modificadores postranscripcionales de histonas, por ejemplo, histonas metiltransferasas)
- Factores que mejoran la catálisis de la ARN Pol II (Varias proteínas interferentes y cofactores de la Pol II; véase ARN polimerasa II).
Mecanismos de transcripción
- Factores orientados a la estructura de la cromatina: (
HMTs ( Histona Metil Transferasas ) ):
COMPASS§† – ( Complejo de Proteínas Asociadas con Set1 ) – Metila la lisina 4 de la histona H3: Es responsable de la represión/silenciamiento de la transcripción. Una parte normal del crecimiento celular y la regulación de la transcripción dentro de la ARN polimerasa II. [30] - Set2 – Metila la lisina 36 de la histona H3: Set2 está involucrado en la regulación de la elongación de la transcripción a través de su contacto directo con el CTD. [31]
(ejemplo irrelevante interesante: Dot1*‡ – Metila la lisina 79 de la histona H3). - Bre1 – Ubiquina (añade ubiquitina a) la lisina 123 de la histona H2B. Está asociada con la preiniciación y permite la unión de la ARN polimerasa II.
Dominio C-terminal
El extremo C de RPB1 se añade para formar el dominio C-terminal (CTD). El dominio carboxiterminal de la ARN polimerasa II consta típicamente de hasta 52 repeticiones de la secuencia Tyr-Ser-Pro-Thr-Ser-Pro-Ser. [32] El dominio se extiende desde el núcleo de la enzima ARNPII hasta el canal de salida, esta ubicación es efectiva debido a sus inducciones de "reacciones de procesamiento de ARN, a través de interacciones directas o indirectas con componentes de la maquinaria de procesamiento de ARN". [33] El dominio CTD no existe en la ARN polimerasa I o la ARN polimerasa III. [3] El CTD de la ARN polimerasa se descubrió por primera vez en el laboratorio de CJ Ingles en la Universidad de Toronto y también en el laboratorio de J Corden en la Universidad Johns Hopkins durante los procesos de secuenciación del ADN que codifica la subunidad RPB1 de la ARN polimerasa de levadura y ratones respectivamente. Otras proteínas a menudo se unen al dominio C-terminal de la ARN polimerasa para activar la actividad de la polimerasa. Es el dominio proteico que está involucrado en el inicio de la transcripción, la protección de la transcripción de ARN y la unión al espliceosoma para el empalme del ARN . [13]
Fosforilación del CTD
La ARN polimerasa II existe en dos formas no fosforilada y fosforilada, IIA y IIO respectivamente. [5] [3] La transición entre las dos formas facilita diferentes funciones para la transcripción. La fosforilación de CTD es catalizada por uno de los seis factores de transcripción generales , TFIIH . TFIIH tiene dos propósitos: uno es desenrollar el ADN en el sitio de inicio de la transcripción y el otro es fosforilarlo. La forma polimerasa IIA se une al complejo de preiniciación, esto se sugiere porque IIA se une con mayor afinidad a la TBP ( proteína de unión a caja TATA ), la subunidad del factor de transcripción general TFIID , que la forma polimerasa IIO. La forma polimerasa IIO facilita la elongación de la cadena de ARN. [5] El método para la iniciación de la elongación se realiza mediante la fosforilación de la serina en la posición 5 (Ser5), a través de TFIIH. La Ser5 recién fosforilada recluta enzimas para tapar el extremo 5' del ARN recién sintetizado y los "factores de procesamiento 3' a los sitios poli(A) ". [33] Una vez que se fosforila la segunda serina, Ser2, se activa la elongación. Para terminar la elongación debe ocurrir una desfosforilación. Una vez que el dominio está completamente desfosforilado, la enzima ARN polimerasa II se "recicla" y cataliza el mismo proceso con otro sitio de iniciación. [33]
Reparación recombinacional acoplada a transcripción
El daño oxidativo del ADN puede bloquear la transcripción de la ARN polimerasa II y causar roturas de hebras. Se ha descrito un proceso de recombinación asociada a la transcripción con plantilla de ARN que puede proteger contra el daño del ADN. [34] Durante las etapas G1/G0 del ciclo celular , las células exhiben ensamblaje de factores de recombinación homóloga en roturas de doble hebra dentro de regiones transcritas activamente. Parece que la transcripción está acoplada a la reparación de roturas de doble hebra del ADN por recombinación homóloga con plantilla de ARN. Este proceso de reparación vuelve a unir de manera eficiente y precisa las roturas de doble hebra en genes que están siendo transcritos activamente por la ARN polimerasa II.
Véase también
- Transcripción eucariota
- Modificación postranscripcional
- ARN polimerasa I
- Holoenzima ARN polimerasa II
- ARN polimerasa III
- Transcripción (genética)
Referencias
- ^ Kornberg RD (diciembre de 1999). "Control transcripcional eucariota". Tendencias en biología celular . 9 (12): M46–9. doi : 10.1016/S0962-8924(99)01679-7 . PMID 10611681.
- ^ Sims RJ, Mandal SS, Reinberg D (junio de 2004). "Aspectos destacados recientes de la transcripción mediada por la ARN polimerasa II". Current Opinion in Cell Biology . 16 (3): 263–71. doi : 10.1016/j.ceb.2004.04.004 . PMID 15145350.
- ^ abcd Young, Richard A. (28 de noviembre de 2003). "ARN polimerasa II". Revista anual de bioquímica . 60 (1): 689–715. doi :10.1146/annurev.bi.60.070191.003353. PMID 1883205.
- ^ Meyer PA, Ye P, Zhang M, Suh MH, Fu J (junio de 2006). "Phasing RNA polymerase II using intrínsically bound Zn atoms: an updated structure model" (Phasing de la ARN polimerasa II utilizando átomos de Zn intrínsecamente unidos: un modelo estructural actualizado). Structure . 14 (6): 973–82. doi : 10.1016/j.str.2006.04.003 . PMID 16765890.
- ^ abcd Weaver, Robert Franklin (1 de enero de 2012). Biología molecular . McGraw-Hill. ISBN 9780073525327.OCLC 789601172 .
- ^ Roeder RG, Rutter WJ (octubre de 1969). "Múltiples formas de la ARN polimerasa dependiente de ADN en organismos eucariotas". Nature . 224 (5216): 234–7. Bibcode :1969Natur.224..234R. doi :10.1038/224234a0. PMID 5344598. S2CID 4283528.
- ^ Roeder RG, Rutter WJ (octubre de 1969). "Múltiples formas de la ARN polimerasa dependiente de ADN en organismos eucariotas". Nature . 224 (5216): 234–7. Bibcode :1969Natur.224..234R. doi :10.1038/224234a0. PMID 5344598. S2CID 4283528.
- ^ Cermakova, Katerina; Demeulemeester, Jonas; Lux, Vanda; Nedomova, Monika; Goldman, Seth R.; Smith, Eric A.; Srb, Pavel; Hexnerova, Rozalie; Fabry, Milan; Madlikova, Marcela; Horejsi, Magdalena (26 de noviembre de 2021). "Un módulo de interacción de proteínas desordenado y ubicuo orquesta la elongación de la transcripción". Science . 374 (6571): 1113–1121. Bibcode :2021Sci...374.1113C. doi :10.1126/science.abe2913. PMC 8943916 . PMID 34822292. S2CID 244660781.
- ^ Armache, Karim-Jean; Mitterweger, Simone; Meinhart, Anton; Cramer, Patrick (2019). "Estructuras de la ARN polimerasa II completa y su subcomplejo, Rpb4/7" (PDF) . Revista de química biológica . 280 (8): 7131–1734. doi :10.2210/pdb1wcm/pdb. PMID 15591044.
- ^ Sawadogo M, Sentenac A (1990). "ARN polimerasa B (II) y factores de transcripción generales". Revisión anual de bioquímica . 59 : 711–54. doi :10.1146/annurev.bi.59.070190.003431. PMID 2197989.
- ^ ab Myer VE, Young RA (octubre de 1998). "Holoenzimas y subcomplejos de la ARN polimerasa II". The Journal of Biological Chemistry . 273 (43): 27757–60. doi : 10.1074/jbc.273.43.27757 . PMID 9774381.
- ^ abcdefghijklm Acker J, de Graaff M, Cheynel I, Khazak V, Kedinger C, Vigneron M (julio de 1997). "Interacciones entre las subunidades de la ARN polimerasa II humana". The Journal of Biological Chemistry . 272 (27): 16815–21. doi : 10.1074/jbc.272.27.16815 . PMID 9201987.
- ^ ab Brickey WJ, Greenleaf AL (junio de 1995). "Estudios funcionales del dominio de repetición carboxiterminal de la ARN polimerasa II de Drosophila in vivo". Genética . 140 (2): 599–613. doi :10.1093/genetics/140.2.599. PMC 1206638 . PMID 7498740.
- ^ "Entrez Gene: polipéptido A de la polimerasa (ARN) II (dirigido por ADN) POLR2A, 220 kDa".
- ^ "Gen Entrez: polipéptido B de la polimerasa (ARN) II (dirigido por ADN) POLR2B, 140 kDa".
- ^ Khazak V, Estojak J, Cho H, Majors J, Sonoda G, Testa JR, Golemis EA (abril de 1998). "Análisis de la interacción de la nueva subunidad hsRPB4 de la ARN polimerasa II (pol II) con su pareja hsRPB7 y con pol II". Biología molecular y celular . 18 (4): 1935–45. doi :10.1128/mcb.18.4.1935. PMC 121423 . PMID 9528765.
- ^ "Gen Entrez: polipéptido E de la polimerasa (ARN) II (dirigido por ADN) POLR2E, 25 kDa".
- ^ "Entrez Gene: polipéptido F de la polimerasa (ARN) II (dirigida por ADN) POLR2F".
- ^ "Entrez Gene: polipéptido G de la polimerasa (ARN) II (dirigida por ADN) POLR2G".
- ^ "POLR2J3 polimerasa (ARN) II (dirigida por ADN) polipéptido J3".
- ^ abc Kolodziej PA, Young RA (septiembre de 1991). "Mutaciones en las tres subunidades más grandes de la ARN polimerasa II de levadura que afectan el ensamblaje de la enzima". Biología molecular y celular . 11 (9): 4669–78. doi :10.1128/mcb.11.9.4669. PMC 361357 . PMID 1715023.
- ^ Kaplan CD, Jin H, Zhang IL, Belyanin A (12 de abril de 2012). "Disección de la función del bucle de activación de Pol II y control dependiente de la actividad de Pol II de la selección del sitio de inicio in vivo". PLOS Genetics . 8 (4): e1002627. doi : 10.1371/journal.pgen.1002627 . PMC 3325174 . PMID 22511879.
- ^ ab Abbondanzieri EA, Greenleaf WJ, Shaevitz JW, Landick R, Block SM (noviembre de 2005). "Observación directa de la escalonamiento de pares de bases por la ARN polimerasa". Nature . 438 (7067): 460–5. Bibcode :2005Natur.438..460A. doi :10.1038/nature04268. PMC 1356566 . PMID 16284617.
- ^ ab Hodges, Courtney; Bintu, Lacramioara; Lubkowska, Lucyna; Kashlev, Mikhail; Bustamante, Carlos (31 de julio de 2009). "Las fluctuaciones nucleosomales gobiernan la dinámica de la transcripción de la ARN polimerasa II". Science . 325 (5940): 626–628. Bibcode :2009Sci...325..626H. doi :10.1126/science.1172926. ISSN 1095-9203. PMC 2775800 . PMID 19644123.
- ^ Churchman, L. Stirling; Weissman, Jonathan S. (20 de enero de 2011). "La secuenciación de transcripción naciente visualiza la transcripción con resolución de nucleótidos". Nature . 469 (7330): 368–373. Bibcode :2011Natur.469..368C. doi :10.1038/nature09652. ISSN 1476-4687. PMC 3880149 . PMID 21248844.
- ^ Galburt, Eric A.; Grill, Stephan W.; Wiedmann, Anna; Lubkowska, Lucyna; Choy, Jason; Nogales, Eva; Kashlev, Mikhail; Bustamante, Carlos (12 de abril de 2007). "El retroceso determina la sensibilidad a la fuerza de la ARN polimerasa II de una manera dependiente del factor". Nature . 446 (7137): 820–823. Bibcode :2007Natur.446..820G. doi :10.1038/nature05701. ISSN 1476-4687. PMID 17361130. S2CID 4310108.
- ^ Bintu, Lacramioara; Kopaczynska, Marta; Hodges, Courtney; Lubkowska, Lucyna; Kashlev, Mikhail; Bustamante, Carlos (13 de noviembre de 2011). "La tasa de elongación de la ARN polimerasa determina el destino de los nucleosomas transcritos". Nature Structural & Molecular Biology . 18 (12): 1394–1399. doi :10.1038/nsmb.2164. ISSN 1545-9985. PMC 3279329 . PMID 22081017.
- ^ Kaplan CD, Larsson KM, Kornberg RD (junio de 2008). "El bucle de activación de la ARN polimerasa II funciona en la selección de sustrato y es el objetivo directo de la alfa-amanitina". Molecular Cell . 30 (5): 547–56. doi :10.1016/j.molcel.2008.04.023. PMC 2475549 . PMID 18538653.
- ^ Gong, Xue Q.; Nedialkov, Yuri A.; Burton, Zachary F. (25 de junio de 2004). "α-Amanitin bloquea la translocación por la ARN polimerasa II humana". Journal of Biological Chemistry . 279 (26): 27422–27427. doi : 10.1074/jbc.M402163200 . ISSN 0021-9258. PMID 15096519.
- ^ Briggs, Scott D.; Bryk, Mary; Strahl, Brian D.; Cheung, Wang L.; Davie, Judith K.; Dent, Sharon YR; Winston, Fred; Allis, C. David (15 de diciembre de 2001). "La metilación de la lisina 4 de la histona H3 está mediada por Set1 y es necesaria para el crecimiento celular y el silenciamiento del ADNr en Saccharomyces cerevisiae". Genes & Development . 15 (24): 3286–3295. doi :10.1101/gad.940201. ISSN 0890-9369. PMC 312847 . PMID 11751634.
- ^ Li, Bing; Howe, LeAnn; Anderson, Scott; Yates, John R.; Workman, Jerry L. (14 de marzo de 2003). "La histona metiltransferasa Set2 funciona a través del dominio carboxilo-terminal fosforilado de la ARN polimerasa II". Journal of Biological Chemistry . 278 (11): 8897–8903. doi : 10.1074/jbc.M212134200 . ISSN 0021-9258. PMID 12511561.
- ^ Meinhart A, Cramer P (julio de 2004). "Reconocimiento del dominio carboxiterminal de la ARN polimerasa II por factores de procesamiento de ARN 3'". Nature . 430 (6996): 223–6. Bibcode :2004Natur.430..223M. doi :10.1038/nature02679. hdl : 11858/00-001M-0000-0015-8512-8 . PMID 15241417. S2CID 4418258.
- ^ abc Egloff, Sylvain; Murphy, Shona (2008). "Descifrando el código CTD de la ARN polimerasa II". Tendencias en genética . 24 (6): 280–288. doi :10.1016/j.tig.2008.03.008. PMID 18457900.
- ^ Wei L, Levine AS, Lan L (2016). "Recombinación homóloga acoplada a la transcripción después del daño oxidativo". Reparación de ADN (Amst.) . 44 : 76–80. doi :10.1016/j.dnarep.2016.05.009. PMID 27233112.
Enlaces externos
- Más información en Berkeley National Lab ( copia de Wayback Machine )
- ARN+polimerasa+II en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
