Antraquinonas
Para la molécula original 9,10-antraquinona , véase antraquinona

Las antraquinonas (también conocidas como antraquinonoides ) son una clase de compuestos fenólicos naturales basados en el esqueleto de 9,10-antraquinona . Se utilizan ampliamente en la industria y se encuentran en la naturaleza.
El nombre "antraquinona" fue utilizado por primera vez por los químicos alemanes Carl Graebe y Carl Theodore Liebermann en una publicación de 1868 en la que describían la síntesis química del colorante rojo alizarina a partir del antraceno , un componente del alquitrán de hulla . Este descubrimiento condujo a la producción industrial de alizarina y al impulso para una mayor investigación sobre la química de las antraquinonas. [1]
Presencia en plantas

El color amarillo de ciertos líquenes, particularmente de la familia Teloschistaceae (aquí Variospora thallincola ), se debe a la presencia de antraquinonas. [2]
Los pigmentos naturales que son derivados de la antraquinona se encuentran, entre otros, en el látex de aloe, sen , ruibarbo y cáscara sagrada , hongos , líquenes y algunos insectos . Una policétido sintasa de tipo II es responsable de la biosíntesis de antraquinona en la bacteria Photorhabdus luminescens . [3] El corismato , formado por la isocorismato sintasa en la vía del shikimato, es un precursor de las antraquinonas en Morinda citrifolia . [4] Se han establecido pruebas para antraquinonas en extractos naturales. [5]
- Glicósidos de sen del sen .
- Frangulina en Frangula alnus .
- Aloe-emodina en resina de aloe .
- Carmín , un pigmento rojo brillante derivado de los insectos. [6]
- La hipericina y la fagopirina son naftodiantronas, derivados de la antraquinona.
Aplicaciones
En la producción de peróxido de hidrógeno
Una gran aplicación industrial de las antraquinonas es la producción de peróxido de hidrógeno . Se utiliza 2-etil-9,10-antraquinona o un derivado de alquilo relacionado, en lugar de la propia antraquinona. [7]

Se fabrican millones de toneladas de peróxido de hidrógeno mediante el proceso de antraquinona . [8]
Pulpa
El 2-antraquinonasulfonato de sodio (AMS) es un derivado de antraquinona soluble en agua que fue el primer derivado de antraquinona que se descubrió que tenía un efecto catalítico en los procesos de pulpa alcalina. [9]
Precursor de colorante
El esqueleto de 9,10-antraquinona se encuentra en muchos colorantes, como la alizarina . [10] Los derivados importantes de la 9,10-antraquinona son la 1-nitroantraquinona, el ácido antraquinona-1-sulfónico y la dinitroantraquinona. [11]
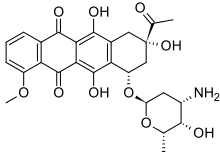
Medicamento
Los derivados de la 9,10-antraquinona incluyen fármacos como las antracenodionas y la familia de fármacos quimioterapéuticos de las antraciclinas . Estos últimos fármacos se derivan de la bacteria Streptomyces peucetius , descubierta en una muestra de suelo cerca del mar Adriático . Los fármacos de la familia de las antraquinonas incluyen la daunorrubicina prototípica , la doxorrubicina , la mitoxantrona , la losoxantrona y la pixantrona . La mayoría de estos fármacos, con la notable excepción de la pixantrona, son extremadamente cardiotóxicos y causan miocardiopatía irreversible , lo que puede limitar su utilidad práctica en el tratamiento del cáncer . [11]
Las antracenodionas también incluyen
- Antipalúdicos como el rufigallol
- Colorantes de ADN/contracolorantes nucleares como DRAQ5, DRAQ7 y CyTRAK Orange para citometría de flujo y microscopía de fluorescencia .
- Los derivados de la antraquinona: reína , emodina, aloe emodina, parietina (fisciona) y crisofanol extraídos de Cassia occidentalis son tóxicos y se sabe que causan hepatomioencefalopatía en niños. [12]
El dantron , la emodina , la emodina del aloe y algunos de los glicósidos de sena tienen efectos laxantes . El uso prolongado y el abuso conducen a la melanosis coli . [13] [14]
Baterías de flujo
Las antraquinonas solubles, como el ácido 9,10-antraquinona-2,7-disulfónico, se utilizan como reactivos en baterías de flujo redox , que proporcionan almacenamiento de energía eléctrica. [15]
Referencias
- ^ Phillips, Max (1929). "La química de la antraquinona". Chemical Reviews . 6 (1): 157–174. doi :10.1021/cr60021a007.
- ^ Llewellyn, Theo; Nowell, Reuben W.; Aptroot, Andre; Temina, Marina; Prescott, Thomas AK; Barraclough, Timothy G.; Gaya, Ester (2023). "La metagenómica arroja luz sobre la evolución del metabolismo de los pigmentos "protectores solares" en los Teloschistales (Ascomycota formadores de líquenes)". Genome Biology and Evolution . 15 (2): evad002. doi :10.1093/gbe/evad002. PMC 9907504 . PMID 36634008.
- ^ Brachmann, AO; Joyce, SA; Jenke-Kodama, H; Schwär, G; Clarke, DJ; Bode, HB (2007). "Una policétido sintasa de tipo II es responsable de la biosíntesis de antraquinona en Photorhabdus luminescens ". ChemBioChem . 8 (14): 1721–8. doi :10.1002/cbic.200700300. PMID 17722122.
- ^ Stalman, M; Koskamp, AM; Luderer, R; Vernooy, JH; Viento, JC; Wullems, GJ; Croes, AF (2003). "Regulación de la biosíntesis de antraquinonas en cultivos celulares de Morinda citrifolia ". Revista de fisiología vegetal . 160 (6): 607–14. doi :10.1078/0176-1617-00773. PMID 12872482.
- ^ Akinjogunla OJ, Yah CS, Eghafona NO, Ogbemudia FO (2010). "Actividad antibacteriana de extractos de hojas de Nymphaea lotus (Nymphaeaceae) sobre Staphylococcus aureus resistente a la meticilina (MRSA) y Staphylococcus aureus resistente a la vancomicina (VRSA) aislados de muestras clínicas". Anales de investigación biológica . 1 (2): 174–184.
- ^ Dapson, RW; Frank, M.; Penney, DP; Kiernan, JA (2007). "Procedimientos revisados para la certificación de carmín (CI 75470, rojo natural 4) como colorante biológico". Biotechnic & Histochemistry . 82 (1): 13–15. doi :10.1080/10520290701207364. PMID 17510809.
- ^ Bueno, G.; Glenneberg, J.; Jacobi, S. (2007). "Peróxido de hidrógeno". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a13_443.pub2. ISBN 978-3527306732.
- ^ Campos-Martin, Jose M.; Blanco-Brieva, Gema; Fierro, Jose LG (2006). "Síntesis de peróxido de hidrógeno: una perspectiva más allá del proceso de antraquinona". Angewandte Chemie International Edition . 45 (42): 6962–6984. doi :10.1002/anie.200503779. PMID 17039551.
- ^ "Pulpado con antraquinona y álcali: una revisión bibliográfica" (PDF) . Proyecto 3370. Appleton, Wisconsin: Instituto de Química del Papel. 1978-07-05.
- ^ Bien, HS; Stawitz, J.; Wunderlich, K. (2005). "Tintes e intermedios de antraquinona". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_355. ISBN 978-3527306732.
- ^ ab Vogel, A. "Antraquinona". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_347. ISBN 978-3527306732.
- ^ Panigrahi, GK; Suthar, MK; Verma, N.; Asthana, S.; Tripathi, A.; Gupta, SK; Saxena, JK; Raisuddin, S.; Das, M. (2015). "Investigación de la interacción de las antraquinonas de las semillas de Cassia occidentalis con la albúmina de suero bovino mediante acoplamiento molecular y análisis espectroscópico: correlación con su potencial citotóxico in vitro". Food Research International . 77 : 368–377. doi :10.1016/j.foodres.2015.08.022.
- ^ Müller-Lissner, SA (1993). "Efectos adversos de los laxantes: realidad y ficción". Farmacología . 47 (Supl 1): 138–145. doi :10.1159/000139853. PMID 8234421.
- ^ Moriarty, KJ; Silk, DB (1988). "Abuso de laxantes". Enfermedades digestivas . 6 (1): 15–29. doi :10.1159/000171181. PMID 3280173.
- ^ Fontmorin, Jean-Marie; Guiheneuf, Solène; Godet-Bar, Thibault; Floner, Didier; Geneste, Florence (2022). "Cómo las antraquinonas pueden permitir que las baterías de flujo redox orgánicas acuosas satisfagan las necesidades de la industrialización". Current Opinion in Colloid & Interface Science . 61 : 101624. doi :10.1016/j.cocis.2022.101624.