Veneno de serpiente

El veneno de serpiente es una saliva altamente tóxica [1] que contiene zootoxinas que facilitan la inmovilización y digestión de las presas . Esto también proporciona defensa contra las amenazas. El veneno de serpiente generalmente se inyecta mediante colmillos únicos durante una mordedura , aunque algunas especies también pueden escupir veneno . [2]
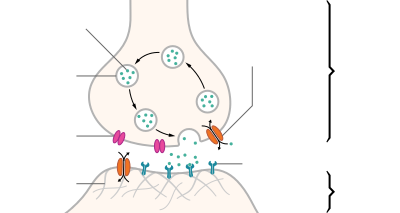
Las glándulas venenosas que secretan zootoxinas son una modificación de las glándulas salivales parótidas que se encuentran en otros vertebrados y suelen estar ubicadas a cada lado de la cabeza, debajo y detrás del ojo, y encerradas en una vaina muscular. El veneno se almacena en grandes glándulas llamadas alvéolos antes de ser transportado por un conducto a la base de colmillos acanalados o tubulares a través de los cuales es expulsado. [3] [4]
El veneno contiene más de 20 compuestos diferentes, que en su mayoría son proteínas y polipéptidos . [3] [5] La compleja mezcla de proteínas, enzimas y varias otras sustancias tiene propiedades tóxicas y letales. [2] El veneno sirve para inmovilizar a la presa. [6] Las enzimas del veneno desempeñan un papel importante en la digestión de la presa, [4] y varias otras sustancias son responsables de efectos biológicos importantes pero no letales. [2] Algunas de las proteínas del veneno de serpiente tienen efectos muy específicos en varias funciones biológicas, incluida la coagulación sanguínea, la regulación de la presión arterial y la transmisión de impulsos nerviosos o musculares. Estos venenos se han estudiado y desarrollado para su uso como herramientas farmacológicas o de diagnóstico, e incluso como medicamentos. [2] [5]
Química
Las proteínas constituyen el 90-95% del peso seco del veneno y son responsables de casi todos sus efectos biológicos. [5] [7] Los cientos, incluso miles, de proteínas que se encuentran en el veneno incluyen toxinas, neurotoxinas en particular, así como proteínas no tóxicas (que también tienen propiedades farmacológicas) y muchas enzimas, especialmente las hidrolíticas . [2] Las enzimas ( peso molecular 13-150 KDa) constituyen el 80-90% de los venenos de vipéridos y el 25-70% de los de elápidos , incluidas las hidrolasas digestivas , la L-aminoácido oxidasa , las fosfolipasas , el procoagulante similar a la trombina y las serina proteasas y metaloproteinasas (hemorraginas) similares a la calicreína , que dañan el endotelio vascular . Las toxinas polipeptídicas (peso molecular 5-10 KDa) incluyen citotoxinas , cardiotoxinas y neurotoxinas postsinápticas (como α-bungarotoxina y α-cobratoxina ), que se unen a los receptores de acetilcolina en las uniones neuromusculares. Los compuestos con bajo peso molecular (hasta 1,5 KDa) incluyen metales, péptidos, lípidos, nucleósidos , carbohidratos, aminas y oligopéptidos , que inhiben la enzima convertidora de angiotensina (ECA) y potencian la bradicinina (BPP). La variación inter e intra-especie en la composición química del veneno es geográfica y ontogénica. [3] Las fosfodiesterasas interfieren con el sistema cardíaco de la presa, principalmente para reducir la presión arterial . La fosfolipasa A2 causa hemólisis al lisar las membranas celulares de fosfolípidos de los glóbulos rojos . [8] Las aminooxidasas y proteasas se utilizan para la digestión. La aminoácido oxidasa también activa otras enzimas y es responsable del color amarillo del veneno de algunas especies. La hialuronidasa aumenta la permeabilidad tisular para acelerar la absorción de otras enzimas en los tejidos. Algunos venenos de serpientes contienen fasciculinas , como las mambas ( Dendroaspis ), que inhiben la colinesterasa para hacer que la presa pierda el control muscular. [9]
| Tipo | Nombre | Origen |
|---|---|---|
| Oxidorreductasas | lactato deshidrogenasa | Elápidos |
| L-aminoácido oxidasa | Todas las especies | |
| Catalasa | Todas las especies | |
| Transferasas | Alanina amino transferasa | |
| Hidrolasas | Fosfolipasa A2 | Todas las especies |
| Lisofosfolipasa | Elápidos, víperidos | |
| Acetilcolinesterasa | Elápidos | |
| Fosfatasa alcalina | Bothrops atrox | |
| Fosfatasa ácida | Deinagkistrodon acutus | |
| 5'-nucleotidasa | Todas las especies | |
| Fosfodiesterasa | Todas las especies | |
| Desoxirribonucleasa | Todas las especies | |
| Ribonucleasa 1 | Todas las especies | |
| Adenosina trifosfatasa | Todas las especies | |
| Amilasa | Todas las especies | |
| Hialuronidasa | Todas las especies | |
| NAD-Nucleotidasa | Todas las especies | |
| Quininogenasa | Viperidae | |
| Activador del factor X | Viperidae, Crotalinae | |
| Heparinasa | Crotalinas | |
| α-fibrinogenasa | Viperidae, Crotalinae | |
| β-Fibrinogenasa | Viperidae, Crotalinae | |
| α-β-Fibrinogenasa | Bitis gabonica | |
| Enzima fibrinolítica | Crotalinas | |
| Activador de la protrombina | Crotalinas | |
| Colagenasa | Viperidae | |
| Elastasa | Viperidae | |
| Liasas | Glucosaminato amoniaco-liasa |
Las toxinas de las serpientes varían mucho en sus funciones. Las dos grandes clases de toxinas que se encuentran en los venenos de las serpientes son las neurotoxinas (que se encuentran principalmente en los elápidos) y las hemotoxinas (que se encuentran principalmente en los vipéridos). Sin embargo, hay excepciones: el veneno de la cobra escupidora de cuello negro ( Naja nigricollis ), un elápido, consiste principalmente en citotoxinas , mientras que el de la serpiente de cascabel de Mojave ( Crotalus scutulatus ), un vipérido, es principalmente neurotóxico. Tanto los elápidos como los vipéridos pueden transportar muchos otros tipos de toxinas.
| α-neurotoxinas | α-Bungarotoxina , α-toxina, erabutoxina, cobratoxina |
|---|---|
| β-neurotoxinas ( PLA2 ) | β-Bungarotoxina , Notexin, ammodytoxina, crotoxina , taipoxina |
| κ-neurotoxinas | Kappa-bungarotoxin |
| Dendrotoxinas ( Kunitz ) | Dendrotoxina , toxinas I y K; posiblemente cadena B de β-bungarotoxina |
| Cardiotoxinas | Toxina y de Naja nigricollis , cardiotoxina III (también conocida como citotoxina) |
| Miotoxinas | Miotoxina -a, crotamina |
| Sarafotoxinas | Sarafotoxinas a, b y c |
| Hemorraginas (metaloproteasa) | Mucrolisinas , Atrolisinas , Acutolisinas , etc. [11] |
| Hemotoxinas (serina proteasa) | Venombina A |
Toxinas
En esta sección falta información sobre cómo las clasificaciones evolutivas/estructurales se corresponden con las clasificaciones funcionales. ( Agosto de 2021 ) |
Neurotoxinas
El inicio de un nuevo impulso neuronal se produce de la siguiente manera:
- Un intercambio de iones (átomos cargados) a través de la membrana de la célula nerviosa envía una corriente despolarizante hacia el final de la célula nerviosa (terminal celular).
- Cuando la corriente despolarizante llega a la terminal de la célula nerviosa, el neurotransmisor acetilcolina (ACh), que se encuentra en vesículas , se libera en el espacio entre los dos nervios (sinapsis) y se desplaza a través de la sinapsis hasta los receptores postsinápticos.
- La ACh se une a los receptores y transfiere la señal a la célula objetivo, y después de un corto tiempo, es destruida por la acetilcolinesterasa.
Fasciculinas
- Estas toxinas atacan a las neuronas colinérgicas (las que utilizan la ACh como transmisora) destruyendo la acetilcolinesterasa (AChE). La ACh, por tanto, no se puede descomponer y se queda en el receptor. Esto provoca tetania (contracción muscular involuntaria), que puede provocar la muerte. Las toxinas se han denominado fasciculinas ya que tras su inyección en ratones provocan fasciculaciones (contracciones musculares rápidas) graves, generalizadas y de larga duración (5-7 h) .
- Ejemplo de serpiente: se encuentra principalmente en el veneno de las mambas ( Dendroaspis spp.) y algunas serpientes de cascabel ( Crotalus spp.).
Dendrotoxinas
- Las dendrotoxinas inhiben las neurotransmisiones al bloquear el intercambio de iones positivos y negativos a través de la membrana neuronal, lo que provoca que no haya impulso nervioso y paraliza los nervios.
- Ejemplo de serpiente: mambas
α-neurotoxinas
- Las alfa-neurotoxinas son un grupo grande; se han identificado y secuenciado más de 100 neurotoxinas postsinápticas. [12] Las α-neurotoxinas atacan los receptores nicotínicos de acetilcolina de las neuronas colinérgicas. Imitan la forma de la molécula de acetilcolina y, por lo tanto, encajan en los receptores, donde bloquean el flujo de ACh, lo que produce una sensación de entumecimiento y parálisis.
- Ejemplos de serpientes: cobra real ( Ophiophagus hannah ) (conocida como hannahtoxina que contiene α-neurotoxinas), [13] serpientes marinas (Hydrophiinae) (conocidas como erabutoxina), krait de muchas bandas ( Bungarus multicinctus ) (conocida como α-bungarotoxina ) y cobras ( Naja spp.) (conocidas como cobratoxina ).
Citotoxinas


Fosfolipasas
- La fosfolipasa es una enzima que transforma la molécula de fosfolípido en un lisofosfolípido (jabón) → la nueva molécula atrae y fija la grasa y rompe las membranas celulares. La fosfolipasa A2 es un tipo específico de fosfolipasas que se encuentran en el veneno de serpiente.
- Ejemplo de serpiente: serpiente habu de Okinawa ( Trimeresurus flavoviridis )
Cardiotoxinas / Citotoxinas
- Las cardiotoxinas son componentes específicamente tóxicos para el corazón. Se unen a sitios específicos de la superficie de las células musculares y causan despolarización → la toxina impide la contracción muscular. Estas toxinas pueden hacer que el corazón lata de forma irregular o deje de latir, lo que provoca la muerte. Un ejemplo es la cardiotoxina III de tres dedos de la cobra china , un ejemplo de la familia de las cobras de tres dedos cortos ( InterPro : IPR003572 ).
- Ejemplos de serpientes: mambas y algunas especies de Naja
Hemotoxinas
- Las hemotoxinas causan hemólisis, la destrucción de glóbulos rojos (eritrocitos), o inducen la coagulación sanguínea (coagulación, p. ej. mucrocetina ). Una familia común de hemotoxinas incluye metaloproteinasas de veneno de serpiente como la mucrolisina . [11] [14]
- Ejemplos de serpientes: la mayoría de las víboras y muchas especies de cobras : la serpiente de cascabel tropical Crotalus durissus produce convulxina , un coagulante. [15]
Miotoxinas

Las miotoxinas son péptidos básicos pequeños que se encuentran en los venenos de las serpientes de cascabel [16] [17] y de los lagartos (por ejemplo, el lagarto de cuentas mexicano ) [18] . Esto implica un mecanismo no enzimático que conduce a una necrosis muscular esquelética grave . Estos péptidos actúan muy rápidamente, causando una parálisis instantánea para evitar que la presa escape y, finalmente, la muerte debido a la parálisis diafragmática .
La primera miotoxina identificada y aislada fue la crotamina , descubierta en la década de 1950 por el científico brasileño José Moura Gonçalves a partir del veneno de la serpiente de cascabel tropical sudamericana Crotalus durissus terrificus . Sus acciones biológicas, su estructura molecular y el gen responsable de su síntesis se han dilucidado en las últimas dos décadas.
Determinación de la toxicidad del veneno (LD50)
En esta sección falta información sobre por qué funciona mejor la dilución de albúmina. ( Agosto de 2021 ) |
La toxicidad del veneno de serpiente se evalúa mediante una prueba toxicológica llamada dosis letal media , dosis letal 50% (abreviada como LD 50 ), que determina la concentración de una toxina necesaria para matar a la mitad de los miembros de una población analizada. La potencia del veneno de serpiente salvaje varía considerablemente debido a diversas influencias, como el entorno biofísico , el estado fisiológico, las variables ecológicas , la variación genética (ya sea adaptativa o incidental) y otros factores evolutivos moleculares y ecológicos. [ cita requerida ] Esto es cierto incluso para los miembros de una especie. Dicha variación es menor en poblaciones cautivas en entornos de laboratorio, aunque no se puede eliminar. Sin embargo, los estudios para determinar la potencia del veneno de serpiente deben diseñarse para minimizar la variabilidad.
Se han diseñado varias técnicas para este fin. Un enfoque es utilizar albúmina de suero bovino al 0,1% (también conocida como "fracción V" en el proceso de Cohn ) como diluyente para determinar los valores de LD 50. Esto da como resultado determinaciones de LD 50 más precisas y consistentes que el uso de solución salina al 0,1% como diluyente. Por ejemplo, la fracción V produce aproximadamente un 95% de albúmina purificada (veneno crudo seco). La solución salina como diluyente produce constantemente resultados de LD 50 muy variables para casi todas las serpientes venenosas. Produce una variación impredecible en la pureza del precipitado (35-60%). [19] La fracción V es estructuralmente estable porque tiene diecisiete enlaces disulfuro ; es única en el sentido de que tiene la solubilidad más alta y el punto isoeléctrico más bajo de las principales proteínas plasmáticas. Esto la convierte en la fracción final que se precipita de su solución. La albúmina sérica bovina se encuentra en la fracción V. La precipitación de la albúmina se realiza reduciendo el pH a 4,8, cerca del pH de las proteínas, y manteniendo la concentración de etanol al 40%, con una concentración de proteínas del 1%. De esta forma, solo el 1% del plasma original permanece en la quinta fracción. [20]
Cuando el objetivo final del procesamiento del plasma es un componente de plasma purificado para inyección o transfusión , el componente de plasma debe ser altamente puro. El primer método práctico a gran escala de fraccionamiento de plasma sanguíneo fue desarrollado por Edwin J. Cohn durante la Segunda Guerra Mundial . Se conoce como el proceso Cohn (o método Cohn). Este proceso también se conoce como fraccionamiento de etanol en frío, ya que implica aumentar gradualmente la concentración de etanol en la solución a 5 °C y 3 °C. [21] El proceso Cohn explota las diferencias en las propiedades de las proteínas plasmáticas, específicamente, la alta solubilidad y el bajo pI de la albúmina. A medida que la concentración de etanol aumenta en etapas de 0 a 40%, el pH disminuye de neutro (pH ~ 7) a aproximadamente 4,8, que está cerca del pI de la albúmina. [21] En cada etapa, las proteínas se precipitan de la solución y se eliminan. El precipitado final es albúmina purificada. Existen varias variaciones de este proceso, incluyendo un método adaptado por Nitschmann y Kistler que utiliza menos pasos y reemplaza la centrifugación y la congelación a granel con filtración y diafiltración. [21] [22] Algunos métodos más nuevos de purificación de albúmina agregan pasos de purificación adicionales al proceso de Cohn y sus variaciones. El procesamiento cromatográfico de albúmina surgió en la década de 1980, sin embargo, no fue ampliamente adoptado hasta más tarde debido a la escasez de equipos de cromatografía a gran escala . Los métodos que incorporan cromatografía generalmente comienzan con plasma criodepletado sometido a intercambio de tampón mediante diafiltración o cromatografía de intercambio de tampón, para preparar el plasma para los siguientes pasos de cromatografía de intercambio iónico . Después del intercambio iónico, generalmente ocurren los pasos de purificación y el intercambio de tampón. [21]
Sin embargo, los métodos cromatográficos comenzaron a adoptarse en la década de 1980. [ cita requerida ] Los desarrollos continuaron entre cuando comenzó a surgir el fraccionamiento de Cohn en 1946, y cuando surgió la cromatografía , en 1983. En 1962, se creó el proceso de Kistler y Nistchmann como un derivado del proceso de Cohn. En la década de 1990, se crearon los procesos Zenalb y CSL Albumex, que incorporaron cromatografía con variaciones. El enfoque general para usar la cromatografía para el fraccionamiento de plasma para albúmina es: recuperación de sobrenadante I, deslipidación, cromatografía de intercambio aniónico , cromatografía de intercambio catiónico y cromatografía de filtración en gel. El material purificado recuperado se formula con combinaciones de octanoato de sodio y N-acetil triptofanato de sodio y luego se somete a procedimientos de inactivación viral, incluida la pasteurización a 60 °C. Esta es una alternativa más eficiente que el proceso de Cohn porque:
- Se necesitaba una automatización fluida y una planta relativamente económica,
- Es más fácil esterilizar los equipos y mantener un buen entorno de fabricación.
- Los procesos cromatográficos son menos dañinos para la proteína albúmina.
- Se puede lograr un resultado de albúmina más exitoso. [ cita requerida ]
En comparación con el proceso de Cohn, la pureza de la albúmina aumentó de aproximadamente el 95% al 98% mediante cromatografía, y el rendimiento aumentó de aproximadamente el 65% al 85%. Pequeños aumentos porcentuales marcan una diferencia en lo que respecta a mediciones sensibles como la pureza. El gran inconveniente tiene que ver con la economía. Aunque el método ofrecía eficiencia, adquirir el equipo necesario era difícil. Se necesitaba maquinaria grande y, durante mucho tiempo, la falta de disponibilidad de equipo limitó su uso generalizado. [ cita requerida ]
Evolución
El veneno evolucionó solo una vez entre todos los Toxicofera hace unos 170 millones de años, y luego se diversificó en la enorme diversidad de venenos que se ve hoy. [23] El veneno original de los toxicoferanos era un conjunto muy simple de proteínas que se ensamblaban en un par de glándulas. Posteriormente, este conjunto de proteínas evolucionó de forma independiente en los diversos linajes de toxicoferanos, incluidos Serpentes , Anguimorpha e Iguania . [24] Desde entonces, varios linajes de serpientes han perdido la capacidad de producir veneno, a menudo debido a un cambio en la dieta o un cambio en las tácticas depredadoras. [23] Además de esto, la fuerza y la composición del veneno han cambiado debido a los cambios en las presas de ciertas especies de serpientes. Por ejemplo, el veneno de la serpiente marina jaspeada ( Aipysurus eydouxii ) se volvió significativamente menos tóxico después de que la dieta de esta especie cambiara de pescado a estrictamente huevos de pescado. [23] Se cree que la evolución del veneno es responsable de la enorme expansión de las serpientes en todo el mundo. [23] [25]
El mecanismo de evolución en la mayoría de los casos ha sido la duplicación de genes en tejidos no relacionados con el veneno. [24] Las proteínas salivales preexistentes son los ancestros probables de la mayoría de los genes de la toxina del veneno. [26] La expresión de la nueva proteína en la glándula del veneno siguió a la duplicación. [24] Luego procedió la selección natural para los rasgos adaptativos siguiendo el modelo de nacimiento y muerte, donde la duplicación es seguida por la diversificación funcional, lo que resulta en la creación de proteínas estructuralmente relacionadas que tienen funciones ligeramente diferentes. [23] [24] [27] El estudio de la evolución del veneno ha sido una alta prioridad para los científicos en términos de investigación científica, debido a la relevancia médica del veneno de serpiente, en términos de hacer investigación sobre antivenenos y cáncer. Saber más sobre la composición del veneno y las formas en que potencialmente puede evolucionar es muy beneficioso. Se han estudiado de cerca tres factores principales que afectan la evolución del veneno: los depredadores de la serpiente que son resistentes al veneno de serpiente, las presas que están en una carrera armamentista evolutiva con las serpientes y las dietas específicas que afectan la evolución intraespecífica del veneno. [23] [28] Los venenos continúan evolucionando como toxinas específicas y se modifican para apuntar a una presa específica, y se ha descubierto que las toxinas varían según la dieta en algunas especies. [29] [30]
La rápida evolución del veneno también puede explicarse por la carrera armamentista entre las moléculas dirigidas al veneno en depredadores resistentes, como la zarigüeya , y el veneno de serpiente que se dirige a las moléculas. Los científicos realizaron experimentos con las zarigüeyas y descubrieron que múltiples ensayos mostraban reemplazos silenciosos en el gen del factor von Willebrand ( vWf ) que codifica una proteína sanguínea hemostática dirigida al veneno. Se cree que estas sustituciones debilitan la conexión entre el vWf y un ligando tóxico del veneno de serpiente (botrocetina), que cambia la carga neta y la hidrofobicidad. Estos resultados son importantes para la evolución del veneno porque es la primera cita de una rápida evolución en una molécula dirigida al veneno. Esto demuestra que puede estar ocurriendo una carrera armamentista evolutiva en términos de propósitos defensivos. Las hipótesis alternativas sugieren que la evolución del veneno se debe a la adaptación trófica, mientras que estos científicos creen, en este caso, que la selección se produciría en rasgos que ayudan a la supervivencia de la presa en términos de evolución del veneno en lugar del éxito de la depredación. Varios otros depredadores de la víbora de foseta (mangostas y erizos) muestran el mismo tipo de relación entre serpientes, lo que ayuda a apoyar la hipótesis de que el veneno tiene un papel defensivo muy fuerte junto con un papel trófico. Lo que a su vez apoya la idea de que la depredación de las serpientes puede ser la carrera armamentista que produce la evolución del veneno de serpiente. [31]
Algunas de las diversas adaptaciones producidas por este proceso incluyen veneno más tóxico para presas específicas en varios linajes, [30] [32] [33] proteínas que predigieren a la presa, [34] así como un método para rastrear a la presa después de una mordedura. [35] Aunque la función del veneno ha evolucionado para ser específica para la clase de presa (por ejemplo, efectos coagulantes particulares), [36] la evolución de efectos toxicológicos amplios (por ejemplo, neurotoxicidad o coagulotoxicidad) no parece verse ampliamente afectada por el tipo de presa. [37] Alguna vez se creyó que la presencia de enzimas digestivas en el veneno de serpiente era una adaptación para ayudar a la digestión. Sin embargo, estudios de la serpiente de cascabel de diamante occidental ( Crotalus atrox ), una serpiente con veneno altamente proteolítico , muestran que el veneno no tiene impacto en el tiempo requerido para que el alimento pase a través del intestino . [38] Estas diversas adaptaciones del veneno también han llevado a un debate considerable sobre la definición de veneno y serpientes venenosas. [23]
Inyección
Víboras
En las víboras , que tienen el aparato de distribución de veneno más desarrollado, la glándula venenosa es muy grande y está rodeada por el músculo masetero o temporal , que consta de dos bandas, la superior que surge detrás del ojo, la inferior que se extiende desde la glándula hasta la mandíbula. Un conducto lleva el veneno desde la glándula hasta el colmillo. En las víboras y elápidos, este surco está completamente cerrado, formando un tubo hipodérmico similar a una aguja. En otras especies, los surcos no están cubiertos, o solo están parcialmente cubiertos. Desde el extremo anterior de la glándula, el conducto pasa por debajo del ojo y por encima del hueso maxilar , hasta el orificio basal del colmillo venenoso, que está envainado en un grueso pliegue de membrana mucosa . Por medio del hueso maxilar móvil articulado al hueso prefrontal y conectado con el hueso transverso, que es empujado hacia adelante por músculos activados por la apertura de la boca, se erige el colmillo y el veneno se descarga a través del orificio distal. Cuando la serpiente muerde, las mandíbulas se cierran y los músculos que rodean la glándula se contraen, lo que hace que el veneno sea expulsado a través de los colmillos.
Elápidos
En los elápidos proteroglifos , los colmillos son tubulares, pero cortos y no poseen la movilidad observada en las víboras.
Colúbridos
Los colúbridos opistoglifos tienen dientes agrandados y acanalados situados en el extremo posterior del maxilar , donde una pequeña porción posterior de la glándula labial o salival superior produce veneno.
Mecánica de la mordida

Varios géneros, entre ellos las serpientes coral asiáticas ( Calliophis ), los áspides cavadores ( Atractaspis ) y las víboras nocturnas ( Causus ), son notables por tener glándulas venenosas excepcionalmente largas, que se extienden a lo largo de cada lado del cuerpo y, en algunos casos, se extienden posteriormente hasta el corazón. En lugar de que los músculos de la región temporal sirvan para expulsar el veneno hacia el conducto, esta acción la realizan los músculos de los costados del cuerpo.
Se observa una variabilidad considerable en el comportamiento de mordedura entre las serpientes. Cuando muerden, las serpientes vipéridas suelen atacar rápidamente, descargando veneno a medida que los colmillos penetran la piel y luego lo liberan de inmediato. Alternativamente, como en el caso de una respuesta de alimentación, algunos vipéridos (por ejemplo, Lachesis ) muerden y sujetan. Un proteroglifo u opistoglifo puede cerrar sus mandíbulas y morder o masticar firmemente durante un tiempo considerable.
Las diferencias en la longitud de los colmillos entre las distintas serpientes venenosas probablemente se deban a la evolución de diferentes estrategias de ataque. [39] Además, se ha demostrado que los colmillos de diferentes especies de serpientes venenosas tienen diferentes tamaños y formas dependiendo de las propiedades biomecánicas de la presa de la serpiente. [40]
Mecánica del escupir
Las cobras escupidoras de los géneros Naja y Hemachatus , cuando se sienten irritadas o amenazadas, pueden expulsar chorros o una pulverización de veneno a una distancia de entre 1,2 y 2,4 metros. Los colmillos de estas serpientes han sido modificados para que puedan escupir; en el interior de los colmillos, el canal forma una curva de 90° hacia la parte frontal inferior del colmillo. Las cobras escupidoras pueden escupir repetidamente y aun así ser capaces de asestar una mordedura mortal.
El escupitajo es una reacción defensiva. Las serpientes tienden a apuntar a los ojos de quienes perciben una amenaza. Un golpe directo puede causar un shock temporal y ceguera a través de una inflamación grave de la córnea y la conjuntiva . Aunque por lo general no se producen síntomas graves si el veneno se lava inmediatamente con abundante agua, la ceguera puede volverse permanente si no se trata. El contacto breve con la piel no es inmediatamente peligroso, pero las heridas abiertas pueden ser vectores de envenenamiento.
Efectos fisiológicos
Este artículo necesita citas adicionales para su verificación . ( agosto de 2021 ) |
Los cuatro tipos distintos de veneno actúan de forma diferente en el cuerpo:
- El veneno proteolítico desmantela el entorno molecular, incluso en el lugar de la picadura.
- El veneno hemotóxico actúa sobre el sistema cardiovascular, incluido el corazón y la sangre.
- El veneno neurotóxico actúa sobre el sistema nervioso, incluido el cerebro.
- El veneno citotóxico tiene una acción localizada en el lugar de la picadura.
Serpientes proteroglifas
El efecto del veneno de las serpientes proteroglifas ( serpientes marinas , kraits , mambas , serpientes negras , serpientes tigre y víboras de la muerte ) se produce principalmente en el sistema nervioso , produciéndose rápidamente parálisis respiratoria al poner el veneno en contacto con el mecanismo nervioso central que controla la respiración; el dolor y la hinchazón local que siguen a una mordedura no suelen ser graves. La mordedura de todos los elápidos proteroglifos, incluso de los más pequeños y gentiles, como las serpientes coral , es, hasta donde se sabe, mortal para los humanos. Sin embargo, quedan algunos elápidos ligeramente venenosos, como las serpientes encapuchadas ( Parasuta ), las bandy-bandies ( Vermicella ), etc.
Víboras
El veneno de las víboras ( víbora de Russell , víbora de escamas de sierra , víbora de monte y serpiente de cascabel ) actúa más sobre el sistema vascular, provocando la coagulación de la sangre y la coagulación de las arterias pulmonares; su acción sobre el sistema nervioso no es grande, no parece distinguirse ningún grupo individual de células nerviosas y el efecto sobre la respiración no es tan directo; la influencia sobre la circulación explica la gran depresión, que es un síntoma de envenenamiento por víboras. El dolor de la herida es intenso y es rápidamente seguido por hinchazón y decoloración. Los síntomas producidos por la mordedura de las víboras europeas son descritos así por Martin y Lamb: [41]
La mordedura es seguida inmediatamente por un dolor local de carácter ardiente; la extremidad pronto se hincha y se decolora, y en una a tres horas se produce una gran postración, acompañada de vómitos y, a menudo , diarrea . Es habitual una transpiración fría y húmeda. El pulso se vuelve extremadamente débil y se puede observar una ligera disnea e inquietud. En los casos graves, que se dan sobre todo en niños, el pulso puede hacerse imperceptible y las extremidades frías; el paciente puede entrar en coma . En un plazo de doce a veinticuatro horas estos graves síntomas constitucionales suelen desaparecer; pero mientras tanto, la hinchazón y la decoloración se han extendido enormemente. La extremidad se vuelve flemonosa y, ocasionalmente, supura. En unos pocos días, la recuperación suele producirse de forma bastante repentina, pero la muerte puede resultar de la depresión grave o de los efectos secundarios de la supuración . En el último capítulo de esta Introducción se menciona que los casos de muerte, tanto en adultos como en niños, no son infrecuentes en algunas partes del continente.
Las víboras difieren mucho entre sí en la toxicidad de sus venenos. Algunas, como la víbora india de Russell ( Daboia russelli ) y la víbora de escamas de sierra ( E. carinatus ); las serpientes de cascabel americanas ( Crotalus spp.), las víboras de monte ( Lachesis spp.) y las víboras de cabeza de lanza ( Bothrops spp.); y las víboras africanas ( Bitis spp.), las víboras nocturnas ( Causus spp.) y las víboras cornudas ( Cerastes spp.), causan resultados fatales a menos que se aplique un remedio rápidamente. La mordedura de las víboras europeas más grandes puede ser muy peligrosa y tener resultados fatales, especialmente en los niños, al menos en las partes más cálidas del continente; Mientras que la pequeña víbora de los prados ( Vipera ursinii ), que casi nunca muerde a menos que se la manipule bruscamente, no parece poseer un veneno muy virulento y, aunque es muy común en algunas partes de Austria y Hungría , no se sabe que haya causado alguna vez un accidente grave.
Colúbridos opistoglifos
Los biólogos sabían desde hacía tiempo que algunas serpientes tenían colmillos traseros, mecanismos de inyección de veneno "inferiores" que podían inmovilizar a sus presas; aunque se registraron algunas muertes, hasta 1957 la posibilidad de que esas serpientes fueran mortales para los humanos parecía, como mucho, remota. Las muertes de dos destacados herpetólogos, Robert Mertens y Karl Schmidt , por mordeduras de colúbridos africanos, cambiaron esa evaluación, y los acontecimientos recientes revelan que varias otras especies de serpientes con colmillos traseros tienen venenos que son potencialmente letales para los grandes vertebrados.
Los venenos de la serpiente Boomslang ( Dispholidus typus ) y de la serpiente de las ramas ( Thelotornis spp.) son tóxicos para las células sanguíneas y diluyen la sangre (hemotóxicos, hemorrágicos). Los primeros síntomas incluyen dolores de cabeza, náuseas, diarrea, letargo, desorientación mental, hematomas y sangrado en el lugar y en todos los orificios del cuerpo. La principal causa de muerte por este tipo de mordeduras es el desangramiento .
El veneno de la boomslang es el más potente de todas las serpientes con colmillos traseros del mundo según la LD50 . Aunque su veneno puede ser más potente que el de algunas víboras y elápidos, causa menos muertes debido a varios factores (por ejemplo, la eficacia de los colmillos no es alta en comparación con muchas otras serpientes, la dosis de veneno administrada es baja y las boomslangs son generalmente menos agresivas en comparación con otras serpientes venenosas como las cobras y las mambas). Los síntomas de una mordedura de estas serpientes incluyen náuseas y hemorragia interna, y uno podría morir de una hemorragia cerebral y colapso respiratorio .
Serpientes aglifas
Experimentos realizados con la secreción de la glándula parótida de Rhabdophis y Zamenis han demostrado que incluso las serpientes aglifas no están completamente desprovistas de veneno, y apuntan a la conclusión de que la diferencia fisiológica entre las serpientes llamadas inofensivas y venenosas es solo de grado, al igual que existen varios pasos en la transformación de una glándula parótida ordinaria en una glándula venenosa o de un diente sólido en un colmillo tubular o estriado.
Uso de venenos de serpiente para tratar enfermedades
Dado que el veneno de serpiente contiene muchos ingredientes biológicamente activos, algunos pueden ser útiles para tratar enfermedades. [42]
Por ejemplo, se ha descubierto que las fosfolipasas tipo A2 (PLA2) de las víboras tunecinas Cerastes cerastes y Macrovipera lebetina tienen actividad antitumoral. [43] También se ha informado de actividad anticancerígena para otros compuestos del veneno de serpiente. [44] [45] Las PLA2 hidrolizan los fosfolípidos, por lo que podrían actuar sobre las superficies de las células bacterianas, proporcionando nuevas actividades antimicrobianas (antibióticas). [46]
La actividad analgésica (antidolor) de muchas proteínas del veneno de serpiente se conoce desde hace mucho tiempo. [47] [48] Sin embargo, el principal desafío es cómo hacer llegar las proteínas a las células nerviosas: las proteínas normalmente no se pueden aplicar en forma de píldoras.
Inmunidad
Entre serpientes
La cuestión de si las serpientes individuales son inmunes a su propio veneno aún no se ha resuelto definitivamente, aunque se conoce un ejemplo de una cobra que se autoenvenenó, lo que resultó en un gran absceso que requirió intervención quirúrgica, pero no mostró ninguno de los otros efectos que habrían demostrado ser rápidamente letales en especies presa o humanos. [49] Además, ciertas especies inofensivas, como la serpiente real común de América del Norte ( Lampropeltis getula ) y la mussurana de América Central y del Sur ( Clelia spp.), son a prueba contra el veneno de los crotalinos , que frecuentan los mismos distritos, y a los que pueden dominar y alimentarse. La serpiente gallina ( Spilotes pullatus ) es el enemigo de la fer-de-lance ( Bothrops caribbaeus ) en Santa Lucía, y en sus encuentros, la serpiente gallina es invariablemente la vencedora. Experimentos repetidos han demostrado que la culebra de collar europea ( Natrix natrix ) no se ve afectada por la mordedura de la víbora europea ( Vipera berus ) y del áspid europeo ( Vipera aspis ), debido a la presencia, en la sangre de la inofensiva serpiente, de principios tóxicos secretados por las glándulas parótidas y labiales, y análogos a los del veneno de estas víboras. Varias especies norteamericanas de serpientes ratoneras, así como serpientes reales, han demostrado ser inmunes o muy resistentes al veneno de especies de serpientes de cascabel. Se dice que la cobra real, que sí se alimenta de cobras, es inmune a su veneno.
Entre otros animales
Se sabe que el erizo (Erinaceidae), la mangosta (Herpestidae), el tejón de miel ( Mellivora capensis ) y la zarigüeya son inmunes a una dosis de veneno de serpiente. [ cita requerida ] Recientemente, se descubrió que el tejón de miel y el cerdo doméstico habían desarrollado de manera convergente reemplazos de aminoácidos en su receptor nicotínico de acetilcolina, que se sabe que confieren resistencia a las alfa-neurotoxinas en los erizos. [50] Aún no se sabe si el cerdo puede considerarse inmune, aunque los primeros estudios muestran resistencia endógena en cerdos probados contra neurotoxinas. [51] Aunque la capa subcutánea de grasa del cerdo puede protegerlo contra el veneno de serpiente, la mayoría de los venenos pasan fácilmente a través de las capas de grasa vascular, lo que hace que sea poco probable que esto contribuya a su capacidad para resistir venenos. El lirón de jardín ( Eliomys quercinus ) se ha agregado recientemente a la lista de animales refractarios al veneno de víbora. Algunas poblaciones de ardilla terrestre de California ( Otospermophilus beecheyi ) son al menos parcialmente inmunes al veneno de la serpiente de cascabel cuando son adultas.
Entre los humanos
La adquisición de inmunidad humana contra el veneno de serpiente es antigua (de alrededor del año 60 d. C., tribu Psylli ). La investigación sobre el desarrollo de vacunas que conduzcan a la inmunidad está en curso. Bill Haast , propietario y director del Serpentario de Miami, se inyectó veneno de serpiente durante la mayor parte de su vida adulta, en un esfuerzo por desarrollar inmunidad a una amplia gama de serpientes venenosas, en una práctica conocida como mitridatismo . Haast vivió hasta los 100 años y sobrevivió a 172 mordeduras de serpientes. Donó su sangre para que se usara en el tratamiento de pacientes con mordeduras de serpiente cuando no había un antiveneno adecuado disponible. Más de 20 individuos tratados de esa manera se recuperaron. [52] [53] [54] El investigador aficionado Tim Friede también deja que las serpientes venenosas lo muerdan con la esperanza de que se desarrolle una vacuna contra el veneno de serpiente, y ha sobrevivido a más de 160 mordeduras de diferentes especies hasta enero de 2016. [55]
Tratamientos tradicionales
La Organización Mundial de la Salud estima que el 80% de la población mundial depende de la medicina tradicional para sus necesidades de atención primaria de salud. [56] Los métodos de tratamiento tradicional de las mordeduras de serpiente, aunque de eficacia cuestionable y quizás incluso dañinos, son no obstante relevantes.
Las plantas que se utilizan para tratar las mordeduras de serpiente en Trinidad y Tobago se convierten en tinturas con alcohol o aceite de oliva y se guardan en frascos de ron llamados botellas de serpiente, que contienen varias plantas y/o insectos diferentes. Las plantas utilizadas incluyen la enredadera llamada escalera de mono ( Bauhinia cumanensis o Bauhinia excisa , Fabaceae), que se machaca y se aplica sobre la mordedura. Alternativamente, se hace una tintura con un trozo de la enredadera y se guarda en una botella de serpiente. Otras plantas utilizadas incluyen raíz de estera ( Aristolochia rugosa ), uña de gato ( Pithecellobim unguis-cati ), tabaco ( Nicotiana tabacum ), arbusto de serpiente ( Barleria lupulina ), semilla de obie ( Cola nitida ) y raíz de gri gri silvestre ( Acrocomia aculeata ). Algunas botellas de serpiente también contienen las orugas ( Battus polydamas , Papilionidae) que comen hojas de árboles ( Aristolochia trilobata ). Los medicamentos de emergencia para las serpientes se obtienen masticando un trozo de tres pulgadas de la raíz de bois canôt ( Cecropia peltata ) y administrando esta solución de raíz masticada al sujeto mordido (generalmente un perro de caza). Esta es una planta nativa común de América Latina y el Caribe, lo que la hace apropiada como remedio de emergencia. Otra planta nativa utilizada es el carnaval ( Renealmia alpinia ) (bayas), que se trituran junto con el jugo de caña silvestre ( Costus scaber ) y se dan a la persona mordida. Las soluciones rápidas han incluido la aplicación de tabaco masticado de cigarrillos, puros o pipas. [57] En el pasado, se pensaba que hacer cortes alrededor de la punción o succionar el veneno era útil, pero ahora este curso de tratamiento se desaconseja enérgicamente, debido al riesgo de autoenvenenamiento a través de cortes con cuchillo o cortes en la boca (se pueden usar ventosas de los kits para mordeduras de serpiente, pero la succión rara vez proporciona un beneficio mensurable). [58] [59]
Sueroterapia
La seroterapia con antiveneno es un tratamiento común en la actualidad y se describió en 1913. [nota 1] Tanto la inmunidad adaptativa como la seroterapia son específicas del tipo de serpiente; el veneno con acción fisiológica idéntica no produce neutralización cruzada. Boulenger 1913 describe los siguientes casos:
Un europeo en Australia que se había vuelto inmune al veneno de la mortal serpiente tigre australiana ( Notechis scutatus ), manipulando estas serpientes con impunidad y estaba bajo la impresión de que su inmunidad se extendía también a otras especies, cuando fue mordido por una cabeza de cobre de las tierras bajas ( Austrelaps superbus ), un elapino emparentado, murió al día siguiente.
En la India , se ha descubierto que el suero preparado con el veneno de la cobra monócula Naja kaouthia no tiene efecto sobre el veneno de dos especies de kraits ( Bungarus ), la víbora de Russell ( Daboia russelli ), la víbora de escamas de sierra ( Echis carinatus ) y la víbora de foseta de Pope ( Trimeresurus popeiorum ). El suero de la víbora de Russell no tiene efecto sobre los venenos de colubrina, ni sobre los de Echis y Trimeresurus .
En Brasil , el suero preparado con veneno de Bothrops spp. no tiene acción sobre el veneno de la serpiente de cascabel ( Crotalus spp.).
El tratamiento antiveneno de las mordeduras de serpiente debe ser acorde al tipo de envenenamiento que se ha producido. En América, existen antivenenos polivalentes que son eficaces contra las mordeduras de la mayoría de las víboras de foseta. Crofab es el antiveneno desarrollado para tratar la mordedura de las víboras de foseta de América del Norte. [60] Estos no son eficaces contra el envenenamiento por serpiente coral , que requiere un antiveneno específico para su veneno neurotóxico. La situación es aún más compleja en países como la India, con su rica mezcla de víboras (Viperidae) y cobras y kraits altamente neurotóxicas de la familia Elapidae.
Notas
- ^ Esta sección se basa en el libro de 1913 The Snakes of Europe , de GA Boulenger, que ahora es de dominio público en los Estados Unidos (y posiblemente en otros lugares). Debido a su antigüedad, el texto de este artículo no debe verse necesariamente como un reflejo del conocimiento actual sobre el veneno de serpiente.
Véase también
Referencias
- ^ "Investigación sobre veneno de reptiles". Australian Reptile Park. Archivado desde el original el 2 de febrero de 2010. Consultado el 21 de diciembre de 2010 .
- ^ abcdef Bauchot R (1994). Serpientes: una historia natural . Nueva York, NY, EE. UU.: Sterling Publishing Co., Inc., págs. 194-209. ISBN 978-1-4027-3181-5.
- ^ abc Halliday A, Kraig T, eds. (2002). Enciclopedia Firefly de reptiles y anfibios . Toronto, Canadá: Firefly Books Ltd., págs. 202-203. ISBN 978-1-55297-613-5.
- ^ ab Bottrall JL, Madaras F, Biven CD, Venning MG, Mirtschin PJ (septiembre de 2010). "Actividad proteolítica de los venenos de serpientes elápidas y víboras y su implicación en la digestión". Journal of Venom Research . 1 (3): 18–28. PMC 3086185 . PMID 21544178.
- ^ abcd Oliveira, Ana L.; Viegas, Matilde F.; da Silva, Saulo L.; Soares, Andreimar M.; Ramos, María J.; Fernandes, Pedro A. (julio de 2022). "La química del veneno de serpiente y su potencial medicinal". Naturaleza Reseñas Química . 6 (7): 451–469. doi :10.1038/s41570-022-00393-7. ISSN 2397-3358. PMC 9185726 . PMID 35702592.
- ^ Mattison C (2007). The New Encyclopedia of Snakes . Nueva Jersey, EE. UU. (publicado por primera vez en el Reino Unido): Princeton University Press (Princeton y Oxford) publicado por primera vez en Blandford. pág. 117. ISBN 978-0-691-13295-2.
- ^ Cardoso KC, Da Silva MJ, Costa GG, Torres TT, Del Bem LE, Vidal RO, et al. (octubre de 2010). "Un análisis transcriptómico de la expresión génica en la glándula venenosa de la serpiente Bothrops alternatus (urutu)". BMC Genomics . 11 (1): 605. doi : 10.1186/1471-2164-11-605 . PMC 3017861 . PMID 20977763.
- ^ Condrea E, Devries A, Mager J (febrero de 1964). "Hemólisis y división de fosfolípidos de eritrocitos humanos por venenos de serpiente". Biochimica et Biophysica Acta (BBA) - Sección especializada en lípidos y temas relacionados . 84 (1): 60–73. doi :10.1016/0926-6542(64)90101-5. PMID 14124757.

- ^ Rodríguez-Ithurralde D, Silveira R, Barbeito L, Dajas F (1983). "Fasciculina, un potente polipéptido anticolinesterasa del veneno de Dendroaspis angusticeps". Neuroquímica Internacional . 5 (3): 267–74. doi :10.1016/0197-0186(83)90028-1. PMID 20487949. S2CID 8952817.

- ^ Mackessy, Stephen P. (1 de mayo de 2021). Mackessy, Stephen P. (ed.). Manual de venenos y toxinas de reptiles (2.ª ed.). Segunda edición. | Boca Raton : CRC Press, 2021.: CRC Press. doi :10.1201/9780429054204. ISBN 978-0-429-05420-4.
{{cite book}}: Mantenimiento de CS1: ubicación ( enlace ) - ^ ab «Palabra clave: Toxina hemorrágica KW-1200». UniProt . Consultado el 1 de junio de 2019 .
- ^ Hodgson WC, Wickramaratna JC (septiembre de 2002). "Actividad neuromuscular in vitro de venenos de serpiente". Farmacología y fisiología clínica y experimental . 29 (9): 807–14. doi : 10.1046/j.1440-1681.2002.03740.x . PMID 12165047. S2CID 20158638.

- ^ He YY, Lee WH, Zhang Y (septiembre de 2004). "Clonación y purificación de alfa-neurotoxinas de la cobra real (Ophiophagus hannah)". Toxicon . 44 (3): 295–303. doi :10.1016/j.toxicon.2004.06.003. PMID 15302536.

- ^ Bernardoni JL, Sousa LF, Wermelinger LS, Lopes AS, Prezoto BC, Serrano SM, Zingali RB, Moura-da-Silva AM (14 de octubre de 2014). "Variabilidad funcional de las metaloproteinasas del veneno de serpiente: ventajas adaptativas en la selección de presas diferentes e implicaciones para el envenenamiento humano". PLOS ONE . 9 (10): e109651. Bibcode :2014PLoSO...9j9651B. doi : 10.1371/journal.pone.0109651 . PMC 4196926 . PMID 25313513.
- ^ Hermans C, Wittevrongel C, Thys C, Smethurst PA, Van Geet C, Freson K (agosto de 2009). "Una mutación heterocigótica compuesta en la glicoproteína VI en un paciente con un trastorno hemorrágico". Journal of Thrombosis and Haemostasis . 7 (8): 1356–63. doi : 10.1111/j.1538-7836.2009.03520.x . PMID 19552682. S2CID 205728095.

- ^ Griffin PR, Aird SD (noviembre de 1990). "Una nueva miotoxina pequeña del veneno de la serpiente de cascabel de la pradera (Crotalus viridis viridis)". FEBS Letters . 274 (1–2): 43–47. doi : 10.1016/0014-5793(90)81325-I . PMID 2253781. S2CID 45019479.
- ^ Samejima Y, Aoki Y, Mebs D (1991). "Secuencia de aminoácidos de una miotoxina del veneno de la serpiente de cascabel de espalda de diamante del este (Crotalus adamanteus)". Toxicon . 29 (4–5): 461–468. doi :10.1016/0041-0101(91)90020-r. PMID 1862521.
- ^ Whittington CM, Papenfuss AT, Bansal P, Torres AM, Wong ES, Deakin JE, et al. (junio de 2008). "Defensinas y la evolución convergente de los genes del veneno del ornitorrinco y de los reptiles". Genome Research . 18 (6): 986–994. doi :10.1101/gr.7149808. PMC 2413166 . PMID 18463304.
- ^ Broad AJ, Sutherland SK, Coulter AR (17 de mayo de 1979). "La letalidad en ratones del peligroso veneno de serpientes australianas y de otras especies" (PDF) . Toxicon . 17 (6): 661–4. doi :10.1016/0041-0101(79)90245-9. PMID 524395.
- ^ Rosen FS (31 de julio de 2003). "Edwin J. Cohn y el desarrollo de la química de proteínas". The New England Journal of Medicine . 349 (5): 511–512. doi :10.1056/NEJM200307313490522.
- ^ abcd Matejtschuk P, Dash CH, Gascoigne EW (diciembre de 2000). "Producción de solución de albúmina humana: un coloide en continuo desarrollo". British Journal of Anaesthesia . 85 (6): 887–95. doi : 10.1093/bja/85.6.887 . PMID 11732525.
- ^ Brodniewicz-Proba T (diciembre de 1991). "Fraccionamiento de plasma humano y el impacto de las nuevas tecnologías en el uso y la calidad de los productos derivados del plasma". Blood Reviews . 5 (4): 245–57. doi :10.1016/0268-960x(91)90016-6. PMID 1782484.
- ^ abcdefg Fry BG, Casewell NR, Wüster W, Vidal N, Young B, Jackson TN (septiembre de 2012). "La diversificación estructural y funcional del sistema de veneno de reptiles Toxicofera". Toxicon . 60 (4): 434–48. doi :10.1016/j.toxicon.2012.02.013. PMID 22446061.
- ^ abcd Casewell NR, Wüster W, Vonk FJ, Harrison RA, Fry BG (abril de 2013). "Cócteles complejos: la novedad evolutiva de los venenos". Tendencias en ecología y evolución . 28 (4): 219–29. doi :10.1016/j.tree.2012.10.020. PMID 23219381.
- ^ Lomonte B, Fernández J, Sanz L, Angulo Y, Sasa M, Gutiérrez JM, Calvete JJ (junio de 2014). "Serpientes venenosas de Costa Rica: implicaciones biológicas y médicas de los perfiles proteómicos de sus venenos analizados a través de la estrategia de la venenosidad de serpientes". Journal of Proteomics . 105 : 323–39. doi :10.1016/j.jprot.2014.02.020. PMID 24576642.
- ^ Hargreaves, Adam D.; Swain, Martin T.; Hegarty, Matthew J.; Logan, Darren W.; Mulley, John F. (agosto de 2014). "Restricción y reclutamiento: duplicación genética y origen y evolución de las toxinas del veneno de serpiente". Genome Biology and Evolution . 6 (8): 2088–2095. doi :10.1093/gbe/evu166. ISSN 1759-6653. PMC 4231632 . PMID 25079342.
- ^ Lynch VJ (enero de 2007). "Inventar un arsenal: evolución adaptativa y neofuncionalización de los genes de la fosfolipasa A2 del veneno de serpiente". BMC Evolutionary Biology . 7 (2): 2. doi : 10.1186/1471-2148-7-2 . PMC 1783844 . PMID 17233905.

- ^ Barlow A, Pook CE, Harrison RA, Wüster W (julio de 2009). "La coevolución de la dieta y la actividad del veneno específico de la presa respalda el papel de la selección en la evolución del veneno de serpiente". Actas. Ciencias biológicas . 276 (1666): 2443–2449. doi :10.1098/rspb.2009.0048. PMC 2690460. PMID 19364745 .
- ^ Pahari S, Bickford D, Fry BG, Kini RM (septiembre de 2007). "Patrón de expresión de los genes de la toxina de tres dedos y de la fosfolipasa A2 en las glándulas venenosas de dos serpientes marinas, Lapemis curtus y Acalyptophis peronii: comparación de la evolución de estas toxinas en serpientes terrestres, serpientes marinas y serpientes marinas". BMC Evolutionary Biology . 7 : 175. doi : 10.1186/1471-2148-7-175 . PMC 2174459 . PMID 17900344.

- ^ ab Barlow A, Pook CE, Harrison RA, Wüster W (julio de 2009). "La coevolución de la dieta y la actividad del veneno específico de la presa respalda el papel de la selección en la evolución del veneno de serpiente". Actas: Ciencias Biológicas . 276 (1666): 2443–9. doi :10.1098/rspb.2009.0048. JSTOR 30244073. PMC 2690460. PMID 19364745 .

- ^ Jansa SA, Voss RS (22 de junio de 2011). "Evolución adaptativa de la proteína vWF dirigida al veneno en zarigüeyas que se alimentan de víboras de foseta". PLOS ONE . 6 (6): e20997. Bibcode :2011PLoSO...620997J. doi : 10.1371/journal.pone.0020997 . PMC 3120824 . PMID 21731638.
- ^ Calvete JJ, Ghezellou P, Paiva O, Matainaho T, Ghassempour A, Goudarzi H, Kraus F, Sanz L, Williams DJ (julio de 2012). "Venómica de serpientes de dos Hydrophiinae poco conocidas: proteómica comparativa de los venenos de Toxicocalamus longissimus terrestre y Hydrophis cyanocinctus marino". Journal of Proteomics . 75 (13): 4091–101. doi :10.1016/j.jprot.2012.05.026. PMID 22643073.
- ^ Li M, Fry BG, Kini RM (enero de 2005). "Dieta basada únicamente en huevos: sus implicaciones para los cambios en el perfil de toxinas y la ecología de la serpiente marina jaspeada (Aipysurus eydouxii)". Journal of Molecular Evolution . 60 (1): 81–9. Bibcode :2005JMolE..60...81L. doi :10.1007/s00239-004-0138-0. PMID 15696370. S2CID 17572816.
- ^ Mackessy SP (julio de 2010). "Tendencias evolutivas en la composición del veneno de las serpientes de cascabel occidentales (Crotalus viridis sensu lato): toxicidad frente a ablandadores". Toxicon . 55 (8): 1463–74. doi :10.1016/j.toxicon.2010.02.028. PMID 20227433.
- ^ Saviola AJ, Chiszar D, Busch C, Mackessy SP (marzo de 2013). "Base molecular para la reubicación de presas en serpientes vipéridas". BMC Biology . 11 (1): 20. doi : 10.1186/1741-7007-11-20 . PMC 3635877 . PMID 23452837.
- ^ Youngman, Nicholas J; Llinas, Joshua; Haworth, Mark; Gillett, Amber; Jones, Lee; Walker, Andrew A; Fry, Bryan G (junio de 2022). "Descifrando las interacciones entre las víboras Bitis y sus presas utilizando la coagulotoxicidad contra diversos plasmas de vertebrados". Toxicon . 216 : 37–44. doi :10.1016/j.toxicon.2022.06.012. ISSN 1879-3150. PMID 35780972. S2CID 250188352.
- ^ Davies, Emma-Louise; Arbuckle, Kevin (diciembre de 2019). "Coevolución de las actividades tóxicas del veneno de serpiente y la dieta: evidencia de que el generalismo ecológico favorece la diversidad toxicológica". Toxins . 11 (12): 711. doi : 10.3390/toxins11120711 . ISSN 2072-6651. PMC 6950196 . PMID 31817769.
- ^ McCue MD (octubre de 2007). "El envenenamiento por presas no mejora el rendimiento digestivo en las serpientes de cascabel de espalda de diamante occidentales (Crotalus atrox)". Journal of Experimental Zoology Part A . 307 (10): 568–77. doi :10.1002/jez.411. PMID 17671964.

- ^ Broeckhoven C, du Plessis A (agosto de 2017). "¿La evolución de los colmillos de serpiente ha perdido su poder de morder? Nuevos conocimientos desde el punto de vista de la mecánica estructural". Biology Letters . 13 (8): 20170293. doi :10.1098/rsbl.2017.0293. PMC 5582107 . PMID 28768797.
- ^ Cleuren SG, Hocking DP, Evans AR (junio de 2021). "Evolución de los colmillos en serpientes venenosas: adaptación de la forma tridimensional de los dientes a las propiedades biomecánicas de sus presas". Evolución; Revista internacional de evolución orgánica . 75 (6): 1377–1394. doi :10.1111/evo.14239. PMID 33904594. S2CID 233411378.
- ^ Martin CJ, Lamb G (1907). "Veneno de serpiente y mordedura de serpiente". En Allbutt TC, Rolleston ND (eds.). Un sistema de medicina . Londres: MacMillan. págs. 783–821.
- ^ McCleary RJ, Kini RM (febrero de 2013). "Proteínas no enzimáticas de venenos de serpiente: una mina de oro de herramientas farmacológicas y pistas sobre fármacos". Toxicon . 62 : 56–74. doi :10.1016/j.toxicon.2012.09.008. PMID 23058997.
- ^ Zouari-Kessentini R, Srairi-Abid N, Bazaa A, El Ayeb M, Luis J, Marrakchi N (2013). "El potencial antitumoral de los venenos de serpientes tunecinos secreta fosfolipasas A2". Investigación BioMed Internacional . 2013 : 1–9. doi : 10.1155/2013/391389 . PMC 3581298 . PMID 23509718.
- ^ Vyas VK, Brahmbhatt K, Bhatt H, Parmar U (febrero de 2013). "Potencial terapéutico del veneno de serpiente en la terapia del cáncer: perspectivas actuales". Revista de biomedicina tropical del Pacífico asiático . 3 (2): 156–62. doi :10.1016/S2221-1691(13)60042-8. PMC 3627178 . PMID 23593597.
- ^ Jain D, Kumar S (2012). "Veneno de serpiente: un potente agente anticancerígeno". Revista asiática del Pacífico para la prevención del cáncer . 13 (10): 4855–60. doi : 10.7314/apjcp.2012.13.10.4855 . PMID: 23244070.
- ^ de Oliveira Junior NG, e Silva Cardoso MH, Franco OL (diciembre de 2013). "Venenos de serpiente: compuestos proteínicos antimicrobianos atractivos para fines terapéuticos". Ciencias de la vida celular y molecular . 70 (24): 4645–58. doi :10.1007/s00018-013-1345-x. PMC 11113393 . PMID 23657358. S2CID 15127065.
- ^ Woolf CJ (enero de 2013). «Dolor: morfina, metabolitos, mambas y mutaciones». The Lancet. Neurología . 12 (1): 18–20. doi :10.1016/S1474-4422(12)70287-9. PMID 23237896. S2CID 8697382.
- ^ Osipov A, Utkin Y (diciembre de 2012). "Efectos de los polipéptidos del veneno de serpiente en el sistema nervioso central". Agentes del sistema nervioso central en química medicinal . 12 (4): 315–28. doi :10.2174/187152412803760618. PMID 23270323. S2CID 36274766.
- ^ "Absceso estéril en la cola de una Naja annulifera: caso de autoenvenenamiento". Archivado desde el original el 27 de octubre de 2004. Consultado el 2 de abril de 2009 .
- ^ Drabeck D, Jansa S (2015). "Por qué al tejón de miel no le importa: evolución independiente de la resistencia a las toxinas de tres dedos en el receptor nicotínico de acetilcolina". Toxicon . 99 : 68–72. doi :10.1016/j.toxicon.2015.03.007. PMID 25796346.
- ^ Grasset E, Zoutendykanda A, Schaafsma A (1935). "Estudios sobre las propiedades tóxicas y antigénicas de los venenos de serpientes de África meridional con especial referencia a la polivalencia del antiveneno sudafricano". Trans. R. Soc. Trop. Med. Hygiene . 28 (6): 601–612. doi :10.1016/S0035-9203(35)90031-1.
- ^ "Adiós a estos famosos floridanos". Florida Trend . 19 de diciembre de 2011 . Consultado el 2 de abril de 2012 .
- ^ Rosenberg C (21 de junio de 2011). "Bill Haast muere a los 100 años; las serpientes eran el amuleto de las celebridades del sur de Florida". Los Angeles Times . Consultado el 16 de octubre de 2012 .
- ^ Schudel M (18 de junio de 2011). "Bill Haast muere a los 100 años: un hombre serpiente de Florida proporcionó veneno para el suero contra las mordeduras de serpiente". The Washington Post . Consultado el 16 de octubre de 2012 .
- ^ "Un hombre hace que serpientes letales lo muerdan 160 veces en su búsqueda de un antídoto humano | América | Noticias | The Independent". Independent.co.uk . 21 de enero de 2016 . Consultado el 7 de julio de 2016 .
- ^ Hiremath VT, Taranath TC (febrero de 2010). "Fitoterapia tradicional para mordeduras de serpientes en tribus del distrito de Chitradurga, Karnataka, India". Folletos etnobotánicos . 14 (2): 120–125.
- ^ Zethelius M, Balick MJ (marzo de 1982). "Medicina moderna y ritual chamánico: un caso de respuesta sinérgica positiva en el tratamiento de una mordedura de serpiente" (PDF) . Revista de Etnofarmacología . 5 (2): 181–5. doi :10.1016/0378-8741(82)90042-3. PMID 7057657.

- ^ "Tratamiento de las mordeduras de serpiente". Ces.ncsu.edu . Consultado el 16 de octubre de 2012 .
- ^ "CDC - Serpientes venenosas - Tema de seguridad y salud en el trabajo de NIOSH". CDC.gov. 1 de julio de 2016. Consultado el 7 de julio de 2016 .
- ^ http://www.savagelabs.com/Products/CroFab/Home/crofab_frame.htm Archivado el 3 de marzo de 2016 en Wayback Machine Enlace al PDF con información de prescripción completa, consultado el 12/11/12
Lectura adicional
- Jonassen I, Collins JF, Higgins DG (agosto de 1995). "Encontrar patrones flexibles en secuencias de proteínas no alineadas". Protein Science . 4 (8): 1587–95. doi :10.1002/pro.5560040817. PMC 2143188 . PMID 8520485.
- Shaw IC (2007). "Capítulo 19: Toxinas de serpiente". En Waring RH, Steventon GB, Mitchell SC (eds.). Moléculas de la muerte (segunda edición). River Edge, NJ: Imperial College Press. págs. 329–344. ISBN 978-1-86094-815-2.
Enlaces externos
- Una descripción general de la diversidad y evolución de los colmillos de serpiente.
- Venenos de serpiente UMich Orientación de proteínas en membranas familias/superfamilia-55 - Orientaciones calculadas de las fosfolipasas A2 del veneno de serpiente y miotoxinas en la bicapa lipídica.
- LD50 para la mayoría de los venenos tóxicos.
- Unidad Australiana de Investigación sobre Veneno: una fuente general de información sobre criaturas venenosas en Australia.
- biomedcentral.com - Remedios medicinales y etnoveterinarios de los cazadores en Trinidad .
- reptilis.net - Cómo funciona el veneno.
- snakevenom.net - Secado y almacenamiento de veneno de serpiente.