Interpretación del espectro de masas
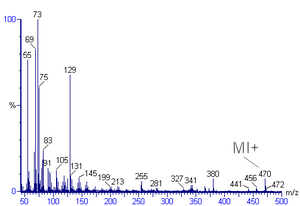
La interpretación de los espectros de masas es el método empleado para identificar la fórmula química, los patrones característicos de los fragmentos y los posibles iones de los fragmentos a partir de los espectros de masas. [1] [2] Los espectros de masas son un gráfico de la abundancia relativa frente a la relación masa-carga. Se utiliza comúnmente para la identificación de compuestos orgánicos a partir de la espectrometría de masas de ionización electrónica . [3] [4] Los químicos orgánicos obtienen espectros de masas de compuestos químicos como parte de la elucidación de la estructura y el análisis es parte de muchos planes de estudio de química orgánica .
Generación de espectros de masas

La ionización electrónica (EI) es un tipo de fuente de iones de espectrómetro de masas en la que un haz de electrones interactúa con una molécula en fase gaseosa M para formar un ion de acuerdo con
con un ion molecular . [5] El superíndice "+" indica la carga del ion y el superíndice "•" indica un electrón desapareado del ion radical . La energía del haz de electrones es típicamente de 70 electronvoltios y el proceso de ionización típicamente produce una fragmentación extensa de los enlaces químicos de la molécula.
Debido a la alta presión de vacío en la cámara de ionización, el recorrido libre medio de las moléculas varía de 10 cm a 1 km y luego las fragmentaciones son procesos unimoleculares. Una vez que se inicia la fragmentación, el electrón se excita primero desde el sitio con la energía de ionización más baja. Dado que el orden de la energía de los electrones es electrones no enlazantes > electrones de enlace pi > electrones de enlace sigma, el orden de preferencia de ionización es electrones no enlazantes > electrones de enlace pi > electrones de enlace sigma. [6]

El pico del espectro de masas con mayor intensidad se denomina pico base. El pico correspondiente al ion molecular es a menudo, pero no siempre, el pico base. La identificación del ion molecular puede ser difícil. Al examinar compuestos orgánicos, la intensidad relativa del pico del ion molecular disminuye con la ramificación y con el aumento de la masa en una serie homóloga. En el espectro del tolueno , por ejemplo, el pico del ion molecular se encuentra a 92 m/z, lo que corresponde a su masa molecular . Los picos de iones moleculares también suelen estar precedidos por un pico M-1 o M-2 resultante de la pérdida de un radical de hidrógeno o dihidrógeno, respectivamente. Aquí, M se refiere a la masa molecular del compuesto. En el espectro del tolueno, se pierde un radical de hidrógeno (par protón-electrón), lo que forma el pico M-1 (91).
Los picos con una masa menor que la del ion molecular son el resultado de la fragmentación de la molécula. Existen muchas vías de reacción para la fragmentación, pero solo los cationes recién formados aparecerán en el espectro de masas, no los fragmentos radicales ni los fragmentos neutros. Los picos metaestables son picos anchos con baja intensidad en valores de masa no enteros. Estos picos son el resultado de iones con tiempos de vida más cortos que el tiempo necesario para atravesar la distancia entre la cámara de ionización y el detector.
Determinación de la fórmula molecular
Regla del nitrógeno
La regla del nitrógeno establece que las moléculas orgánicas que contienen hidrógeno , carbono , nitrógeno , oxígeno , silicio , fósforo , azufre o halógenos tienen una masa nominal impar si tienen un número impar de átomos de nitrógeno o una masa par si tienen un número par de átomos de nitrógeno presentes. [7] [8] La regla del nitrógeno es válida para las estructuras en las que todos los átomos de la molécula tienen un número de enlaces covalentes igual a su valencia estándar, contando cada enlace sigma y cada enlace pi como un enlace covalente separado.
Los anillos mandan
A partir de los principios del grado de insaturación, las moléculas que contienen solo carbono, hidrógeno, halógenos, nitrógeno y oxígeno siguen la fórmula
donde C es el número de carbonos, H es el número de hidrógenos, X es el número de halógenos y N es el número de nitrógeno.
Regla del electrón par
La regla del electrón par establece que los iones con un número par de electrones (cationes pero no iones radicales) tienden a formar iones de fragmentos de electrones pares y los iones de electrones impares (iones radicales) forman iones de electrones impares o iones de electrones pares. [9] Las especies de electrones pares tienden a fragmentarse en otro catión de electrones pares y una molécula neutra en lugar de dos especies de electrones impares.
Reglas de Stevenson
Cuanto más estable sea el catión del producto, más abundante será el proceso de descomposición correspondiente. Se pueden utilizar varias teorías para predecir el proceso de fragmentación, como la regla del octeto electrónico, la estabilización por resonancia y la hiperconjugación, entre otras. [6]
Regla del 13
La regla de 13 es un procedimiento simple para tabular la posible fórmula química para una masa molecular dada. [10] El primer paso para aplicar la regla es suponer que solo el carbono y el hidrógeno están presentes en la molécula y que la molécula comprende una cierta cantidad de "unidades" de CH, cada una de las cuales tiene una masa nominal de 13. Si el peso molecular de la molécula en cuestión es M , la cantidad de posibles unidades de CH es n y
donde r es el resto. La fórmula base de la molécula es
y el grado de insaturación es
Un valor negativo de u indica la presencia de heteroátomos en la molécula y un valor de u semientero indica la presencia de un número impar de átomos de nitrógeno. Al añadir heteroátomos, la fórmula molecular se ajusta según la masa equivalente de carbono e hidrógeno. Por ejemplo, añadir N requiere eliminar CH 2 y añadir O requiere eliminar CH 4 .
Efectos isotópicos
Los picos isotópicos dentro de un espectro pueden ayudar a dilucidar la estructura. Los compuestos que contienen halógenos (especialmente cloro y bromo ) pueden producir picos isotópicos muy distintos. El espectro de masas del bromuro de metilo tiene dos picos prominentes de igual intensidad en m/z 94 (M) y 96 (M+2) y luego dos más en 79 y 81 que pertenecen al fragmento de bromo.
Incluso cuando los compuestos contienen únicamente elementos con picos isotópicos menos intensos ( carbono u oxígeno ), la distribución de estos picos puede utilizarse para asignar el espectro al compuesto correcto. Por ejemplo, dos compuestos con masa idéntica de 150 Da, C 8 H 12 N 3 + y C 9 H 10 O 2 + , tendrán dos intensidades M+2 diferentes, lo que permite distinguirlos.
Fragmentación
El patrón de fragmentación de los espectros, además de la determinación del peso molar de un compuesto desconocido, también es adecuado para proporcionar información estructural, especialmente en combinación con el cálculo del grado de insaturación a partir de la fórmula molecular (cuando esté disponible). Los fragmentos neutros que se pierden con frecuencia son el monóxido de carbono , el etileno , el agua , el amoniaco y el sulfuro de hidrógeno . Existen varios procesos de fragmentación, como se indica a continuación.
α - escisión
La fragmentación surge de un proceso de homólisis . Esta escisión resulta de la tendencia del electrón desapareado del sitio radical a aparearse con un electrón de otro enlace a un átomo adyacente al sitio de carga, como se ilustra a continuación. [7] Esta reacción se define como una escisión homolítica ya que solo se transfiere un único electrón. Las fuerzas impulsoras de dicha reacción son las capacidades de donación de electrones de los sitios radicales: N > S, O,π > Cl, Br > H. [11] Un ejemplo es la escisión de enlaces carbono-carbono junto a un heteroátomo . En esta representación, los movimientos de un solo electrón se indican mediante una flecha de una sola punta .

Escisión del enlace sigma
La ionización de los alcanos debilita el enlace CC, lo que finalmente da lugar a la descomposición. [7] A medida que se rompe el enlace, se genera una especie de electrón uniforme y cargado (R+) y una especie de radical neutro (R•). Los carbocationes altamente sustituidos son más estables que los no sustituidos. A continuación se muestra un ejemplo.

Escisión inductiva
Esta reacción resulta del efecto inductivo de los sitios radicales, como se muestra a continuación. Esta reacción se define como una escisión heterolítica, ya que se transfiere un par de electrones. [11] Las fuerzas impulsoras de dicha reacción son las electronegatividades de los sitios radicales: halógenos > O, S >> N, C. Esta reacción es menos favorecida que las reacciones en sitios radicales. [11]

Reordenamiento de McLafferty
El reordenamiento de McLafferty puede ocurrir en una molécula que contiene un grupo ceto e implica una escisión β, con la ganancia del átomo de hidrógeno γ. [12] [13] [14] La formación de complejos iónicos neutros implica homólisis de enlace o heterólisis de enlace, en la que los fragmentos no tienen suficiente energía cinética para separarse y, en cambio, reaccionan entre sí como una reacción ion-molécula.
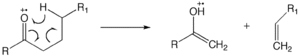
Reordenamiento del hidrógeno a un heteroátomo saturado
El desplazamiento de hidrógeno “1,5 ” provoca la transferencia de un hidrógeno γ a un sitio radical en un heteroátomo saturado. Los mismos requisitos para la transposición de McLafferty se aplican a la transposición de hidrógeno a un heteroátomo saturado. Dicha transposición inicia la reacción en el sitio de carga, lo que da como resultado la formación de un ion de electrón impar y una pequeña molécula neutra (agua o ácido, etc.). Para los alcoholes, esta escisión heterolítica libera una molécula de agua. Dado que las reacciones en el sitio de carga son dominantes en los alcoholes menos voluminosos, esta reacción se favorece para los alcoholes como primario > secundario > terciario. [11]
Reordenamiento de doble hidrógeno
El desplazamiento de hidrógeno “1,5” provoca la transferencia de dos hidrógenos γ a dos sitios radicales en dos átomos insaturados diferentes. Los mismos requisitos para la transposición de McLafferty se aplican a la transposición de doble hidrógeno. Esta reacción se observa para tres grupos funcionales insaturados, a saber, tioésteres, ésteres y amidas. [15]
Reordenamiento orto
El desplazamiento de hidrógeno “1,5 ” provoca la transferencia de dos hidrógenos γ a dos sitios radicales en dos átomos insaturados diferentes. Los mismos requisitos para el desplazamiento de hidrógeno “1,5 ” ocurren entre sustituyentes adecuados en las posiciones orto de los anillos aromáticos. Los mismos requisitos para el reordenamiento de McLafferty se aplican al reordenamiento orto, excepto para el fuerte doble enlace carbono-carbono α,β. Tal reordenamiento inicia la reacción de sitio de carga, lo que resulta en la formación de un ion de electrón impar y una pequeña molécula neutra (agua o HCl, etc.). Esta reacción se puede utilizar para diferenciar los isómeros orto de los para y meta. El reordenamiento de McLafferty se aplica al reordenamiento de doble hidrógeno. Esta reacción se observa para tres grupos funcionales insaturados, a saber, tioésteres, ésteres y amidas. [11]

Reacción retro-Diels-Alder
Esta reacción ocurre principalmente en el ciclohexeno y sus derivados. Al ionizarse, los electrones pi se excitan y generan un sitio de carga y un sitio radical. A continuación, dos escisiones α sucesivas dan lugar a un radical butadieno y a un eteno neutro, ya que el eteno tiene una energía de ionización mayor que el butadieno (reglas de Stevenson). [11]

Reacción de cicloeliminación
Esta reacción ocurre principalmente en moléculas cíclicas de cuatro miembros. Una vez ionizada, produce un ion distónico y luego se fragmenta para dar lugar a un ion radical eteno y una molécula de eteno neutra. [11]
Patrones de fragmentación de clases de compuestos específicos
Alcanos
En el caso de los alcanos lineales, se observan a menudo picos de iones moleculares. Sin embargo, en el caso de los compuestos de cadena larga, la intensidad de los picos de iones moleculares suele ser débil. Los fragmentos lineales suelen diferir en 14 Da (CH2 = 14). Por ejemplo, los patrones de fragmentación del hexano. El catión butilo m/z=57 es el pico base, y otros picos más abundantes en el espectro son los carbocationes de alquilo en m/z=15, 29, 43 Da. [6] [2] [11]

Los alcanos ramificados tienen picos de iones moleculares algo más débiles en los espectros. Tienden a fragmentarse en el punto ramificado. En el caso del 2,3-dimetilbutano, un pico de catión isopropilo (m/z=43) es muy fuerte. [6] [2] [11]

Los cicloalcanos tienen picos de iones moleculares relativamente intensos (deben romperse dos enlaces). Los picos de fragmentación de alquenos suelen ser el modo más significativo. La pérdida de “CH 2 CH 2 “ (= 28) es común, si está presente. Sin embargo, en el caso de los cicloalcanos sustituidos, prefieren formar los cationes cicloalquilo por escisión en los puntos ramificados. [11]

Alquenos
Los alquenos suelen producir picos de iones moleculares más fuertes que los alcanos debido a que la energía de ionización de un electrón pi es menor que la de un electrón σ. Después de la ionización, los enlaces dobles pueden migrar fácilmente, lo que hace que la determinación de isómeros sea casi imposible. La escisión alílica es el modo de fragmentación más importante debido a la estabilización por resonancia. [11]

Son posibles reordenamientos de tipo McLafferty (similares a los enlaces pi del carbonilo). Nuevamente, es posible la migración de enlaces. [11]

Los ciclohexenos a menudo experimentan reacciones retro-Diels-Alder.
Alquinos
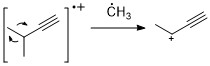
Al igual que los alquenos, los alquinos suelen mostrar picos de iones moleculares fuertes. La escisión propargílica es el modo de fragmentación más importante. [11]
Hidrocarburos aromáticos
Los hidrocarburos aromáticos muestran un pico de ion molecular distintivo. La escisión bencílica es bastante común. Cuando los grupos alquilo están unidos al anillo, un modo favorable de escisión es perder un radical H para formar el catión tropilio (m/z 91). [2] [11]
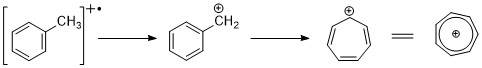
Los bencenos sustituidos con alquilo pueden fragmentarse a través del proceso cinético controlado para formar iones C 6 H 5 + , C 6 H 6 + . [11]

Otro modo común de fragmentación es el reordenamiento de McLafferty, que requiere que la longitud de la cadena alquílica sea al menos mayor a 3 carbonos. [11]

Alcoholes
Los alcoholes generalmente tienen picos de iones moleculares débiles debido a la fuerte electronegatividad del oxígeno. La escisión “alfa” es común debido a la estabilización por resonancia. Se perderá el grupo alquilo más grande. [2]

Otro modo de fragmentación común es la deshidratación (M-18). Para alcoholes de cadena más larga, una transposición de tipo McLafferty puede producir agua y etileno (M-46).

Los alcoholes cíclicos tienden a mostrar picos M+ más fuertes que las cadenas lineales y siguen vías de fragmentación similares: escisión alfa y deshidratación. [11]
Fenol
El fenol presenta un pico de iones moleculares fuerte. Se observa pérdida de H· (M – 1), CO (M – 28) y es común observar el radical formilo (HCO·, M – 29). [2] [11]

Éter
Los éteres producen picos de iones moleculares ligeramente más intensos en comparación con los alcoholes o alcanos correspondientes. Existen dos modos de escisión comunes: la escisión α y la escisión del enlace CO.

Los éteres aromáticos pueden generar el ion C6H5O+ por pérdida del grupo alquilo en lugar de H; esto puede expulsar CO como en la degradación fenólica. [11]

Compuestos carbonílicos
Existen cinco tipos de compuestos carbonílicos, entre los que se incluyen aldehídos, cetonas, ácidos carboxílicos y ésteres. [2] Los principales modos de fragmentación se describen a continuación:
La escisión alfa puede ocurrir en cualquier lado del grupo funcional carbonilo, ya que un par solitario de oxígeno puede estabilizar la carga positiva.

La escisión β es un modo característico de fragmentación de compuestos carbonílicos debido a la estabilización por resonancia.

Para compuestos carbonílicos de cadena más larga (el número de carbonos es mayor que 4), los reordenamientos de McLafferty son dominantes.

De acuerdo con estos patrones de fragmentación, los picos característicos de los compuestos carbonílicos se resumen en la siguiente tabla.
| Fragmentación | Camino | m/z del ion observado | ||||
|---|---|---|---|---|---|---|
| Aldehídos G = H | Cetonas G= CH3 | Ésteres G= OCH3 | Ácidos G = OH | Amidas G = NH2 | ||
| Escisión alfa | Pérdida del radical R | 29 | 43 | 59 | 45 | 44 |
| Escisión alfa | Pérdida del radical G | M-1 | M-15 | M-59 | M-45 | M-44 |
| Escisión beta | M-43 | M-57 | M-73 | M-59 | M-58 | |
| Reordenamiento de McLafferty | 44 | 58 | 74 | 60 | 59 | |
En el caso de los compuestos carbonílicos aromáticos, las escisiones alfa son favorables principalmente para perder G· (M – 1,15, 29…) para formar el ion C6H5CO+ (m/z=105), que puede perder además CO (m/z= 77) y HCCH (m/z=51). [6]

Aminas
Las aminas siguen la regla del nitrógeno. La relación masa-carga de iones moleculares impares sugiere la existencia de un número impar de nitrógenos. No obstante, los picos de iones moleculares son débiles en las aminas alifáticas debido a la facilidad de fragmentación junto a las aminas. Las reacciones de escisión alfa son el modo de fragmentación más importante para las aminas; para las aminas n-alifáticas 1°, hay un pico intenso en m/z 30. [11] [6]
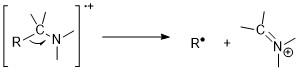
Las aminas aromáticas tienen picos de iones moleculares intensos. En el caso de las anilinas, prefieren perder un átomo de hidrógeno antes de expulsar el HCN.

Nitrilos
El modo de fragmentación principal es la pérdida de un átomo de H (M – 1) del carbono próximo al grupo CN debido a la estabilización por resonancia. La reorganización de McLafferty se puede observar cuando tienen longitudes de cadena más largas. [6]

Compuestos nitro
Los compuestos nitrados alifáticos normalmente presentan picos de iones moleculares débiles, mientras que los compuestos nitrados aromáticos presentan un pico fuerte. El modo de degradación habitual es la pérdida de NO + y NO2 + . [6]

Electrospray y ionización química a presión atmosférica
La ionización química por electrospray y por presión atmosférica tienen diferentes reglas para la interpretación del espectro debido a los diferentes mecanismos de ionización. [16]
Véase también
- Algoritmo de detección de componentes (CODA), un algoritmo utilizado en el análisis de datos de espectrometría de masas
- Lista de software de espectrometría de masas
Referencias
- ^ Terrence A. Lee (4 de febrero de 1998). Guía para principiantes sobre interpretación de espectros de masas. John Wiley & Sons . ISBN 978-0-471-97629-5.
- ^ abcdefg Fred W. McLafferty (1 de enero de 1993). Interpretación de espectros de masas. Libros de ciencias universitarias. ISBN 978-0-935702-25-5.
- ^ Identificación espectrométrica de compuestos orgánicos Silverstein, Bassler, Morrill 4a Ed.
- ^ Espectroscopia orgánica William Kemp 2da. Ed. ISBN 0-333-42171-X
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "ionización electrónica". doi :10.1351/goldbook.E01999
- ^ abcdefgh Pavia, Donald L. Introducción a la espectroscopia . pág. 141. ISBN 1-285-46012-X.
- ^ abc Tureček, František; McLafferty, Fred W. (1993). Interpretación de espectros de masas . Sausalito, California: University Science Books. págs. 37–38. ISBN 0-935702-25-3.
- ^ David O. Sparkman (2007). Referencia de escritorio sobre espectrometría de masas . Pittsburgh: Global View Pub. p. 64. ISBN 0-9660813-9-0.
- ^ Karni, Miriam; Mandelbaum, Asher (1980). "La 'regla del electrón par'". Espectrometría de masas orgánica . 15 (2): 53–64. doi :10.1002/oms.1210150202. ISSN 0030-493X.
- ^ Bright, JW; Chen, ECM (1983). "Interpretación espectral de masas utilizando la "regla del '13'"". Revista de Educación Química . 60 (7): 557. Bibcode :1983JChEd..60..557B. doi :10.1021/ed060p557. ISSN 0021-9584.
- ^ abcdefghijklmnopqrst Dass, Chhabil (2007). Fundamentos de la espectrometría de masas contemporánea . Wiley-interscience. págs. 219–232. ISBN 978-0-471-68229-5.
- ^ FW McLafferty (1959). "Análisis espectrométrico de masas. Reordenamientos moleculares". Anal. Química. 31 (1): 82–87. doi :10.1021/ac60145a015.
- ^ Gross ML (2004). "Focus in honor of Fred McLafferty, distinguido con el premio a la contribución de 2003, por el descubrimiento del "reordenamiento de McLafferty"". J. Am. Soc. Mass Spectrom . 15 (7): 951–5. doi : 10.1016/j.jasms.2004.05.009 . PMID 15234352.
- ^ Nibbering NM (2004). "El reordenamiento de McLafferty: un recuerdo personal". J. Am. Soc. Mass Spectrom . 15 (7): 956–8. doi : 10.1016/j.jasms.2004.04.025 . PMID 15234353.
- ^ Kingston, David G. (1974). "Transferencia intramolecular de hidrógeno en espectros de masas. II. El reordenamiento de McLafferty y reacciones relacionadas". Chemical Reviews . 74 : 216–242. doi :10.1021/cr60288a004.
- ^ Holčapek, Michal; Jirásko, Robert; Lísa, Miroslav (2010). "Reglas básicas para la interpretación de los espectros de masas de ionización a presión atmosférica de moléculas pequeñas". Journal of Chromatography A . 1217 (25): 3908–3921. doi :10.1016/j.chroma.2010.02.049. ISSN 0021-9673. PMID 20303090.





