Sitio intersticial

En cristalografía , los sitios intersticiales , agujeros o huecos son el espacio vacío que existe entre el empaquetamiento de átomos (esferas) en la estructura cristalina . [ cita requerida ]
Los agujeros son fáciles de ver si intentas agrupar círculos ; no importa qué tan cerca los coloques o cómo los organices, tendrás espacio vacío en el medio. Lo mismo sucede en una celda unitaria ; no importa cómo estén organizados los átomos, habrá sitios intersticiales presentes entre los átomos. Estos sitios o agujeros pueden llenarse con otros átomos ( defecto intersticial ). La imagen con círculos empaquetados es solo una representación 2D. En una red cristalina , los átomos (esferas) estarían empaquetados en una disposición 3D . Esto da como resultado sitios intersticiales de diferentes formas según la disposición de los átomos en la red.
Empaquetado compacto
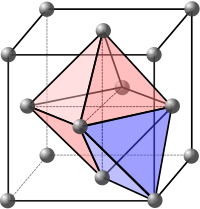
Una celda unitaria compacta, tanto cúbica centrada en las caras como hexagonal, puede formar dos agujeros de formas diferentes. Si observamos las tres esferas verdes en la ilustración de empaquetamiento hexagonal en la parte superior de la página, forman un agujero con forma de triángulo. Si un átomo se coloca encima de este agujero triangular, forma un agujero intersticial tetraédrico. Si los tres átomos de la capa superior se rotan y su agujero triangular se asienta sobre este, se forma un agujero intersticial octaédrico. [ cita requerida ] En una estructura compacta hay 4 átomos por celda unitaria y tendrá 4 huecos octaédricos (relación 1:1) y 8 huecos tetraédricos (relación 1:2) por celda unitaria. [1] El hueco tetraédrico es de menor tamaño y podría caber un átomo con un radio de 0,225 veces el tamaño de los átomos que forman la red. Un hueco octaédrico podría caber un átomo con un radio de 0,414 veces el tamaño de los átomos que forman la red. [1] Un átomo que llena este espacio vacío podría ser más grande que esta relación de radio ideal, lo que conduciría a una red distorsionada debido al empuje de los átomos circundantes, pero no puede ser más pequeño que esta relación. [1]
Cúbica centrada en las caras (FCC)
Si la mitad de los sitios tetraédricos de la red FCC original están ocupados por iones de carga opuesta, la estructura formada es la estructura cristalina de blenda de cinc . Si todos los sitios tetraédricos de la red FCC original están ocupados por iones de carga opuesta, la estructura formada es la estructura de fluorita o estructura de antifluorita. Si todos los sitios octaédricos de la red FCC original están ocupados por iones de carga opuesta, la estructura formada es la estructura de sal de roca .
Empaquetamiento compacto hexagonal (HCP)
Si la mitad de los sitios tetraédricos de la red HCP original están ocupados por iones de carga opuesta, la estructura formada es la estructura cristalina de wurtzita. Si todos los sitios octaédricos de la red HCP del anión están ocupados por cationes, la estructura formada es la estructura de arseniuro de níquel.
Cúbico simple
Una celda unitaria cúbica simple, con pilas de átomos dispuestos como si estuvieran en las ocho esquinas de un cubo, formaría un único agujero cúbico o vacío en el centro. Si estos huecos están ocupados por iones de carga opuesta a la de la red original, se forma la estructura de cloruro de cesio.
Cúbica centrada en el cuerpo (BCC)
Una celda unitaria cúbica centrada en el cuerpo tiene seis huecos octaédricos ubicados en el centro de cada cara de la celda unitaria y doce más ubicados en el punto medio de cada borde de la misma celda, para un total de seis huecos octaédricos netos. Además, hay 24 huecos tetraédricos ubicados en un espacio cuadrado alrededor de cada hueco octaédrico, para un total de doce huecos tetraédricos netos. Estos huecos tetraédricos no son máximos locales y técnicamente no son huecos, pero ocasionalmente aparecen en celdas unitarias de múltiples átomos.
Defecto intersticial
Un defecto intersticial se refiere a átomos adicionales que ocupan algunos sitios intersticiales al azar como defectos cristalográficos en un cristal que normalmente tiene sitios intersticiales vacíos de manera predeterminada.
Referencias
- ^ abc «Estudio de los huecos intersticiales». Archivado desde el original el 4 de agosto de 2020.