Inhibición competitiva
2yo
5OH ) actúa como un inhibidor competitivo del metanol ( CH
3OH ) y etilenglicol ( (CH2OH ) 2 ) para la enzima alcohol deshidrogenasa en el hígado cuando está presente en grandes cantidades. Por esta razón, el etanol se utiliza a veces como un medio para tratar o prevenir la toxicidad tras la ingestión accidental de estos productos químicos.
La inhibición competitiva es la interrupción de una vía química debido a que una sustancia química inhibe el efecto de otra al competir con ella por la unión o el enlace . Cualquier sistema metabólico o de mensajería química puede verse afectado potencialmente por este principio, pero varias clases de inhibición competitiva son especialmente importantes en bioquímica y medicina , incluida la forma competitiva de inhibición enzimática , la forma competitiva de antagonismo de receptores , la forma competitiva de actividad antimetabolitos y la forma competitiva de envenenamiento (que puede incluir cualquiera de los tipos mencionados anteriormente).
Tipo de inhibición enzimática
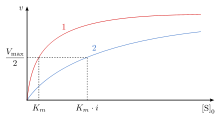
En la inhibición competitiva de la catálisis enzimática , la unión de un inhibidor impide la unión de la molécula diana de la enzima, también conocida como sustrato. [1] Esto se logra bloqueando el sitio de unión del sustrato (el sitio activo) por algún medio. La Vmax indica la velocidad máxima de la reacción, mientras que la Km es la cantidad de sustrato necesaria para alcanzar la mitad de la Vmax . La Km también juega un papel en indicar la tendencia del sustrato a unirse a la enzima. [2] La inhibición competitiva se puede superar añadiendo más sustrato a la reacción, lo que aumenta las posibilidades de unión de la enzima y el sustrato. Como resultado, la inhibición competitiva altera solo la Km , dejando la Vmax igual . [3] Esto se puede demostrar utilizando gráficos de cinética enzimática como el gráfico de Michaelis-Menten o el de Lineweaver-Burk . Una vez que el inhibidor se une a la enzima, la pendiente se verá afectada, ya que la Km aumenta o disminuye con respecto a la Km original de la reacción. [4] [5] [6]
La mayoría de los inhibidores competitivos funcionan uniéndose reversiblemente al sitio activo de la enzima. [1] Como resultado, muchas fuentes afirman que esta es la característica definitoria de los inhibidores competitivos. [7] Sin embargo, esto es una simplificación engañosa , ya que hay muchos mecanismos posibles por los cuales una enzima puede unirse al inhibidor o al sustrato, pero nunca a ambos al mismo tiempo. [1] Por ejemplo, los inhibidores alostéricos pueden mostrar inhibición competitiva, no competitiva o no competitiva . [1]
Mecanismo
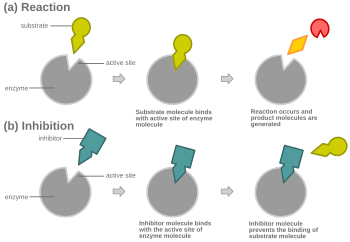
En la inhibición competitiva, un inhibidor que se asemeja al sustrato normal se une a la enzima, generalmente en el sitio activo , y evita que el sustrato se una. [8] En un momento dado, la enzima puede estar unida al inhibidor, al sustrato o a ninguno, pero no puede unirse a ambos al mismo tiempo. Durante la inhibición competitiva, el inhibidor y el sustrato compiten por el sitio activo. El sitio activo es una región de una enzima a la que se puede unir una proteína o sustrato en particular. Por lo tanto, el sitio activo solo permitirá que uno de los dos complejos se una al sitio, ya sea permitiendo que se produzca una reacción o proporcionándola. En la inhibición competitiva, el inhibidor se asemeja al sustrato, ocupando su lugar y uniéndose al sitio activo de una enzima. Aumentar la concentración del sustrato disminuiría la "competencia" para que el sustrato se una adecuadamente al sitio activo y permita que se produzca una reacción. [3] Cuando el sustrato tiene una concentración mayor que la concentración del inhibidor competitivo, es más probable que el sustrato entre en contacto con el sitio activo de la enzima que con el del inhibidor.
Los inhibidores competitivos se utilizan comúnmente para fabricar productos farmacéuticos. [3] Por ejemplo, el metotrexato es un fármaco de quimioterapia que actúa como inhibidor competitivo. Es estructuralmente similar a la coenzima folato , que se une a la enzima dihidrofolato reductasa . [3] Esta enzima es parte de la síntesis de ADN y ARN, y cuando el metotrexato se une a la enzima, la vuelve inactiva, de modo que no puede sintetizar ADN y ARN. [3] Por lo tanto, las células cancerosas no pueden crecer ni dividirse. Otro ejemplo: las prostaglandinas se producen en grandes cantidades como respuesta al dolor y pueden causar inflamación. Los ácidos grasos esenciales forman las prostaglandinas; cuando se descubrió esto, resultó que en realidad eran muy buenos inhibidores de las prostaglandinas. Estos inhibidores de ácidos grasos se han utilizado como medicamentos para aliviar el dolor porque pueden actuar como sustrato, unirse a la enzima y bloquear las prostaglandinas. [9]
Un ejemplo de inhibición competitiva no relacionada con fármacos es la prevención del oscurecimiento de frutas y verduras. Por ejemplo, la tirosinasa , una enzima presente en los hongos, normalmente se une al sustrato, monofenoles , y forma o-quinonas marrones. [10] Los sustratos competitivos, como los benzaldehídos 4-sustituidos para los hongos, compiten con el sustrato reduciendo la cantidad de monofenoles que se unen. Estos compuestos inhibidores añadidos a los productos los mantienen frescos durante períodos de tiempo más prolongados al disminuir la unión de los monofenoles que causan el oscurecimiento. [10] Esto permite un aumento en la calidad de los productos, así como en su vida útil.
La inhibición competitiva puede ser reversible o irreversible. Si se trata de una inhibición reversible , los efectos del inhibidor pueden superarse aumentando la concentración del sustrato. [8] Si es irreversible, la única forma de superarla es producir más del objetivo (y, por lo general, degradar y/o excretar el objetivo inhibido de forma irreversible).
En casi todos los casos, los inhibidores competitivos se unen en el mismo sitio de unión (sitio activo) que el sustrato, pero la unión en el mismo sitio no es un requisito. Un inhibidor competitivo podría unirse a un sitio alostérico de la enzima libre y evitar la unión del sustrato, siempre que no se una al sitio alostérico cuando el sustrato está unido. Por ejemplo, la estricnina actúa como un inhibidor alostérico del receptor de glicina en la médula espinal y el tronco encefálico de los mamíferos. La glicina es un importante neurotransmisor inhibidor postsináptico con un sitio receptor específico. La estricnina se une a un sitio alternativo que reduce la afinidad del receptor de glicina por la glicina, lo que produce convulsiones debido a la menor inhibición por parte de la glicina. [11]
En la inhibición competitiva, la velocidad máxima ( ) de la reacción no cambia, mientras que la afinidad aparente del sustrato por el sitio de unión disminuye (la constante de disociación aparentemente aumenta). El cambio en ( constante de Michaelis-Menten ) es paralelo a la alteración en , a medida que uno aumenta, el otro debe disminuir. Cuando un inhibidor competitivo se une a una enzima, aumenta. Esto significa que la afinidad de unión por la enzima disminuye, pero se puede superar aumentando la concentración del sustrato. [12] Cualquier concentración dada de inhibidor competitivo se puede superar aumentando la concentración del sustrato. En ese caso, el sustrato reducirá la disponibilidad para que un inhibidor se una y, por lo tanto, superará al inhibidor en la unión a la enzima. [12]

Ejemplos biológicos
Después de una ingestión accidental de un fármaco opioide contaminado , desmetilprodina , se descubrió el efecto neurotóxico de la 1-metil-4-fenil-1,2,3,6-tetrahidropiridina ( MPTP ). La MPTP puede atravesar la barrera hematoencefálica y entrar en los lisosomas ácidos . [13] La MPTP se activa biológicamente por la MAO-B, una isoenzima de la monoaminooxidasa (MAO) que se concentra principalmente en trastornos y enfermedades neurológicas. [14] Más tarde, se descubrió que la MPTP causa síntomas similares a los de la enfermedad de Parkinson . Las células del sistema nervioso central (astrocitos) incluyen MAO-B que oxida la MPTP a 1-metil-4-fenilpiridinio (MPP+), que es tóxica. [13] La MPP+ finalmente viaja al líquido extracelular mediante un transportador de dopamina , que en última instancia causa los síntomas de Parkinson. Sin embargo, la inhibición competitiva de la enzima MAO-B o del transportador de dopamina protege contra la oxidación de MPTP a MPP+. Se han probado algunos compuestos por su capacidad para inhibir la oxidación de MPTP a MPP+, incluidos el azul de metileno , el 5-nitroindazol, el norharman , el 9-metilnorharman y la menadiona . [14] Estos demostraron una reducción de la neurotoxicidad producida por MPTP.

Las sulfamidas también actúan como inhibidores competitivos. Por ejemplo, la sulfanilamida se une competitivamente a la enzima en el sitio activo de la dihidropteroato sintasa (DHPS) imitando el sustrato ácido paraaminobenzoico (PABA). [15] Esto evita que el sustrato mismo se una, lo que detiene la producción de ácido fólico, un nutriente esencial. Las bacterias deben sintetizar ácido fólico porque no tienen un transportador para él. Sin ácido fólico, las bacterias no pueden crecer ni dividirse. Por lo tanto, debido a la inhibición competitiva de las sulfamidas, son excelentes agentes antibacterianos. Un ejemplo de inhibición competitiva se demostró experimentalmente para la enzima succínico deshidrogenasa, que cataliza la oxidación de succinato a fumarato en el ciclo de Krebs . El malonato es un inhibidor competitivo de la succínico deshidrogenasa. La unión de la succínico deshidrogenasa al sustrato, succinato, se inhibe competitivamente. Esto sucede porque la química del malonato es similar a la del succinato. La capacidad del malonato para inhibir la unión de la enzima y el sustrato se basa en la proporción de malonato y succinato. El malonato se une al sitio activo de la succínico deshidrogenasa, de modo que el succinato no puede hacerlo. Por lo tanto, inhibe la reacción. [16]
Ecuación
El modelo de Michaelis-Menten puede ser una herramienta invaluable para comprender la cinética enzimática. Según este modelo, se puede utilizar un gráfico de la velocidad de reacción (V 0 ) asociada con la concentración [S] del sustrato para determinar valores como V max , velocidad inicial y K m (V max /2 o afinidad de la enzima con el complejo de sustrato). [4]
La inhibición competitiva aumenta el valor aparente de la constante de Michaelis-Menten , , de modo que la velocidad inicial de reacción, , viene dada por
donde , es la constante de disociación del inhibidor y es la concentración del inhibidor.
permanece igual porque la presencia del inhibidor puede ser superada por concentraciones más altas de sustrato. , la concentración de sustrato que se necesita para alcanzar , aumenta con la presencia de un inhibidor competitivo. Esto se debe a que la concentración de sustrato necesaria para alcanzar con un inhibidor es mayor que la concentración de sustrato necesaria para alcanzar sin un inhibidor.
Derivación
En el caso más simple de una enzima de sustrato único que obedece la cinética de Michaelis-Menten, el esquema típico
se modifica para incluir la unión del inhibidor a la enzima libre:
Obsérvese que el inhibidor no se une al complejo ES y el sustrato no se une al complejo EI. En general, se supone que este comportamiento es indicativo de que ambos compuestos se unen en el mismo sitio, pero eso no es estrictamente necesario. Al igual que con la derivación de la ecuación de Michaelis-Menten, suponga que el sistema está en estado estable, es decir, la concentración de cada una de las especies de enzimas no cambia.
Además, la concentración total de enzima conocida es , y la velocidad se mide en condiciones en las que las concentraciones de sustrato e inhibidor no cambian sustancialmente y se ha acumulado una cantidad insignificante de producto.
Podemos entonces plantear un sistema de ecuaciones:
| ( 1 ) |
| ( 2 ) |
| ( 3 ) |
| ( 4 ) |
donde y son conocidos. La velocidad inicial se define como , por lo que necesitamos definir la incógnita en términos de los valores conocidos y .
A partir de la ecuación ( 3 ), podemos definir E en términos de ES reordenando como
Dividiendo por da
Al igual que en la derivación de la ecuación de Michaelis-Menten, el término puede reemplazarse por la constante de velocidad macroscópica :
| ( 5 ) |
Sustituyendo la ecuación ( 5 ) en la ecuación ( 4 ), tenemos
Reordenando, encontramos que
En este punto, podemos definir la constante de disociación para el inhibidor como , dando
| ( 6 ) |
En este punto, sustituya la ecuación ( 5 ) y la ecuación ( 6 ) en la ecuación ( 1 ):
Reordenando para resolver ES, encontramos
| ( 7 ) |
Volviendo a nuestra expresión para , ahora tenemos:
Dado que la velocidad es máxima cuando toda la enzima está unida como complejo enzima-sustrato, . Reemplazando y combinando términos finalmente obtenemos la forma convencional:
| ( 8 ) |
Para calcular la concentración de inhibidor competitivo que produce una fracción de velocidad donde :
| ( 9 ) |
Véase también
- Regresión de Schild para la inhibición del receptor de ligando
- Inhibición no competitiva
Notas y referencias
- ^ abcd "Tipos de inhibición". Centro de Terapéutica Traslacional del NIH. Archivado desde el original el 8 de septiembre de 2011. Consultado el 2 de abril de 2012 .
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Diseño funcional de proteínas". Biología celular molecular (4.ª ed.).
- ^ abcde Berg JM, Tymoczko JL, Stryer L (2002). "Las enzimas pueden ser inhibidas por moléculas específicas". Bioquímica (5.ª ed.).
- ^ ab Berg JM, Tymoczko JL, Stryer L (2002). "El modelo de Michaelis-Menten explica las propiedades cinéticas de muchas enzimas". Bioquímica (5.ª ed.).
- ^ Eadie SG (1942). "La inhibición de la colinesterasa por fisostigmina y prostigmina". Journal of Biological Chemistry . 146 : 85–93. doi : 10.1016/S0021-9258(18)72452-6 .
- ^ Berg JM, Tymoczko JL, Stryer L (2002). "Apéndice: Vmax y KM pueden determinarse mediante gráficos de doble reciprocidad". Bioquímica (5.ª ed.).
- ^ Ophardt C. "Virtual Chembook". Elmhurst College. Archivado desde el original el 17 de octubre de 2015. Consultado el 1 de septiembre de 2015 .
- ^ ab "Mapa: Bioquímica gratis y fácil (Ahern y Rajagopal)". Biology LibreTexts . 24 de diciembre de 2014 . Consultado el 2 de noviembre de 2017 .
- ^ Flower RJ (marzo de 1974). "Fármacos que inhiben la biosíntesis de prostaglandinas". Pharmacological Reviews . 26 (1): 33–67. PMID 4208101.
- ^ ab Jiménez M, Chazarra S, Escribano J, Cabanes J, García-Carmona F (agosto de 2001). "Inhibición competitiva de la tirosinasa de hongos por benzaldehídos 4-sustituidos". Journal of Agricultural and Food Chemistry . 49 (8): 4060–4063. doi :10.1021/jf010194h. PMID 11513710.
- ^ Dick RM (2011). "Capítulo 2. Farmacodinámica: el estudio de la acción de los fármacos". En Ouellette R, Joyce JA (eds.). Farmacología para enfermería anestesiológica . Jones & Bartlett Learning. ISBN 978-0-7637-8607-6.
- ^ ab Voet D, Voet JG, Pratt CW (29 de febrero de 2016). Fundamentos de bioquímica: la vida a nivel molecular (quinta edición). Hoboken, NJ. ISBN 9781118918401.OCLC 910538334 .
{{cite book}}: CS1 maint: location missing publisher (link) - ^ ab Sian J, Youdim MB, Riederer P, Gerlach M (1999). "Síndrome parkinsoniano inducido por MPTP". Neuroquímica básica: aspectos moleculares, celulares y médicos. Sexta edición .
- ^ ab Herraiz T, Guillén H (agosto de 2011). "Inhibición de la bioactivación de la neurotoxina MPTP por antioxidantes, agentes redox e inhibidores de la monoaminooxidasa". Food and Chemical Toxicology . 49 (8): 1773–1781. doi :10.1016/j.fct.2011.04.026. hdl :10261/63126. PMID 21554916.
- ^ "Cómo funcionan las sulfamidas". Institutos Nacionales de Salud (NIH) . 15 de mayo de 2015. Consultado el 2 de noviembre de 2017 .
- ^ Potter VR, Dubois KP (marzo de 1943). "Estudios sobre el mecanismo de transporte de hidrógeno en tejidos animales". The Journal of General Physiology . 26 (4): 391–404. doi :10.1085/jgp.26.4.391. PMC 2142566 . PMID 19873352.





![{\displaystyle V_{0}={\frac {V_{\max }\,[S]}{K_{m}^{\text{app}}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e6ea985b759c13c54c08b2e1a1f7b292c549beb)
![{\displaystyle K_{m}^{\text{aplicación}}=K_{m}(1+[I]/K_{i})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e013bb3d416acd07c0c55ee196d46e9ede190a63)

![{\estilo de visualización [I]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5962300a54e8ce8b5761dac9a5fbbca450c2ce0f)

![{\displaystyle {\ce {E + S <=>[k_1][k_{-1}] ES ->[k_2] E + P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa34fa0b8ef16e2c4886b79b41fd6a84e83a68fd)
![{\displaystyle {\ce {EI + S <=>[k_{-3}][k_3] E + S + I <=>[k_1][k_{-1}] ES + I ->[k_2] E +P+I}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c358fddd797429f33b9c778a4bf4f669e8000b0)
![{\displaystyle {\frac {d[{\ce {E}}]}{dt}}={\frac {d[{\ce {ES}}]}{dt}}={\frac {d[{ \ce {EI}}]}{dt}}=0.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d5d8b4f228bd04aff5488c2efbc9f11f6a27a4b)
![{\displaystyle [{\ce {E}}]_{0}=[{\ce {E}}]+[{\ce {ES}}]+[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee7863f535867e7f0b9e3619c9d5431b8d14851a)
![{\displaystyle {\frac {d[{\ce {E}}]}{dt}}=0=-k_{1}[{\ce {E}}][{\ce {S}}]+k_ {-1}[{\ce {ES}}]+k_{2}[{\ce {ES}}]-k_{3}[{\ce {E}}][{\ce {I}}] +k_{-3}[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/524f829178a7d543a7f1dfe0d3836d3f2cd9beca)
![{\displaystyle {\frac {d[{\ce {ES}}]}{dt}}=0=k_{1}[{\ce {E}}][{\ce {S}}]-k_{ -1}[{\ce {ES}}]-k_{2}[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/deee1b4eb1dae3e5957260a6e625632daa130b8c)
![{\displaystyle {\frac {d[{\ce {EI}}]}{dt}}=0=k_{3}[{\ce {E}}][{\ce {I}}]-k_{ -3}[EI]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/632d3667fd0a9b85d3e0572d171e0ee8b67e8668)
![{\displaystyle {\ce {[S], [I]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ec1dbaad807d3af650d3805d798ed15120624bd)
![{\displaystyle {\ce {[E]_0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a654ad516b5d2547fd9980bb7590464441d6c38)
![{\displaystyle V_{0}=d[{\ce {P}}]/dt=k_{2}[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cee1a793ade4b98a68c506615766985cb243899)
![{\displaystyle {\ce {[ES]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a96c38a14c944f4ae51601cd8670fd2bf8e12331)
![{\displaystyle k_{1}[{\ce {E}}][{\ce {S}}]=(k_{-1}+k_{2})[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/940c092e01999c100f4d5fff6650b39dff53de02)
![{\displaystyle k_{1}[{\ce {S}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28690106a4f72a9371157eefe3e178d952cb36f0)
![{\displaystyle [{\ce {E}}]={\frac {(k_{-1}+k_{2})[{\ce {ES}}]}{k_{1}[{\ce {S }}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41cd11072115b7e97377d2dc62bd80a0e9460cd5)

![{\displaystyle [{\ce {E}}]={\frac {K_{m}[{\ce {ES}}]}{\ce {[S]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5caf94a9df39bcbeae36e01bfcd1f48e27626ce9)
![{\displaystyle 0={\frac {k_{3}[{\ce {I}}]K_{m}[{\ce {ES}}]}{\ce {[S]}}}-k_{- 3}[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3612eb7c921915246bb9dd47363904140d563374)
![{\displaystyle [{\ce {EI}}]={\frac {K_{m}k_{3}[{\ce {I}}][{\ce {ES}}]}{k_{-3} [{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5e8681d305f3fa55e808a5c06fad3748f06e131)

![{\displaystyle [{\ce {EI}}]={\frac {K_{m}[{\ce {I}}][{\ce {ES}}]}{K_{i}[{\ce { S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b5b6d93be687b516fc668d4934ac27e5972ae30)
![{\displaystyle [{\ce {E}}]_{0}={\frac {K_{m}[{\ce {ES}}]}{\ce {[S]}}}+[{\ce {ES}}]+{\frac {K_{m}[{\ce {I}}][{\ce {ES}}]}{K_{i}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c1417ec7ba5d7255a28927ed40932af9323e01)
![{\displaystyle [{\ce {E}}]_{0}=[{\ce {ES}}]\left({\frac {K_{m}}{\ce {[S]}}}+1 +{\frac {K_{m}[{\ce {I}}]}{K_{i}[{\ce {S}}]}}\right)=[{\ce {ES}}]{\ frac {K_{m}K_{i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}{K_{i}[{\ce {S }}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2691e0b26e6bee9fe37253403c892909a07add45)
![{\displaystyle [{\ce {ES}}]={\frac {K_{i}[{\ce {S}}][{\ce {E}}]_{0}}{K_{m}K_ {i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b57aff644fb93ec40ef3663d1463f25ea158869e)
![{\displaystyle V_{0}=k_{2}[{\ce {ES}}]={\frac {k_{2}K_{i}[{\ce {S}}][{\ce {E} }]_{0}}{K_{m}K_{i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7548c901ebd2e13620f6c9c6c30510ad5365859)
![{\displaystyle V_{0}={\frac {k_{2}[{\ce {E}}]_{0}[{\ce {S}}]}{K_{m}+[{\ce { S}}]+K_{m}{\frac {[{\ce {I}}]}{K_{i}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83cb5b38fc5e1ea8d7df09f1f8fec2d8f47db635)
![{\displaystyle V_{\max }=k_{2}[{\ce {E}}]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ea107b2c44540b990daab7f21c8a35fc76f6476)
![{\displaystyle V_{0}={\frac {V_{\max}[{\ce {S}}]}{K_{m}(1+{\frac {[{\ce {I}}]}{K_{i}}})+[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09a841f4777fa07f79bcec43de7264e95ef8f57c)
![{\displaystyle {\ce {[yo]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da716928de5f662f6ff1a1fc9ec0bde65f3fe2c2)


![{\displaystyle [{\ce {I}}]=\left({\frac {1}{f_{V{_{0}}}}}-1\right)K_{i}\left(1+{\frac {[{\ce {S}}]}{K_{m}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ccc99438e12f1dfdd4bdbdd0b21637c4003c470f)