Histoplasma capsulatum
| Histoplasma capsulatum | |
|---|---|
 | |
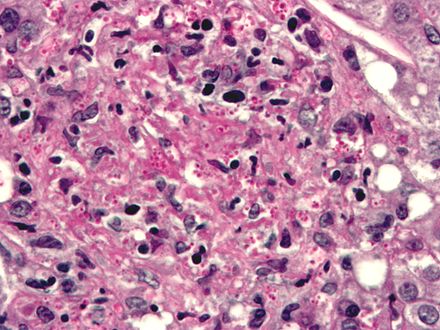
| Histopatología de Histoplasma capsulatum , tinción H&E , que muestra organismos rodeados de halos, en un granuloma de histiocitos epitelioides . | |
| Clasificación científica | |
| Dominio: | Eucariota |
| Reino: | Hongos |
| División: | Ascomycota |
| Clase: | Eurotiomicetos |
| Orden: | Onígenales |
| Familia: | Ajellomycetaceae |
| Género: | Histoplasma |
| Especies: | H. capsulatum |
| Nombre binomial | |
| Histoplasma capsulatum Cariño (1906) | |
Histoplasma capsulatum es una especie de hongo dimórfico . Su forma sexual se denomina Ajellomyces capsulatus . Puede causar histoplasmosis pulmonar y diseminada .
Histoplasma capsulatum está "distribuido en todo el mundo, excepto en la Antártida, pero se asocia con mayor frecuencia a los valles fluviales " [1] y se encuentra principalmente en "la región central y oriental de los Estados Unidos " [2], seguido de " América Central y del Sur , y otras áreas del mundo". [2] Es más frecuente en los valles de los ríos Ohio y Misisipi . Fue descubierto por Samuel Taylor Darling en 1906.
Crecimiento y morfología
Histoplasma capsulatum es un hongo ascomiceto relacionado estrechamente con Blastomyces dermatitidis . Es potencialmente sexual, y su estado sexual, Ajellomyces capsulatus , se puede producir fácilmente en cultivo, aunque no se ha observado directamente en la naturaleza. H. capsulatum se agrupa con B. dermatitidis y el patógeno sudamericano Paracoccidioides brasiliensis en la familia de hongos recientemente reconocida Ajellomycetaceae . [3] [4] Es dimórfico y cambia de una forma de crecimiento similar a un moho (filamentoso) en el hábitat natural a una forma de levadura pequeña y en ciernes en el huésped animal de sangre caliente.
Al igual que B. dermatitidis , H. capsulatum tiene dos tipos de apareamiento, "+" y "–". La gran mayoría de los aislamientos norteamericanos pertenecen a un solo tipo genético, [5] [6] pero un estudio de múltiples genes sugiere una población sexual recombinante. [6] Un análisis reciente ha sugerido que el tipo genético norteamericano predominante y un tipo menos común deben considerarse especies filogenéticas separadas, distintas de los aislamientos de H. capsulatum obtenidos en América Central y del Sur y otras partes del mundo. Estas entidades se designan temporalmente NAm1 (el tipo raro, que incluye un famoso aislamiento experimental denominado "la cepa Downs") y NAm2 (el tipo común). [6] Hasta el momento, no se observa una distinción clínica o geográfica bien establecida entre estos dos grupos genéticos.
En su forma asexual, el hongo crece como un microhongo colonial muy similar en macromorfología a B. dermatitidis . Un examen microscópico muestra una marcada distinción: H. capsulatum produce dos tipos de conidios, macroconidios globosos, de 8-15 μm, con una ornamentación distintiva de la pared celular tuberculada o en forma de dedo, y microconidios ovoides, de 2-4 μm, que parecen lisos o finamente rugosos. No está claro si alguno de estos tipos de conidios es la principal partícula infecciosa. Se forman en tallos cortos individuales y se transmiten fácilmente por el aire cuando se altera la colonia. Los ascomas del estado sexual miden 80-250 μm, y son muy similares en apariencia y anatomía a los descritos anteriormente para B. dermatitidis . Las ascosporas son igualmente diminutas, con un promedio de 1,5 μm.
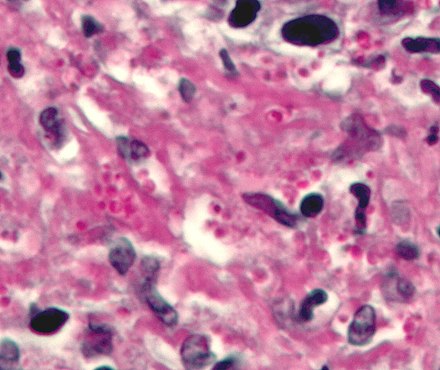
Las células de levadura en ciernes que se forman en los tejidos infectados son pequeñas (de aproximadamente 2 a 4 μm) y se observan típicamente formando grupos dentro de las células fagocíticas, incluidos los histiocitos y otros macrófagos, así como los monocitos. Una especie filogenética africana, H. duboisii , a menudo forma células de levadura más grandes, de hasta 15 μm.
Distribución geográfica
Histoplasma capsulatum está "distribuido en todo el mundo, excepto en la Antártida, pero más a menudo asociado con los valles de los ríos " [1] y se presenta principalmente en "los Estados Unidos centrales y orientales" [2] seguido de "América central y del sur, y otras áreas del mundo" [2] . Es más frecuente en los valles de los ríos Ohio y Mississippi .
Las zonas enzoóticas y endémicas de H. capsulatum se pueden dividir aproximadamente en áreas centrales, donde el hongo se encuentra ampliamente en el suelo o en la vegetación contaminada por excrementos de aves o insumos orgánicos equivalentes, y áreas periféricas, donde el hongo se encuentra relativamente raramente en asociación con el suelo, pero aún se encuentra abundantemente en grandes acumulaciones de guano de murciélago o pájaro en espacios cerrados como cuevas, edificios y árboles huecos. El área central principal para esta especie incluye los valles de los ríos Mississippi, Ohio y Potomac en los EE. UU., así como una amplia extensión de áreas adyacentes que se extienden desde Kansas , Illinois , Indiana y Ohio en el norte hasta Mississippi , Luisiana y Texas en el sur. [7] [8] [9] En algunas áreas, como Kansas City , las pruebas cutáneas con la preparación del antígeno de histoplasmina muestran que el 80-90% de la población residente tiene una reacción de anticuerpos a H. capsulatum , lo que probablemente indica una infección subclínica previa. [7] Los estados del norte de los EE. UU., como Minnesota , Michigan , Nueva York y Vermont , son áreas periféricas para la histoplasmosis, pero tienen condados dispersos donde entre el 5 y el 19 % de los residentes a lo largo de su vida muestran exposición a H. capsulatum . Un condado de Nueva York , el condado de St. Lawrence (al otro lado del río St. Lawrence desde el área de Cornwall – Preston – Brockville de Ontario, Canadá ) muestra exposiciones superiores al 20 %. [7]
La distribución de H. capsulatum en Canadá no está tan bien documentada como en los EE. UU. El valle de San Lorenzo es probablemente la región endémica más conocida según los informes de casos y una serie de estudios de reacción a pruebas cutáneas que se realizaron entre 1945 y 1970. El área de Montreal es un foco endémico particularmente bien documentado, no solo en las regiones agrícolas que rodean la ciudad [10] sino también dentro de la ciudad misma. [11] El área de Mount Royal en el centro de Montreal, especialmente los lados norte y este del parque Mt. Royal, mostró tasas de exposición entre el 20 y el 50% en escolares [11] y estudiantes universitarios residentes localmente de por vida. [12] Una tasa particularmente alta de exposición del 79,3% se mostró en St. Thomas, Ontario , al sur de London, Ontario , después de que 7 residentes locales murieran de histoplasmosis en 1957. [13] Según numerosos estudios regionales pequeños, los reactores a la prueba cutánea de histoplasmina forman ca. Entre el 10 y el 50 % de la población en gran parte del sur de Ontario y en el valle del San Lorenzo de Quebec, aproximadamente el 5 % en el sur de Manitoba y algunas partes del norte de Quebec (por ejemplo, Abitibi-Témiscamingue ) y aproximadamente el 1 % en Nueva Escocia . [12] [13] [14] [15] [16] La exposición de los canadienses aborígenes ocurre notablemente al norte de Quebec, [17] [18] pero no se ha informado en zonas biogeoclimáticas boreales similares en muchas otras partes de Canadá. Recientemente y de manera notable, se demostró que un grupo de cuatro casos de histoplasmosis adquiridos de forma autóctona estaban asociados con un campo de golf en los suburbios de Edmonton, Alberta . [19] El examen sugirió que el suelo local era la fuente.
Espectro de enfermedades
La histoplasmosis es generalmente una infección subclínica que no llega a la atención de la persona involucrada. El organismo tiende a permanecer vivo en las calcificaciones pulmonares dispersas; por lo tanto, algunos casos se detectan por la aparición de una infección grave cuando un paciente se inmunodeprime, quizás décadas después. Los casos francos se observan con mayor frecuencia como histoplasmosis pulmonar aguda, una enfermedad que se asemeja a la neumonía aguda pero que generalmente es autolimitada. [7] [20] Se observa con mayor frecuencia en niños recién expuestos a H. capsulatum o en individuos muy expuestos. Las afecciones cutáneas eritematosas que surgen de las reacciones a los antígenos pueden complicar la enfermedad, al igual que las mialgias, las artralgias y, raramente, las afecciones artríticas. Los pacientes con enfisema pueden contraer histoplasmosis pulmonar cavitaria crónica como una complicación de la enfermedad; eventualmente, la cavidad formada puede ser ocupada por una bola de hongo Aspergillus ( aspergiloma ), lo que puede provocar hemoptisis masiva. [20] Otra forma poco común de histoplasmosis es una enfermedad de progresión lenta conocida como mediastinitis granulomatosa, en la que los ganglios linfáticos de la cavidad mediastínica entre los pulmones se inflaman y finalmente se vuelven necróticos; los ganglios hinchados o el líquido que drena pueden afectar en última instancia a los bronquios, la vena cava superior, el esófago o el pericardio. Una enfermedad particularmente peligrosa es la fibrosis mediastínica, en la que un subconjunto de individuos con mediastinitis granulomatosa desarrolla una reacción fibrótica incontrolada que puede presionar los pulmones o los bronquios, o puede causar insuficiencia cardíaca derecha. Hay una serie de otras manifestaciones pulmonares raras de histoplasmosis.
La histoplasmosis, al igual que la blastomicosis, puede diseminarse por vía hematógena para infectar órganos y tejidos internos, pero lo hace en una proporción muy baja de casos, y la mitad o más de estos casos de diseminación implican inmunodepresión. A diferencia de la blastomicosis, la histoplasmosis es una enfermedad definitoria de SIDA reconocida en personas con infección por VIH ; la histoplasmosis diseminada afecta aproximadamente al 5% de los pacientes con SIDA con recuentos de células CD4 + <150 células/μL en áreas altamente endémicas. [21] La incidencia de esta afección disminuyó significativamente después de la introducción de las terapias actuales contra el VIH. [20] Otras afecciones muy poco comúnmente asociadas con H. capsulatum incluyen endocarditis y peritonitis . [7] [22]
Ecología y epidemiología
El Histoplasma capsulatum parece estar fuertemente asociado con los excrementos de ciertas especies de aves, así como de murciélagos. [7] Una mezcla de estos excrementos y ciertos tipos de suelo es particularmente propicia para la proliferación. En áreas altamente endémicas existe una fuerte asociación con el suelo debajo y alrededor de los gallineros, y con áreas donde el suelo o la vegetación se han contaminado fuertemente con material fecal depositado por aves en bandadas, como estorninos y mirlos . Las áreas de descanso de aves que están libres de Histoplasma parecen tener un menor contenido de nitrógeno, fósforo, materia orgánica y humedad que las áreas de descanso contaminadas. [7] El guano de las gaviotas y otras aves asociadas al agua que anidan en colonias rara vez está relacionado con la histoplasmosis. [23] Las viviendas de los murciélagos, incluidas las cuevas, los áticos y los árboles huecos, son hábitats clásicos de H. capsulatum . [7] [22]
Los brotes de histoplasmosis suelen estar asociados a la limpieza de acumulaciones de guano o a la limpieza de vegetación cubierta de guano, o a la exploración de cuevas de murciélagos. Sin embargo, también pueden estar asociados al polvo que se levanta con el viento y que se libera durante los proyectos de construcción en zonas endémicas: un brote clásico es el asociado a una intensa actividad de construcción, incluida la construcción del metro, en Montreal en 1963. [24]
Al igual que con la blastomicosis , la comprensión precisa de las afinidades ecológicas de H. capsulatum se complica en gran medida por la dificultad de aislar el hongo directamente de la naturaleza. Nuevamente, se debe utilizar el procedimiento de paso de ratón ideado originalmente por Emmons [25] . Se ha publicado una técnica de PCR directa para la detección de H. capsulatum en el suelo. [26] Parece particularmente probable que H. capsulatum cause enfermedad clínica en niños pequeños, personas que trabajan en sitios contaminados por excrementos de pájaros o murciélagos propicios, personas expuestas al polvo de construcción levantado de sitios contaminados, pacientes inmunodeprimidos y personas que sufren de enfisema. La eliminación del agente de suelos contaminados generalmente implica el uso de fumigantes tóxicos con un éxito limitado. [27]
Etimología
En 1905, Samuel Taylor Darling identificó por casualidad un microorganismo similar a un protozoo en una muestra de autopsia mientras intentaba comprender la malaria , que prevalecía durante la construcción del Canal de Panamá . Llamó a este microorganismo Histoplasma capsulatum porque invadía el citoplasma ( plasma ) de células similares a histiocitos ( Histo ) y tenía un halo refractivo que imitaba una cápsula ( capsulatum ), un nombre inapropiado. [28]
Imágenes adicionales
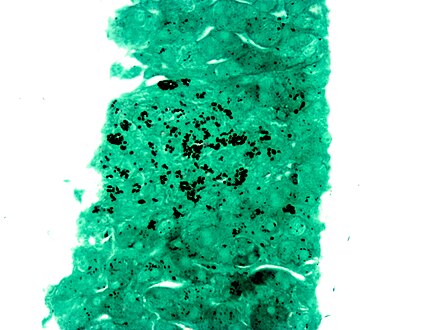
- Histopatología de Histoplasma capsulatum , tinción GMS , que muestra levaduras de gemación estrecha
- H. capsulatum . Tinción de plata metenamina.
- Histoplasma (rojo brillante, pequeño, circular). Tinción de PAS diastasa .
- Histoplasma . Tinción PAS diastasa.
- Histoplasma en un granuloma . Tinción de PAS diastasa.
- Histoplasma en un granuloma. Tinción GMS .
Véase también
Referencias
- ^ ab Chiller, Tom M. (2016), "Histoplasmosis", Libro amarillo de los CDC: Información de salud de los CDC para viajes internacionales .
- ^ abcd CDC (2014), Enfermedades fúngicas > Enfermedades fúngicas globales > Prevención de muertes por histoplasmosis.
- ^ Untereiner, WA; Scott, JA; Naveau, FA; Bachewich, J. (2002). "Filogenia de Ajellomyces, Polytolypa y Spiromastix (Onygenaceae) inferida a partir de la secuencia de ADNr y datos no moleculares". Estudios en Micología . 47 : 25–35.
- ^ Untereiner, WA; Scott, JA; Naveau, FA; Sigler, L; Bachewich, J; Angus, A (2004). "Las Ajellomycetaceae, una nueva familia de Onygenales asociadas a vertebrados". Mycologia . 96 (4): 812–821. doi :10.2307/3762114. JSTOR 3762114. PMID 21148901.
- ^ Karimi, K; Wheat, LJ; Connolly, P; Cloud, G; Hajjeh, R; Wheat, E; Alves, K; Lacaz Cd Cda, S; Keath, E (1 de diciembre de 2002). "Diferencias en la histoplasmosis en pacientes con síndrome de inmunodeficiencia adquirida en los Estados Unidos y Brasil". The Journal of Infectious Diseases . 186 (11): 1655–1660. doi : 10.1086/345724 . PMID 12447743.
- ^ abc Kasuga, T; Blanco, TJ; Koenig, G; McEwen, J; Restrepo, A; Castañeda, E; Da Silva Lacaz, C; Heins-Vaccari, EM; De Freitas, RS; Zancopé-Oliveira, RM; Qin, Z; Negroni, R; Carter, fiscal del distrito; Mikami, Y; Tamura, M; Taylor, ML; Miller, GF; Poonwan, N; Taylor, JW (2003). "Filogeografía del hongo patógeno Histoplasma capsulatum". Ecología Molecular . 12 (12): 3383–401. Código Bib : 2003 MolEc..12.3383K. doi :10.1046/j.1365-294x.2003.01995.x. Número de modelo: PMID 14629354. Número de modelo: S2CID 13060796.
- ^ abcdefgh Kwon-Chung, K. junio; Bennett, Joan E. (1992). Micología médica . Filadelfia: Lea y Febiger. ISBN 978-0812114638.
- ^ Chamany, S; Mirza, SA; Fleming, JW; Howell, JF; Lenhart, SW; Mortimer, VD; Phelan, MA; Lindsley, MD; Iqbal, NJ; Wheat, LJ; Brandt, ME; Warnock, DW; Hajjeh, RA (2004). "Un gran brote de histoplasmosis entre estudiantes de secundaria en Indiana, 2001". The Pediatric Infectious Disease Journal . 23 (10): 909–14. doi :10.1097/01.inf.0000141738.60845.da. PMID 15602189. S2CID 23475233.
- ^ Stobierski, MG; Hospedales, CJ; Hall, WN; Robinson-Dunn, B; Hoch, D; Sheill, DA (1996). "Brote de histoplasmosis entre empleados de una fábrica de papel, Michigan, 1993". Journal of Clinical Microbiology . 34 (5): 1220–1223. doi :10.1128/JCM.34.5.1220-1223.1996. PMC 228985 . PMID 8727906.
- ^ Guy, R; Roy, O (1949). "Sensibilidad a la histoplasmina; observaciones preliminares en un grupo de niños en edad escolar de la provincia de Quebec". Revista canadiense de salud pública . 40 (2): 68–71. PMID 18113223.
- ^ ab Leznoff, A; Frank, H; Taussig, A; Brandt, JL (1969). "La distribución focal de la histoplasmosis en Montreal". Revista Canadiense de Salud Pública . 60 (8): 321–5. PMID 5806145.
- ^ ab MacEachern, EJ; McDonald, JC (1971). "Sensibilidad a la histoplasmina en estudiantes de la Universidad McGill". Revista Canadiense de Salud Pública . 62 (5): 415–422. PMID 5137623.
- ^ ab Haggar, RA; Brown, EL; Toplack, NJ (1957). "Histoplasmosis en el suroeste de Ontario". Revista de la Asociación Médica Canadiense . 77 (9): 855–861. PMC 1824134 . PMID 13472567.
- ^ Rostocka, M; Hiltz, JE (1966). "Sensibilidad cutánea a la histoplasmina en Nueva Escocia". Revista Canadiense de Salud Pública . 57 (9): 413–418. PMID 5981243.
- ^ Hoff, B.; Fogle, B. (1970). "Informe de caso. Histoplasmosis en un perro". Revista veterinaria canadiense . 11 (7): 145–148. PMC 1695089 . PMID 5464271.
- ^ Mochi, A; Edwards, PQ (1952). "Distribución geográfica de la histoplasmosis y sensibilidad a la histoplasmina". Boletín de la Organización Mundial de la Salud . 5 (3): 259–291. PMC 2554039 . PMID 14935779.
- ^ Guy, R; Panisset, M; Frappier, A (1949). "Sensibilidad a la histoplasmina; un breve estudio de la incidencia de hipersensibilidad a la histoplasmina en una tribu india del norte de Quebec". Revista canadiense de salud pública . 40 (7): 306–309. PMID 18133141.
- ^ Schaefer, O (1966). "Calcificación miliar pulmonar y sensibilidad a la histoplasmina en esquimales canadienses". Revista Canadiense de Salud Pública . 57 (9): 410–418. PMID 5977447.
- ^ Anderson, Heather; Honish, Lance; Taylor, Geoff; Johnson, Marcia; Tovstiuk, Chrystyna; Fanning, Anne; Tyrrell, Gregory; Rennie, Robert; Jaipaul, Joy; Sand, Crystal; Probert, Steven (2006). "Clúster de histoplasmosis, campo de golf, Canadá". Enfermedades infecciosas emergentes . 12 (1): 163–165. doi :10.3201/eid1201.051083. PMC 3291405 . PMID 16494738.
- ^ abc Kauffman, CA (2007). "Histoplasmosis: una actualización clínica y de laboratorio". Clinical Microbiology Reviews . 20 (1): 115–132. doi :10.1128/CMR.00027-06. PMC 1797635 . PMID 17223625.
- ^ Hajjeh, RA (1995). "Histoplasmosis diseminada en personas infectadas con el virus de la inmunodeficiencia humana". Clinical Infectious Diseases . 21 (Supl 1): S108–10. doi :10.1093/clinids/21.supplement_1.s108. PMID 8547497.
- ^ ab Rippon, John Willard (1988). Micología médica: los hongos patógenos y los actinomicetos patógenos (3.ª ed.). Filadelfia, PA: Saunders. ISBN 978-0721624440.
- ^ Waldman, RJ; England, AC; Tauxe, R; Kline, T; Weeks, RJ; Ajello, L; Kaufman, L; Wentworth, B; Fraser, DW (1983). "Un brote invernal de histoplasmosis aguda en el norte de Michigan". American Journal of Epidemiology . 117 (1): 68–75. doi :10.1093/oxfordjournals.aje.a113517. PMID 6823954.
- ^ Leznoff, A; Frank, H; Telner, P; Rosensweig, J; Brandt, JL (1964). "Histoplasmosis en Montreal durante el otoño de 1963, con observaciones sobre el eritema multiforme". Revista de la Asociación Médica Canadiense . 91 (22): 1154–1160. PMC 1928451 . PMID 14226089.
- ^ Emmons, CW (1961). "Aislamiento de Histoplasma capsulatum del suelo en Washington, DC" Public Health Reports . 76 (591–596): 591–5. doi :10.2307/4591218. JSTOR 4591218. PMC 1929641 . PMID 13696714.
- ^ Reid, TM; Schafer, MP (1999). "Detección directa de Histoplasma capsulatum en suspensiones de suelo mediante PCR de dos etapas". Sondas moleculares y celulares . 13 (4): 269–273. doi :10.1006/mcpr.1999.0247. PMID 10441199.
- ^ Ajello, L.; Weeks, RJ (1983). "Descontaminación del suelo y otras medidas de control". En DiSalvo, Arthur F. (ed.). Micosis ocupacionales . Filadelfia, Pensilvania: Lea y Febiger. págs. 229–238. ISBN 9780812108859.
- ^ Mahajan, Monika (2021). "Etimología: Histoplasma capsulatum". Enfermedades infecciosas emergentes . 27 (3): 969. doi : 10.3201/eid2703.et2703 . PMC 7920646 .
Citando texto de dominio público de los CDC