Punto de ebullición

El punto de ebullición de una sustancia es la temperatura a la cual la presión de vapor de un líquido es igual a la presión que rodea al líquido [1] [2] y el líquido se transforma en vapor.
El punto de ebullición de un líquido varía en función de la presión ambiental circundante. Un líquido en un vacío parcial , es decir, bajo una presión más baja, tiene un punto de ebullición más bajo que cuando ese líquido está a presión atmosférica . Debido a esto, el agua hierve a 100 °C (o con precisión científica: 99,97 °C (211,95 °F)) bajo presión estándar al nivel del mar, pero a 93,4 °C (200,1 °F) a 1.905 metros (6.250 pies) [3] de altitud. Para una presión dada, diferentes líquidos hervirán a diferentes temperaturas.
El punto de ebullición normal (también llamado punto de ebullición atmosférico o punto de ebullición a presión atmosférica ) de un líquido es el caso especial en el que la presión de vapor del líquido es igual a la presión atmosférica definida a nivel del mar, una atmósfera . [4] [5] A esa temperatura, la presión de vapor del líquido se vuelve suficiente para superar la presión atmosférica y permitir que se formen burbujas de vapor dentro de la masa del líquido. El punto de ebullición estándar ha sido definido por la IUPAC desde 1982 como la temperatura a la que se produce la ebullición bajo una presión de un bar . [6]
El calor de vaporización es la energía necesaria para transformar una cantidad determinada (un mol, un kg, una libra, etc.) de una sustancia de líquido a gas a una presión determinada (a menudo la presión atmosférica).
Los líquidos pueden transformarse en vapor a temperaturas inferiores a sus puntos de ebullición mediante el proceso de evaporación . La evaporación es un fenómeno superficial en el que las moléculas situadas cerca del borde del líquido, que no están contenidas por la suficiente presión del líquido en ese lado, escapan al entorno en forma de vapor . Por otro lado, la ebullición es un proceso en el que las moléculas de cualquier parte del líquido escapan, lo que da lugar a la formación de burbujas de vapor en el interior del líquido.
Temperatura y presión de saturación
Un líquido saturado contiene tanta energía térmica como puede sin hervir (o, por el contrario, un vapor saturado contiene tan poca energía térmica como puede sin condensarse ).
La temperatura de saturación significa punto de ebullición . La temperatura de saturación es la temperatura a la que un líquido hierve y pasa a su fase de vapor , a la que se corresponde con la presión de saturación correspondiente . Se puede decir que el líquido está saturado de energía térmica . Cualquier adición de energía térmica da como resultado una transición de fase .
Si la presión en un sistema permanece constante ( isobárica ), un vapor a temperatura de saturación comenzará a condensarse en su fase líquida a medida que se elimina energía térmica ( calor ). De manera similar, un líquido a temperatura y presión de saturación hervirá en su fase de vapor a medida que se aplique energía térmica adicional.
El punto de ebullición corresponde a la temperatura a la cual la presión de vapor del líquido es igual a la presión ambiental circundante. Por lo tanto, el punto de ebullición depende de la presión. Los puntos de ebullición pueden publicarse con respecto a la presión estándar del NIST, EE. UU. de 101,325 kPa (1 atm ), o la presión estándar de la IUPAC de 100.000 kPa (1 bar ). A mayores elevaciones, donde la presión atmosférica es mucho menor, el punto de ebullición también es menor. El punto de ebullición aumenta con el aumento de presión hasta el punto crítico , donde las propiedades del gas y del líquido se vuelven idénticas. El punto de ebullición no puede aumentarse más allá del punto crítico. Del mismo modo, el punto de ebullición disminuye con la disminución de la presión hasta que se alcanza el punto triple . El punto de ebullición no puede reducirse por debajo del punto triple.
Si se conocen el calor de vaporización y la presión de vapor de un líquido a una determinada temperatura, el punto de ebullición se puede calcular utilizando la ecuación de Clausius-Clapeyron , así:
dónde:
- es el punto de ebullición a la presión de interés,
- es la constante del gas ideal ,
- es la presión de vapor del líquido,
- es una cierta presión donde se conoce la correspondiente (normalmente los datos están disponibles a 1 atm o 100 kPa (1 bar)),
- es el calor de vaporización del líquido,
- es la temperatura de ebullición,
- es el logaritmo natural .
La presión de saturación es la presión correspondiente a la temperatura de saturación a la que un líquido hierve y pasa a su fase de vapor. La presión de saturación y la temperatura de saturación tienen una relación directa: a medida que aumenta la presión de saturación, también aumenta la temperatura de saturación.
Si la temperatura de un sistema permanece constante ( sistema isotérmico ), el vapor a presión y temperatura de saturación comenzará a condensarse en su fase líquida a medida que aumenta la presión del sistema. De manera similar, un líquido a presión y temperatura de saturación tenderá a condensarse en su fase de vapor a medida que disminuye la presión del sistema.
Hay dos convenciones con respecto al punto de ebullición estándar del agua : el punto de ebullición normal se da comúnmente como 100 °C (212 °F ) (en realidad 99,97 °C (211,9 °F) siguiendo la definición termodinámica de la escala Celsius basada en el kelvin ) a una presión de 1 atm (101,325 kPa). El punto de ebullición estándar recomendado por la IUPAC del agua a una presión estándar de 100 kPa (1 bar) [7] es 99,61 °C (211,3 °F). [6] [8] A modo de comparación, en la cima del Monte Everest , a 8.848 m (29.029 pies ) de altitud, la presión es de unos 34 kPa (255 Torr ) [9] y el punto de ebullición del agua es 71 °C (160 °F). [ cita requerida ] La escala de temperatura Celsius estuvo definida hasta 1954 por dos puntos: 0 °C definido por el punto de congelación del agua y 100 °C definido por el punto de ebullición del agua a presión atmosférica estándar .
Relación entre el punto de ebullición normal y la presión de vapor de los líquidos

Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, menor será el punto de ebullición normal (es decir, el punto de ebullición a presión atmosférica) del líquido.
El gráfico de presión de vapor a la derecha tiene gráficos de las presiones de vapor versus temperaturas para una variedad de líquidos. [10] Como se puede ver en el gráfico, los líquidos con las presiones de vapor más altas tienen los puntos de ebullición normales más bajos.
Por ejemplo, a cualquier temperatura dada, el cloruro de metilo tiene la presión de vapor más alta de todos los líquidos del gráfico. También tiene el punto de ebullición normal más bajo (−24,2 °C), que es donde la curva de presión de vapor del cloruro de metilo (la línea azul) se cruza con la línea de presión horizontal de una atmósfera ( atm ) de presión de vapor absoluta.
El punto crítico de un líquido es la temperatura (y presión) más alta a la que realmente hervirá.
Véase también Presión de vapor del agua .
Punto de ebullición de los elementos químicos
El elemento con el punto de ebullición más bajo es el helio . Tanto el punto de ebullición del renio como el del tungsteno superan los 5000 K a presión estándar ; debido a que es difícil medir temperaturas extremas con precisión sin sesgo, ambos han sido citados en la literatura como los que tienen el punto de ebullición más alto. [11]
Punto de ebullición como propiedad de referencia de un compuesto puro
Como se puede ver en el gráfico anterior del logaritmo de la presión de vapor frente a la temperatura para cualquier compuesto químico puro dado , su punto de ebullición normal puede servir como una indicación de la volatilidad general de ese compuesto . Un compuesto puro dado tiene solo un punto de ebullición normal, si lo hay, y el punto de ebullición normal y el punto de fusión de un compuesto pueden servir como propiedades físicas características para ese compuesto, enumeradas en libros de referencia. Cuanto más alto es el punto de ebullición normal de un compuesto, menos volátil es ese compuesto en general y, a la inversa, cuanto más bajo es el punto de ebullición normal de un compuesto, más volátil es ese compuesto en general. Algunos compuestos se descomponen a temperaturas más altas antes de alcanzar su punto de ebullición normal, o a veces incluso su punto de fusión. Para un compuesto estable, el punto de ebullición varía desde su punto triple hasta su punto crítico , dependiendo de la presión externa. Más allá de su punto triple, el punto de ebullición normal de un compuesto, si lo hay, es más alto que su punto de fusión. Más allá del punto crítico, las fases líquida y de vapor de un compuesto se fusionan en una fase, que puede llamarse gas sobrecalentado. A cualquier temperatura dada, si el punto de ebullición normal de un compuesto es más bajo, entonces ese compuesto generalmente existirá como un gas a presión externa atmosférica. Si el punto de ebullición normal del compuesto es más alto, entonces ese compuesto puede existir como un líquido o sólido a esa temperatura dada a presión externa atmosférica, y entonces existirá en equilibrio con su vapor (si es volátil) si sus vapores están contenidos. Si los vapores de un compuesto no están contenidos, entonces algunos compuestos volátiles pueden eventualmente evaporarse a pesar de sus puntos de ebullición más altos.

En general, los compuestos con enlaces iónicos tienen puntos de ebullición normales altos, si no se descomponen antes de alcanzar esas altas temperaturas. Muchos metales tienen puntos de ebullición altos, pero no todos. Muy generalmente, a igualdad de otros factores, en compuestos con moléculas unidas covalentemente , a medida que aumenta el tamaño de la molécula (o masa molecular ), aumenta el punto de ebullición normal. Cuando el tamaño molecular se convierte en el de una macromolécula , polímero o de otro modo muy grande, el compuesto a menudo se descompone a alta temperatura antes de que se alcance el punto de ebullición. Otro factor que afecta al punto de ebullición normal de un compuesto es la polaridad de sus moléculas. A medida que aumenta la polaridad de las moléculas de un compuesto, aumenta su punto de ebullición normal, a igualdad de otros factores. Estrechamente relacionado está la capacidad de una molécula para formar enlaces de hidrógeno (en estado líquido), lo que dificulta que las moléculas abandonen el estado líquido y, por lo tanto, aumenta el punto de ebullición normal del compuesto. Los ácidos carboxílicos simples se dimerizan formando enlaces de hidrógeno entre moléculas. Un factor menor que afecta a los puntos de ebullición es la forma de una molécula. Hacer que la forma de una molécula sea más compacta tiende a reducir ligeramente el punto de ebullición normal en comparación con una molécula equivalente con mayor área de superficie.
| Nombre común | n - butano | isobutano |
|---|---|---|
| Nombre IUPAC | butano | 2-metilpropano |
Forma molecular | 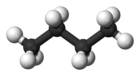 | 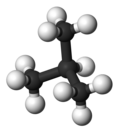 |
| Punto de ebullición (°C) | -0,5 | -11,7 |
| Nombre común | n - pentano | isopentano | neopentano |
|---|---|---|---|
| Nombre IUPAC | pentano | 2-metilbutano | 2,2-dimetilpropano |
Forma molecular |  |  |  |
| Punto de ebullición (°C) | 36.0 | 27.7 | 9.5 |

La mayoría de los compuestos volátiles (a temperaturas cercanas a la temperatura ambiente) pasan por una fase líquida intermedia mientras se calientan desde una fase sólida hasta transformarse finalmente en una fase de vapor. En comparación con la ebullición, una sublimación es una transformación física en la que un sólido se convierte directamente en vapor, lo que ocurre en algunos casos seleccionados, como con el dióxido de carbono a presión atmosférica. Para estos compuestos, un punto de sublimación es una temperatura a la que un sólido que se convierte directamente en vapor tiene una presión de vapor igual a la presión externa.
Impurezas y mezclas
En la sección anterior, se trataron los puntos de ebullición de compuestos puros. Las presiones de vapor y los puntos de ebullición de las sustancias pueden verse afectados por la presencia de impurezas disueltas ( solutos ) u otros compuestos miscibles, y el grado de efecto depende de la concentración de las impurezas u otros compuestos. La presencia de impurezas no volátiles, como sales o compuestos de una volatilidad mucho menor que el compuesto componente principal, disminuye su fracción molar y la volatilidad de la solución , y, por lo tanto, aumenta el punto de ebullición normal en proporción a la concentración de los solutos. Este efecto se denomina elevación del punto de ebullición . Como ejemplo común, el agua salada hierve a una temperatura más alta que el agua pura.
En otras mezclas de compuestos miscibles (componentes), puede haber dos o más componentes de volatilidad variable, cada uno con su propio punto de ebullición de componente puro a cualquier presión dada. La presencia de otros componentes volátiles en una mezcla afecta las presiones de vapor y, por lo tanto, los puntos de ebullición y de rocío de todos los componentes de la mezcla. El punto de rocío es una temperatura a la que un vapor se condensa en un líquido. Además, a cualquier temperatura dada, la composición del vapor es diferente de la composición del líquido en la mayoría de estos casos. Para ilustrar estos efectos entre los componentes volátiles de una mezcla, se utiliza comúnmente un diagrama de punto de ebullición . La destilación es un proceso de ebullición y [generalmente] condensación que aprovecha estas diferencias de composición entre las fases líquida y de vapor.
Punto de ebullición del agua con elevación.
A continuación se muestra una tabla del cambio en el punto de ebullición del agua con la elevación, a intervalos de 500 metros sobre el rango de habitación humana [el Mar Muerto a −430,5 metros (−1.412 pies) hasta La Rinconada, Perú a 5.100 m (16.700 pies)], luego de 1.000 metros sobre el rango adicional de elevación de la superficie deshabitada [hasta el Monte Everest a 8.849 metros (29.032 pies)], junto con un rango similar en Imperial.
| Elevación (m) | Punto de ebullición (°C) | Elevación (pies) | Punto de ebullición (°F) | |
|---|---|---|---|---|
| -500 | 101.6 | −1.500 | 214.7 | |
| 0 | 100.0 | 0 | 212.0 | |
| 500 | 98.4 | 1.500 | 209.3 | |
| 1.000 | 96,7 | 3.000 | 206.6 | |
| 1.500 | 95.1 | 4.500 | 203.9 | |
| 2.000 | 93.4 | 6.000 | 201.1 | |
| 2.500 | 91.7 | 7.500 | 198.3 | |
| 3.000 | 90.0 | 9.000 | 195,5 | |
| 3.500 | 88.2 | 10.500 | 192.6 | |
| 4.000 | 86.4 | 12.000 | 189,8 | |
| 4.500 | 84.6 | 13.500 | 186,8 | |
| 5.000 | 82.8 | 15.000 | 183,9 | |
| 6.000 | 79.1 | 16.500 | 180.9 | |
| 7.000 | 75.3 | 20.000 | 173,8 | |
| 8.000 | 71.4 | 23.000 | 167,5 | |
| 9.000 | 67.4 | 26.000 | 161.1 | |
| 29.000 | 154.6 |
Tabla de elementos
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Period | |||||||||||||||||||||
| 1 | H2 20,271 K (−252,879 °C) | Él4,222 K (−268,928 °C) | |||||||||||||||||||
| 2 | Li1603 K (1330 °C) | Ser2742 K (2469 °C) | B4200 K (3927 °C) | do3915 K ( subl. ) (3642 °C) | N º 2 77,355 K (−195,795 °C) | O2 90,188 K (−182,962 °C) | F2 85,03 K (−188,11 °C) | Nordeste27,104 K (−246,046 °C) | |||||||||||||
| 3 | N / A1156,090 K (882,940 °C) | Mg1363 K (1091 °C) | Alabama2743 K (2470 °C) | Si3538 K (3265 °C) | PAG553,7 K (280,5 °C) | S717,8 K (444,6 °C) | Cl 2239,11 K (−34,04 °C) | Arkansas87,302 K (−185,848 °C) | |||||||||||||
| 4 | K1032 K (759 °C) | California1757 K (1484 °C) | Carolina del Sur3109 K (2836 °C) | Sí3560 K (3287 °C) | V3680 K (3407 °C) | Cr2945,15 K (2672,0 °C) | Minnesota2334 K (2061 °C) | Fé3134 K (2861 °C) | Co3200 K (2927 °C) | Ni3003 K (2730 °C) | Cu2835 K (2562 °C) | Zinc1180 K (907 °C) | Georgia2673 K (2400 °C) | En3106 K (2833 °C) | Como887 K ( subl. ) (615 °C) | Sí958 K (685 °C) | Br 2332,0 K (58,8 °C) | Kr119,735 K (−153,415 °C) | |||
| 5 | Rb961 K (688 °C) | Sr1650 K (1377 °C) | Y3203 K (2930 °C) | Zr4650 K (4377 °C) | Nótese bien5017 K (4744 °C) | Mes4912 K (4639 °C) | Tc4538 K (4265 °C) | Ru4423 K (4150 °C) | Rh3968 K (3695 °C) | Pd3236 K (2963 °C) | Ag2483 K (2210 °C) | Cd1040 K (767 °C) | En2345 K (2072 °C) | Sn2875 K (2602 °C) | Sb1908 K (1635 °C) | Te1261 K (988 °C) | Yo 2 457,4 K (184,3 °C) | Xe165,051 K (−108,099 °C) | |||
| 6 | Cs944 K (671 °C) | Licenciado en Letras2118 K (1845 °C) |  | Lu3675 K (3402 °C) | alta frecuencia4876 K (4603 °C) | Ejército de reserva5731 K (5458 °C) | Yo6203 K (5930 °C) | Re5900,15 K (5627,0 °C) | El sistema operativo5285 K (5012 °C) | Ir4403 K (4130 °C) | En4098 K (3825 °C) | Au3243 K (2970 °C) | Hg629,88 K (356,73 °C) | El1746 K (1473 °C) | Pb2022 K (1749 °C) | Bi1837 K (1564 °C) | Correos1235 K (962 °C) | A las 2503 ± 3 K (230 ± 3 °C) | Enfermera211,5 K (−61,7 °C) | ||
| 7 | Es950 K (677 °C) | Real academia de bellas artes2010 K (1737 °C) |  | Lr | Rf5800 K (5500 °C) | Db | Sg | Bh | Hs | Monte | Ds | Rg | En340 ± 10 K (67 ± 10 °C) | Nueva Hampshire1430 K (1130 °C) | Florida380 K (107 °C) | Mc~1400 K (~1100 °C) | Nivel1035–1135 K (762–862 °C) | Ts883 K (610 °C) | Sí450 ± 10 K (177 ± 10 °C) | ||
 | La3737 K (3464 °C) | Este3716 K (3443 °C)6 | Pr3403 K (3130 °C) | Dakota del Norte3347 K (3074 °C) | P.m3273 K (3000 °C) | Pequeño2173 K (1900 °C) | UE1802 K (1529 °C) | Dios3546 K (3273 °C) | Tuberculosis3396 K (3123 °C) | Por favor2840 K (2567 °C) | Hola2873 K (2600 °C) | Sí.3141 K (2868 °C) | Yo soy2223 K (1950 °C) | Yb1469 K (1196 °C) | |||||||
 | C.A3471 K (3198 °C) | El5061 K (4788 °C) | Pensilvania4300?K (4027 °C) | tú4404 K (4131 °C) | Notario público4175,15 K (3902,0 °C) | Pu3508,15 K (3235,0 °C) | Soy2880 K (2607 °C) | Centímetro3383 K (3110 °C) | Libro2900 K (2627 °C) | Cf1743 K (1470 °C) | Es1269 (996 °C) | Fm | Maryland | No | |||||||
| Leyenda | |||||||||||||||||||||
| Los valores están en kelvin K y grados Celsius °C, redondeados. | |||||||||||||||||||||
| Para conocer el equivalente en grados Fahrenheit °F, consulte: Puntos de ebullición de los elementos (página de datos) | |||||||||||||||||||||
| Algunos valores son predicciones | |||||||||||||||||||||
Primordial De la decadencia Sintético El borde muestra la aparición natural del elemento. | |||||||||||||||||||||
Véase también
- Puntos de ebullición de los elementos (página de datos)
- Elevación del punto de ebullición
- Punto crítico (termodinámica)
- Ebulliómetro , un dispositivo para medir con precisión el punto de ebullición de los líquidos.
- Temperatura de Hagedorn
- Método de Joback (estimación de puntos de ebullición normales a partir de la estructura molecular)
- Lista de gases incluyendo puntos de ebullición
- Punto de fusión
- Subenfriamiento
- Sobrecalentamiento
- Constante de Trouton que relaciona el calor latente con el punto de ebullición
- Punto triple
Referencias
- ^ Goldberg, David E. (1988). 3000 problemas resueltos de química (1.ª ed.). McGraw-Hill, sección 17.43, pág. 321. ISBN 0-07-023684-4.
- ^ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, eds. (1999). Prevención de la contaminación: el enfoque de gestión de residuos para el siglo XXI . CRC Press. Sección 27, pág. 15. ISBN 1-56670-495-2.
- ^ "Punto de ebullición del agua y altitud". www.engineeringtoolbox.com .
- ^ Glosario de química general Página web de la Universidad de Purdue
- ^ Reel, Kevin R.; Fikar, RM; Dumas, PE; Templin, Jay M. y Van Arnum, Patricia (2006). AP Chemistry (REA) – The Best Test Prep for the Advanced Placement Exam (9.ª ed.). Asociación de Investigación y Educación. Sección 71, pág. 224. ISBN 0-7386-0221-3.
- ^ ab Cox, JD (1982). "Notación para estados y procesos, significado de la palabra estándar en termodinámica química y observaciones sobre formas tabuladas comúnmente de funciones termodinámicas". Química pura y aplicada . 54 (6): 1239–1250. doi : 10.1351/pac198254061239 .
- ^ Presión estándar La IUPAC define la "presión estándar" como 10 5 Pa (que equivale a 1 bar).
- ^ Apéndice 1: Tablas y gráficos de propiedades (unidades del SI). Desplácese hacia abajo hasta la Tabla A-5 y lea el valor de temperatura de 99,61 °C a una presión de 100 kPa (1 bar). Obtenido del sitio web de Educación Superior de McGraw-Hill.
- ^ West, JB (1999). "Presiones barométricas en el monte Everest: nuevos datos y significado fisiológico". Journal of Applied Physiology . 86 (3): 1062–6. doi :10.1152/jappl.1999.86.3.1062. PMID 10066724. S2CID 27875962.
- ^ Perry, RH; Green, DW, eds. (1997). Manual de ingenieros químicos de Perry (7.ª ed.). McGraw-Hill. ISBN 0-07-049841-5.
- ^ DeVoe, Howard (2000). Termodinámica y química (1.ª ed.). Prentice-Hall. ISBN 0-02-328741-1.
Enlaces externos
- . . 1914.







