Hemidesmosoma
| Hemidesmosoma | |
|---|---|
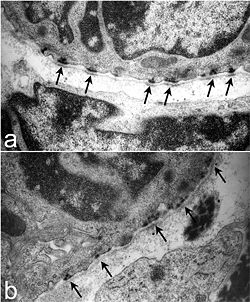 Ultraestructura de los hemidesmosomas traqueales en ratones. En un ratón normal (a) hay hemidesmosomas bien definidos y organizados con áreas oscuras en la lámina densa que linda con el hemidesmosoma (flechas). En contraste, los hemidesmosomas en las tráqueas Lamc2 -/- (b) están menos organizados, el componente intracelular es más difuso y la lámina densa directamente debajo de las áreas hemidesmosómicas carece de la densidad electrónica observada en el control de la camada (flechas). De Nguyen et al., 2006. [1] | |
| Detalles | |
| Identificadores | |
| latín | hemidesmosoma |
| Malla | D022002 |
| El | H1.00.01.1.02029 |
| FMA | 67415 |
| Terminología anatómica [editar en Wikidata] | |
Los hemidesmosomas son estructuras muy pequeñas con forma de tachuela que se encuentran en los queratinocitos de la epidermis de la piel y que se adhieren a la matriz extracelular . Tienen una forma similar a los desmosomas cuando se visualizan mediante microscopía electrónica ; sin embargo, los desmosomas se adhieren a las células adyacentes. Los hemidesmosomas también son comparables a las adherencias focales , ya que ambos unen las células a la matriz extracelular. En lugar de desmogleínas y desmocolinas en el espacio extracelular, los hemidesmosomas utilizan integrinas . Los hemidesmosomas se encuentran en las células epiteliales que conectan las células epiteliales basales con la lámina lúcida , que es parte de la lámina basal . [2] Los hemidesmosomas también están involucrados en las vías de señalización, como la migración de queratinocitos o la intrusión de células carcinomatosas . [3]
Estructura
Los hemidesmosomas se pueden clasificar en dos tipos según sus constituyentes proteicos. Los hemidesmosomas de tipo 1 se encuentran en el epitelio estratificado y pseudoestratificado . Los hemidesmosomas de tipo 1 tienen cinco elementos principales: integrina α6 β4 , plectina en su isoforma 1a, es decir P1a, proteína tetraspanina CD151 , BPAG1e o isoforma e del antígeno del penfigoide ampolloso, y BPAG2 (también conocido como BP180 o colágeno tipo 17). [2] Los hemidesmosomas de tipo 1 se encuentran en el tejido epitelial estratificado y pseudoestratificado. Los hemidesmosomas de tipo 2 contienen integrina α6β4 y plectina sin los antígenos BP. [4]
Los hemidesmosomas tienen dos componentes que atraviesan la membrana: la integrina α6β4 y BPAG2. La integrina α6β4 funciona como un receptor de laminina-332 . La integrina α6β4 está compuesta por dos dímeros de subunidades α y β. La subunidad β4, más grande, tiene dominios que se unen a la fibronectina III y al calcio. La subunidad α6 se une a BP180, CD151 y laminina-322 extracelulares. Cuando la integrina α6β4 se une a la plectina 1a y BPAG1, se asocia con los filamentos intermedios de queratina en el citoesqueleto. [2]
Los hemidesmosomas están unidos a la queratina por la isoforma 1a de plectina de la familia de proteínas plaquinas . La plectina es una proteína de 500 kDa con un dominio largo en forma de varilla y un dominio en el extremo que contiene un sitio de unión de filamento intermedio. BPAG2, o (antígeno del penfigoide ampolloso 2), es una proteína transmembrana que existe adyacente a las integrinas, BPAG2 tiene dominios que se unen a la plectina, la subunidad β4 de la integrina en el citoplasma y la integrina α6 y la laminina-332 en el espacio extracelular. CD151, una proteína de la superfamilia de las tetraspaninas , reside en la superficie celular de los queratinocitos y el endotelio vascular . CD151 ayuda en la formación de hemidesmosomas. BPAG1e es un antígeno con múltiples isoformas que se une a la integrina α6β4, BPAG2 y la queratina 5 y 14 . La función principal de BPAG1e es la estabilidad del hemidesmosoma. [2]
Enfermedades
Mantener los queratinocitos epidérmicos basales adheridos a la lámina basal es vital para la homeostasis de la piel . Las enfermedades genéticas o adquiridas que causan la alteración de los componentes del hemidesmosoma pueden provocar trastornos de formación de ampollas en la piel entre las diferentes capas de la piel. Estos trastornos se denominan colectivamente epidermólisis ampollosa o EB. Los síntomas típicos incluyen piel frágil, desarrollo de ampollas y erosión por estrés físico leve. [2] Sin embargo, la enfermedad también puede manifestarse como erosiones en la córnea, la tráquea, el tracto gastrointestinal, el esófago, distrofia muscular y deformidad muscular. [5]
Las mutaciones en 12 genes diferentes que codifican partes del hemidesmosoma han dado lugar a la epidermólisis ampollosa. [6] Hay tres tipos de EB: EB simple (EBS), EB distrófica (DEB) y EB de unión (JEB). En la epidermólisis ampollosa simple, las capas de la epidermis se separan. La EBS está causada por mutaciones que codifican queratina, plectina y BPAG1e. Con la epidermólisis ampollosa de unión, las capas de la lámina lúcida (parte de la lámina basal) se separan. Esto es causado por mutaciones en la integrina α6β4, laminina 322 y BPAG2. En la epidermólisis ampollosa distrófica, las capas de la dermis papilar se separan de las fibrillas de anclaje . Esto es causado por mutaciones en el gen del colágeno 7 .
Véase también
Referencias
- ^ Nguyen NM, Pulkkinen L, Schlueter JA, Meneguzzi G, Uitto J, Senior RM (2006). "Desarrollo pulmonar en la deficiencia de laminina γ2: hemidesmosomas traqueales anormales con morfogénesis de ramificación normal y diferenciación epitelial". Respir. Res. 7 (1): 28. doi : 10.1186/1465-9921-7-28 . PMC 1386662 . PMID 16483354.
- ^ abcdeWalko, Gernot; Castañón, María J.; Wiche, Gerhard (mayo de 2015). "Arquitectura molecular y función del hemidesmosoma". Investigación de células y tejidos . 360 (2): 363–378. doi :10.1007/s00441-014-2061-z. ISSN 1432-0878. PMC 4544487 . PMID 25487405.
- ^ Wilhelmsen, Kevin; Litjens, Sandy HM; Sonnenberg, Arnoud (abril de 2006). "Múltiples funciones de la integrina alfa6beta4 en la homeostasis epidérmica y la tumorigénesis". Biología molecular y celular . 26 (8): 2877–2886. doi :10.1128/MCB.26.8.2877-2886.2006. ISSN 0270-7306. PMC 1446957 . PMID 16581764.
- ^ Fontao, L.; Stutzmann, J.; Gendry, P.; Launay, JF (1999-08-01). "Regulación del ensamblaje de la placa hemidesmosómica tipo II en células epiteliales intestinales". Experimental Cell Research . 250 (2): 298–312. doi :10.1006/excr.1999.4549. ISSN 0014-4827. PMID 10413585.
- ^ Bardhan, Ajoy; Bruckner-Tuderman, Leena; Chapple, Iain LC; Fine, Jo-David; Harper, Natasha; Has, Cristina; Magin, Thomas M.; Marinkovich, M. Peter; Marshall, John F.; McGrath, John A.; Mellerio, Jemima E. (24 de septiembre de 2020). "Epidermólisis ampollosa". Nature Reviews Disease Primers . 6 (1): 78. doi :10.1038/s41572-020-0210-0. ISSN 2056-676X. PMID 32973163. S2CID 221861310.
- ^ Fine, Jo-David; Bruckner-Tuderman, Leena; Eady, Robin AJ; Bauer, Eugene A.; Bauer, Johann W.; Has, Cristina; Heagerty, Adrian; Hintner, Helmut; Hovnanian, Alain (junio de 2014). "Epidermólisis ampollosa hereditaria: recomendaciones actualizadas sobre diagnóstico y clasificación". Revista de la Academia Estadounidense de Dermatología . 70 (6): 1103–1126. doi : 10.1016/j.jaad.2014.01.903 . ISSN 1097-6787. PMID 24690439.
