Exploración con galio
| Exploración con galio-67 | |
|---|---|
| Sinónimos | Imágenes con galio |
| CIE-10-PCS | C?1?LZZ (planar) C?2?LZZ (tomográfico) |
| CIE-9-CM | 92,18 |
| Código OPS-301 | 3-70 °C |
| MedlinePlus | 003450 |
Una gammagrafía con galio es un tipo de prueba de medicina nuclear que utiliza un radiofármaco galio-67 ( 67 Ga) o galio-68 ( 68 Ga) para obtener imágenes de un tipo específico de tejido o estado patológico del tejido. Se pueden utilizar sales de galio como el citrato de galio y el nitrato de galio . La forma de la sal no es importante, ya que es el ion galio disuelto libremente Ga 3+ el que está activo. [1] Tanto las sales de 67 Ga como las de 68 Ga tienen mecanismos de captación similares. [2] El galio también se puede utilizar en otras formas, por ejemplo, el 68 Ga-PSMA se utiliza para la obtención de imágenes de cáncer . La emisión gamma del galio-67 se obtiene mediante una cámara gamma , mientras que la emisión de positrones del galio-68 se obtiene mediante tomografía por emisión de positrones (PET).
Las sales de galio son absorbidas por tumores, inflamaciones e infecciones agudas y crónicas, [3] [4] lo que permite obtener imágenes de estos procesos patológicos. El galio es particularmente útil para obtener imágenes de osteomielitis que afecta la columna vertebral y para obtener imágenes de infecciones más antiguas y crónicas que pueden ser la causa de una fiebre de origen desconocido . [5] [6]
Las exploraciones DOTA con galio-68 están reemplazando cada vez más a las exploraciones con octreotida (un tipo de exploración con indio-111 que utiliza octreotida como ligando del receptor de somatostatina). El galio-68 está unido a un derivado químico del octreotida, como el DOTATOC , y los positrones que emite se visualizan mediante una exploración PET-CT . Estas exploraciones son útiles para localizar tumores neuroendocrinos y cáncer de páncreas . [7] [8]
Exploración con citrato de galio
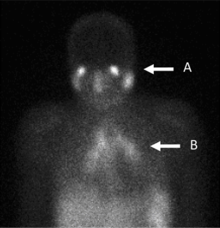
En el pasado, la gammagrafía con galio era el método de referencia para la estadificación del linfoma , hasta que fue reemplazada por la tomografía por emisión de positrones (PET) con fludesoxiglucosa (FDG). [9] [10] La gammagrafía con galio todavía se utiliza para obtener imágenes de inflamaciones e infecciones crónicas , y a veces todavía localiza tumores insospechados, ya que es absorbido por muchos tipos de células cancerosas en cantidades que superan las de los tejidos normales. Por lo tanto, una mayor absorción de galio-67 puede indicar una infección nueva o antigua, un foco inflamatorio de cualquier causa o un tumor canceroso.
Se ha sugerido que la obtención de imágenes con galio puede convertirse en una técnica obsoleta, siendo reemplazada por la obtención de imágenes de leucocitos con indio y anticuerpos antigranulocitos con tecnecio como mecanismo de detección de infecciones. Para la detección de tumores , especialmente linfomas, la obtención de imágenes con galio todavía se utiliza, pero puede ser reemplazada por la obtención de imágenes PET con fludesoxiglucosa en el futuro. [11]
En el caso de las infecciones, la gammagrafía con galio tiene una ventaja sobre la gammagrafía con leucocitos de indio para la obtención de imágenes de osteomielitis (infección ósea) de la columna vertebral, infecciones e inflamaciones pulmonares y para infecciones crónicas. En parte, esto se debe a que el galio se une a las membranas de los neutrófilos , incluso después de su muerte. La gammagrafía con leucocitos de indio es mejor para las infecciones agudas (en las que los neutrófilos todavía se localizan de forma rápida y activa en la infección), y también para la osteomielitis que no afecta a la columna vertebral, y para las infecciones abdominales y pélvicas . Tanto la gammagrafía con galio como la gammagrafía con leucocitos de indio pueden utilizarse para obtener imágenes de fiebre de origen desconocido (temperatura elevada sin explicación). Sin embargo, la gammagrafía con leucocitos de indio solo permite obtener imágenes del 25 % de los casos que son causados por infecciones agudas, mientras que el galio también permite localizar otras fuentes de fiebre, como infecciones crónicas y tumores. [12] [13]
Mecanismo
El cuerpo generalmente maneja el Ga 3+ como si fuera hierro férrico (Fe-III), y por lo tanto el ion isótopo libre se une (y se concentra) en áreas de inflamación, como un sitio de infección, y también áreas de división celular rápida. [14] El galio (III) (Ga 3+ ) se une a la transferrina , la lactoferrina leucocitaria , los sideróforos bacterianos , las proteínas inflamatorias y las membranas celulares de los neutrófilos, tanto vivos como muertos. [15]
La lactoferrina se encuentra en los leucocitos. El galio puede unirse a la lactoferrina y ser transportado a sitios de inflamación, o unirse a la lactoferrina liberada durante la fagocitosis bacteriana en sitios de infección (y permanece debido a la unión con los receptores de macrófagos ). [16] El galio-67 también se une a las moléculas sideróforas de las propias bacterias, y por esta razón se puede utilizar en pacientes leucopénicos con infección bacteriana (en este caso se une directamente a las proteínas bacterianas y no se necesitan leucocitos). [17] Se cree que la captación está asociada con una variedad de propiedades tumorales, incluidos los receptores de transferencia, el metabolismo tumoral anaeróbico y la perfusión tumoral y la permeabilidad vascular . [18] [19]
Indicaciones comunes
- Estudio de cuerpo entero para localizar el origen de la fiebre en pacientes con fiebre de origen desconocido. [20]
- Detección de inflamación/infección pulmonar y mediastínica , especialmente en pacientes inmunodeprimidos . [21]
- Evaluación y seguimiento de procesos inflamatorios linfocíticos o granulomatosos activos como la sarcoidosis o la tuberculosis . [22]
- Diagnóstico de osteomielitis vertebral y/o infección del espacio discal donde se prefiere el galio-67 a los leucocitos marcados.
- Diagnóstico y seguimiento del tratamiento médico de la fibrosis retroperitoneal .
- Evaluación y seguimiento de la toxicidad pulmonar inducida por fármacos (p. ej., bleomicina, amiodarona)
- Evaluación de pacientes que no son candidatos para exploración con leucocitos (recuento de leucocitos inferior a 6000).
Tenga en cuenta que todas estas condiciones también se observan en las exploraciones PET que utilizan galio-68.
Técnica
La técnica principal ( 67 Ga) utiliza la gammagrafía para producir imágenes bidimensionales. Después de que se ha inyectado el trazador, las imágenes se toman típicamente con una cámara gamma a las 24, 48 y, en algunos casos, 72 y 96 horas más tarde. [23] [24] Cada conjunto de imágenes demora entre 30 y 60 minutos, según el tamaño del área que se está fotografiando. La imagen resultante tendrá áreas brillantes que recolectaron grandes cantidades de trazador, porque hay inflamación presente o está ocurriendo una división celular rápida. También se pueden adquirir imágenes de tomografía computarizada por emisión de fotón único (SPECT). En algunos centros de imágenes, las imágenes SPECT se pueden combinar con una tomografía computarizada (TC) utilizando software de fusión o cámaras híbridas SPECT/TC para superponer tanto la información de la imagen fisiológica de la exploración con galio como la información anatómica de la tomografía computarizada.
Una dosis de inyección común es de alrededor de 150 megabecquerels . [25] Las imágenes no deben realizarse antes de las 24 horas, ya que un fondo alto en este momento produce falsos negativos. Las imágenes de cuerpo entero de cuarenta y ocho horas son apropiadas. Las imágenes diferidas se pueden obtener incluso 1 semana o más después de la inyección si el intestino es un factor de confusión. La SPECT se puede realizar según sea necesario. Se pueden administrar laxantes orales o enemas antes de las imágenes para reducir la actividad intestinal y reducir la dosis en el intestino grueso; sin embargo, la utilidad de la preparación intestinal es controvertida. [24]
Entre el 10% y el 25% de la dosis de galio-67 se excreta en las 24 horas siguientes a la inyección (la mayor parte se excreta por los riñones). Después de 24 horas, la principal vía excretora es el colon. [24] El "órgano diana" (órgano que recibe la mayor dosis de radiación en la exploración media) es el colon (intestino grueso). [23]
En una exploración normal, la captación de galio se observa en una amplia variedad de lugares que no indican un hallazgo positivo. Estos suelen incluir tejidos blandos, hígado y huesos. Otros sitios de localización pueden ser las glándulas nasofaríngeas y lagrimales , las mamas (particularmente en la lactancia o el embarazo ), las heridas que cicatrizan normalmente, los riñones, la vejiga y el colon. [26]
Exploración con galio y PSMA

El isótopo emisor de positrones, 68 Ga, se puede utilizar para detectar el antígeno de membrana específico de la próstata (PSMA), una proteína presente en las células del cáncer de próstata . Se ha demostrado que la técnica mejora la detección de la enfermedad metastásica en comparación con las exploraciones por resonancia magnética o tomografía computarizada . [27]
En diciembre de 2020, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el 68 Ga PSMA-11 para uso médico en los Estados Unidos. [28] [29] Está indicado para la tomografía por emisión de positrones (PET) de lesiones positivas al antígeno de membrana específico de la próstata (PSMA) en hombres con cáncer de próstata. [30] [29] Es fabricado por la Instalación de Ciclotrones Biomédicos de la UCLA. [29] La FDA aprobó el 68 Ga PSMA-11 basándose en la evidencia de dos ensayos clínicos (Ensayo 1/NCT0336847 idéntico a NCT02919111 y Ensayo 2/NCT02940262 idéntico a NCT02918357) de participantes masculinos con cáncer de próstata. [29] A algunos participantes se les diagnosticó recientemente cáncer de próstata. [29] Otros participantes fueron tratados antes, pero existía la sospecha de que el cáncer se estaba propagando debido al aumento del antígeno prostático específico o PSA. [29] Los ensayos se llevaron a cabo en dos sitios de los Estados Unidos. [29]
La FDA considera que el 68 Ga PSMA-11 es un medicamento de primera clase . [31]
Indicaciones comunes
La gammagrafía con galio y PSMA se recomienda principalmente en casos de recurrencia bioquímica del cáncer de próstata, en particular en pacientes con valores bajos de PSA y en pacientes con enfermedad de alto riesgo en los que se considera probable la presencia de metástasis. [32] [33]
Técnica
Se recomienda la administración intravenosa de 1,8 a 2,2 megabecquerelios de 68 Ga PSMA-11 por kilogramo de peso corporal. Las imágenes deben comenzar aproximadamente 60 minutos después de la administración con una adquisición desde la mitad del muslo hasta la base del cráneo. [32] [34]
Escaneos de galio DOTA
Los péptidos conjugados con 68 Ga DOTA (incluidos 68 Ga DOTA-TATE , DOTA-TOC y DOTA-NOC) se utilizan en la tomografía por emisión de positrones (PET) de tumores neuroendocrinos (NET). La exploración es similar a la exploración SPECT con octreótido en que se utiliza un análogo de la somatostatina basado en octreótido (como edotreótido ) como radioligando , y existen indicaciones y usos similares a los de las exploraciones con octreótido, sin embargo, la calidad de la imagen mejora significativamente. [35] Los receptores de somatostatina se sobreexpresan en muchos NET, de modo que el péptido conjugado con 68 Ga DOTA se capta preferentemente en estas ubicaciones y se visualiza en la exploración. [36] Además del diagnóstico y la estadificación de los NET, la obtención de imágenes con péptido conjugado con 68 Ga DOTA se puede utilizar para la planificación y la dosimetría en preparación para la terapia con lutecio -177 o itrio-90 DOTA . [37] [38]
En junio de 2016, Netspot (kit para la preparación de inyección de dotatato de galio Ga-68) fue aprobado para uso médico en los Estados Unidos. [39] [40]
En agosto de 2019, la inyección de 68 Ga edotreótido ( 68 Ga DOTATOC) fue aprobada para uso médico en los Estados Unidos para su uso con imágenes PET para la localización de tumores neuroendocrinos (NET) positivos para el receptor de somatostatina en adultos y niños. [41] [42] [43]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el 68 Ga edotreótido (DOTATOC) basándose en la evidencia de tres ensayos clínicos (ensayo 1/NCT#1619865, ensayo 2/NCT#1869725, ensayo 3/NCT#2441062) de 334 tumores neuroendocrinos conocidos o sospechosos. [42] Los ensayos se llevaron a cabo en los Estados Unidos. [42]
El oxodotreótido de galio ( 68 Ga) fue aprobado para uso médico en Canadá como Netspot en julio de 2019, [44] y como Netvision en mayo de 2022. [45]
La combinación de cloruro de germanio (68Ge) / cloruro de galio (68Ga) fue aprobada para uso médico en la Unión Europea en agosto de 2024. [46]
Radioquímica del galio-67
El citrato de galio-67 se produce mediante un ciclotrón. El bombardeo de partículas cargadas de Zn-68 enriquecido se utiliza para producir galio-67. Luego, el galio-67 se compleja con ácido cítrico para formar citrato de galio. La vida media del galio-67 es de 78 horas. [47] Se desintegra por captura de electrones y luego emite rayos gamma de desexcitación que son detectados por una cámara gamma. La emisión primaria es a 93 keV (abundancia del 39 %), seguida de 185 keV (21 %) y 300 keV (17 %). [48] : 64 Para la obtención de imágenes, se utilizan múltiples ventanas de energía de la cámara gamma, generalmente centradas alrededor de 93 y 184 keV o 93, 184 y 296 keV. [24]
Radioquímica del galio-68
El galio-68 , que tiene una vida media de 68 minutos, se produce en un generador de galio-68 por desintegración de germanio-68 con una vida media de 271 días o por irradiación de zinc-68 a través de un ciclotrón de baja energía. El uso de un generador significa que se puede producir fácilmente un suministro de 68 Ga con una infraestructura mínima, por ejemplo en sitios sin un ciclotrón , comúnmente utilizado para producir otros isótopos PET. Se desintegra por emisión de positrones y captura de electrones en zinc-68. [49] La energía máxima de emisión de positrones es de 1,9 MeV. [48] : 65
Referencias
- ^ Treves ST (2014). Medicina nuclear pediátrica e imágenes moleculares (4.ª ed.). Springer. pág. 480. ISBN 9781461495512.
- ^ Jain SK (2017). Infecciones por imágenes: del laboratorio al paciente. Springer. pág. 34. ISBN 9783319545929Archivado desde el original el 21 de febrero de 2022 . Consultado el 23 de junio de 2017 .
- ^ Verberne SJ y OPP Temmerman (2017). 12 - Diagnóstico por imágenes de infecciones articulares protésicas Archivado el 21 de febrero de 2022 en Wayback Machine. - Arts, JJ Chris. Manejo de las infecciones articulares periprotésicas (IAP). J. Geurts, Woodhead Publishing: 259-285.
- ^ Verberne SJ, Raijmakers PG, Temmerman O (2016). "La precisión de las técnicas de diagnóstico por imágenes en la evaluación de la infección periprotésica de cadera: una revisión sistemática y un metaanálisis". The Journal of Bone and Joint Surgery. Volumen estadounidense . 98 (19): 1638–1645. doi :10.2106/jbjs.15.00898. PMID 27707850. S2CID 9202184. Archivado desde el original el 16 de diciembre de 2016. Consultado el 18 de diciembre de 2016 .
- ^ Termaat MF, Raijmakers PG, Scholten HJ, Bakker FC, Patka P, Haarman HJ (noviembre de 2005). "La precisión de las imágenes diagnósticas para la evaluación de la osteomielitis crónica: una revisión sistemática y un metanálisis". The Journal of Bone and Joint Surgery. American Volumen . 87 (11): 2464–71. doi :10.2106/JBJS.D.02691. PMID 16264122. S2CID 26280068.
- ^ Becker W (octubre de 1995). "La contribución de la medicina nuclear al paciente con infección". Revista Europea de Medicina Nuclear . 22 (10): 1195–1211. doi :10.1007/BF00800606. PMID 8542906. S2CID 19293222.
- ^ Hofman M, Kong G, Neels O, Eu P, Hong E, Hicks R (2012). "Alto impacto en el manejo de la PET/CT con Ga-68 DOTATATE (GaTate) para la obtención de imágenes de tumores neuroendocrinos y otros tumores que expresan somatostatina". Revista de imágenes médicas y oncología radioterápica . 56 (1): 40–47. doi : 10.1111/j.1754-9485.2011.02327.x . PMID 22339744. S2CID 21843609.
- ^ Scott, A, Howe J (2018). "Manejo de tumores neuroendocrinos del intestino delgado". Revista de práctica oncológica . 14 (8): 471–482. doi :10.1200/JOP.18.00135. PMC 6091496 . PMID 30096273.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Bryan RN (2010). Introducción a la ciencia de la imagenología médica. Cambridge: Cambridge University Press. pág. 200. ISBN 9780521747622Archivado desde el original el 21 de febrero de 2017 . Consultado el 20 de febrero de 2017 .
- ^ Bleeker-Rovers CP, Vos FJ, van der Graaf WT, Oyen WJ (16 de junio de 2011). "Imágenes de medicina nuclear de infecciones en pacientes con cáncer (con énfasis en FDG-PET)". The Oncologist . 16 (7): 980–991. doi :10.1634/theoncologist.2010-0421. PMC 3228133 . PMID 21680576.
- ^ Ziessman HA, O'Malley JP, Thrall JH (2013). Medicina nuclear: requisitos básicos. Libro electrónico. Elsevier Health Sciences. pág. 281. ISBN. 978-0323112925.
- ^ Palestro CJ (abril de 1994). "El papel actual de la obtención de imágenes con galio en las infecciones". Seminarios de medicina nuclear . 24 (2): 128–141. doi :10.1016/S0001-2998(05)80227-2. PMID 8023169.
- ^ Shields TW, LoCicero J, Reed CE, Feins RH (2009). Cirugía torácica general. Lippincott Williams & Wilkins. pág. 2106. ISBN 9780781779821.
- ^ Love C, Palestro CJ (junio de 2004). «Radionuclide imaging of infection» (Imágenes de infecciones mediante radionúclidos). Journal of Nuclear Medicine Technology . 32 (2): 47–57, cuestionario 58–9. PMID 15175400. Archivado desde el original el 7 de noviembre de 2016. Consultado el 20 de febrero de 2017 .
- ^ Tsan MF (enero de 1985). "Mecanismo de acumulación de galio-67 en lesiones inflamatorias". Revista de Medicina Nuclear . 26 (1): 88–92. PMID 3880816.
- ^ Greenberg AM, Prein J (2007). Principios de fijación interna en cirugía reconstructiva y correctiva ósea craneomaxilofacial utilizando la técnica AO/ASIF . Nueva York: Springer. p. 79. ISBN 9780387224275.
- ^ Weiner R (1996). "El mecanismo de localización del 67Ga en enfermedades malignas". Medicina nuclear y biología . 23 (6): 745–751. doi :10.1016/0969-8051(96)00119-9. PMID 8940716.
- ^ Biersack HJ, Freeman LM (2007). Medicina nuclear clínica . Berlín: Springer. p. 324. ISBN 978-3-540-28026-2.
- ^ Hoffer P (1980). «Galio: mecanismos». Journal of Nuclear Medicine . 21 (3): 282–5. PMID 6988551. Archivado desde el original el 7 de julio de 2022. Consultado el 20 de febrero de 2017 .
- ^ "Gammagrafía con galio". MedlinePlus . Archivado desde el original el 14 de septiembre de 2017 . Consultado el 14 de septiembre de 2017 .
- ^ "Parámetro de práctica ACR–SPR para la realización de gammagrafía en casos de inflamación e infección" (PDF) . American College of Radiology . 2014. Archivado desde el original (PDF) el 16 de octubre de 2015 . Consultado el 14 de septiembre de 2017 .
- ^ "Gammagrafía pulmonar con galio". MedlinePlus . Archivado desde el original el 14 de septiembre de 2017 . Consultado el 14 de septiembre de 2017 .
- ^ ab Bombardieri E, Aktolun C, Baum RP, Bishof-Delaloye A, Buscombe J, Chatal JF, et al. (2 de septiembre de 2003). "Pautas para el procedimiento de gammagrafía 67Ga para imágenes de tumores" (PDF) . EANM . Archivado (PDF) desde el original el 26 de octubre de 2020 . Consultado el 14 de septiembre de 2017 .
- ^ abcd "Guía de procedimiento de la Sociedad de Medicina Nuclear para la gammagrafía con galio en la inflamación" (PDF) . SNMMI . 2 de junio de 2004. Archivado (PDF) desde el original el 21 de octubre de 2016 . Consultado el 7 de septiembre de 2016 .
- ^ "Notas de orientación sobre la administración clínica de radiofármacos y el uso de fuentes radiactivas selladas" (PDF) . Comité Asesor sobre la Administración de Sustancias Radiactivas. Enero de 2016. Archivado (PDF) desde el original el 24 de septiembre de 2016 . Consultado el 7 de septiembre de 2016 .
- ^ Palestro CJ (2012). "SPECT y PET en la evaluación de infecciones óseas". En Fogelman I, Gnanasegaran G, van der Wall H (eds.). Radionúclidos e imágenes óseas híbridas . Berlín: Springer. págs. 523–559. doi :10.1007/978-3-642-02400-9_20. ISBN 978-3-642-02399-6.
- ^ Maurer T, Eiber M, Schwaiger M, Gschwend JE (23 de febrero de 2016). "Uso actual de PSMA-PET en el tratamiento del cáncer de próstata". Nature Reviews Urology . 13 (4): 226–235. doi :10.1038/nrurol.2016.26. PMID 26902337. S2CID 2448922.
- ^ "Paquete de aprobación de medicamentos: galio Ga 68 PSMA-11". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 16 de diciembre de 2020. Archivado desde el original el 26 de enero de 2021. Consultado el 25 de diciembre de 2020 .
- ^ abcdefg «Instantánea de ensayos de fármacos: Ga 68 PSMA-11». Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 1 de diciembre de 2020. Archivado desde el original el 10 de diciembre de 2020. Consultado el 11 de diciembre de 2020 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Etiquetado de GALLIUM GA 68 PSMA-11: prospecto" (PDF) . Drugs@FDA . Universidad de California, Los Ángeles. 17 de noviembre de 2021. Archivado (PDF) del original el 13 de mayo de 2022 . Consultado el 18 de marzo de 2022 .
- ^ "Aprobaciones de nuevos fármacos terapéuticos 2020". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 31 de diciembre de 2020. Archivado desde el original el 18 de enero de 2021. Consultado el 17 de enero de 2021 .
- ^ ab Fendler WP, Eiber M, Beheshti M, Bomanji J, Ceci F, Cho S, et al. (10 de marzo de 2017). "68Ga-PSMA PET/CT: guía de procedimiento conjunta de EANM y SNMMI para la obtención de imágenes de cáncer de próstata: versión 1.0". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 44 (6): 1014–1024. doi :10.1007/s00259-017-3670-z. PMID 28283702. S2CID 5882407.
- ^ Rai BP, Baum RP, Patel A, Hughes R, Alonzi R, Lane T, et al. (septiembre de 2016). "El papel de la tomografía por emisión de positrones con antígeno de membrana específico de la próstata marcado con galio (Ga) 68 (PSMA) en el tratamiento de pacientes con cáncer de próstata confinado en el órgano y localmente avanzado antes del tratamiento radical y después de la prostatectomía radical". Urology . 95 : 11–15. doi :10.1016/j.urology.2015.12.048. PMID 26790588.
- ^ Afaq A, Batura D, Bomanji J (14 de febrero de 2017). "Nuevas fronteras en la obtención de imágenes del cáncer de próstata: utilidad clínica de la tomografía por emisión de positrones con antígeno de membrana específico de la próstata". Urología y Nefrología Internacional . 49 (5): 803–810. doi :10.1007/s11255-017-1541-y. PMID 28197764. S2CID 3902900.
- ^ Mojtahedi A, Thamake S, Tworowska I, Ranganathan D, Delpassand ES (15 de agosto de 2014). "El valor de la PET/CT con 68Ga-DOTATATE en el diagnóstico y tratamiento de tumores neuroendocrinos en comparación con las modalidades de diagnóstico por imágenes aprobadas por la FDA: una revisión de la literatura". American Journal of Nuclear Medicine and Molecular Imaging . 4 (5): 426–434. ISSN 2160-8407. PMC 4138137 . PMID 25143861.
- ^ Virgolini I, Ambrosini V, Bomanji JB, Baum RP, Fanti S, Gabriel M, et al. (2 de julio de 2010). "Pautas de procedimiento para la obtención de imágenes de tumores mediante PET/CT con péptidos conjugados con 68Ga-DOTA: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE" (PDF) . Revista Europea de Medicina Nuclear e Imágenes Molecular . 37 (10): 2004–2010. doi :10.1007/s00259-010-1512-3. PMID 20596866. S2CID 11469889. Archivado (PDF) del original el 17 de mayo de 2017 . Consultado el 6 de octubre de 2017 .
- ^ Kam BL, Teunissen JJ, Krenning EP, de Herder WW, Khan S, van Vliet EI, et al. (3 de marzo de 2012). "Péptidos marcados con lutecio para la terapia de tumores neuroendocrinos". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 39 (S1): 103–112. doi :10.1007/s00259-011-2039-y. PMC 3304065 . PMID 22388631.
- ^ Taïeb D, Garrigue P, Bardiès M, Abdullah AE, Pacak K (octubre de 2015). "Aplicación y requisitos dosimétricos para análogos de somatostatina marcados con galio-68 en terapia dirigida con radionúclidos para tumores neuroendocrinos gastroenteropancreáticos". Clínicas PET . 10 (4): 477–486. doi :10.1016/j.cpet.2015.06.001. PMC 4617555 . PMID 26384594.
- ^ "Netspot (kit para la preparación de inyección de galio Ga 68 dotatato)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 21 de junio de 2016. Archivado desde el original el 31 de marzo de 2021. Consultado el 18 de octubre de 2020 .
- Resumen para legos en: "Revisión del resumen: Número de solicitud: 208547Orig1s000" (PDF) . Centro de Evaluación e Investigación de Medicamentos . 30 de mayo de 2016.
- ^ "Kit Netspot- 68ga-dotatate". DailyMed . 23 de octubre de 2019. Archivado desde el original el 22 de septiembre de 2020 . Consultado el 18 de octubre de 2020 .
- ^ "GA-68-DOTATOC- inyección de galio ga-68 de edotreótido, solución". DailyMed . 3 de septiembre de 2019. Archivado desde el original el 7 de julio de 2022 . Consultado el 17 de marzo de 2020 .
- ^ abc «Instantáneas de ensayos de fármacos: Ga-68-DOTATOC». Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 21 de agosto de 2019. Archivado desde el original el 13 de diciembre de 2019. Consultado el 17 de marzo de 2020 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ "Paquete de aprobación de medicamentos: Dotatoc GA 68 de galio". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 23 de septiembre de 2019. Archivado desde el original el 6 de abril de 2021. Consultado el 18 de octubre de 2020 .
- ^ "Base resumida de la decisión (SBD) para Netspot". Health Canada . 23 de octubre de 2014. Archivado desde el original el 31 de mayo de 2022. Consultado el 29 de mayo de 2022 .
- ^ "Base resumida de la decisión - NETVision". Health Canada . 26 de mayo de 2022. Archivado desde el original el 7 de julio de 2022 . Consultado el 7 de julio de 2022 .
- ^ "GalliaPharm EPAR". Agencia Europea de Medicamentos (EMA) . 1 de agosto de 2024. Consultado el 26 de agosto de 2024 .
- ^ OIEA (2009). Radionucleidos producidos por ciclotrón: características físicas y métodos de producción (PDF) . Viena: Organismo Internacional de Energía Atómica. p. 116. ISBN 9789201069085. Archivado (PDF) del original el 9 de marzo de 2017 . Consultado el 7 de septiembre de 2016 .
- ^ ab Delacroix D, Guerre JP, Leblanc P, Hickman C (2002). Manual de datos sobre radionúclidos y protección radiológica (2.ª ed.). Ashford: Nuclear Technology Publishing. ISBN 978-1870965873.
- ^ Bé MM, Chisté V, Mougeot X, Chechev V, Kondev F, Nichols AL, et al. (2013). Monografía BIPM: Tabla de radionucleidos vol. 7. París: Bureau International des Poids et Mesures. pag. 33.ISBN 9789282222485Archivado desde el original el 23 de agosto de 2017 . Consultado el 14 de septiembre de 2017 .
