Beta termodinámica
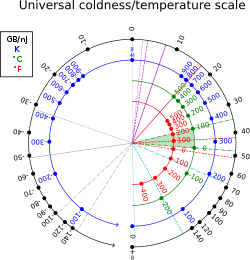
En termodinámica estadística , la beta termodinámica , también conocida como frialdad , [1] es el recíproco de la temperatura termodinámica de un sistema: (donde T es la temperatura y k B es la constante de Boltzmann ). [2]
La beta termodinámica tiene unidades recíprocas a las de la energía (en unidades del SI , julios recíprocos , ). En unidades no térmicas, también se puede medir en bytes por julio, o más convenientemente, gigabytes por nanojulio; [3] 1 K −1 es equivalente a aproximadamente 13.062 gigabytes por nanojulio; a temperatura ambiente: T = 300 K, β ≈44 GB/nJ ≈39 eV −1 ≈2,4 × 10 20 J −1 . El factor de conversión es 1 GB/nJ = J −1 .
Descripción
La beta termodinámica es esencialmente la conexión entre la teoría de la información y la interpretación de la mecánica estadística de un sistema físico a través de su entropía y la termodinámica asociada con su energía . Expresa la respuesta de la entropía a un aumento de energía. Si se agrega una pequeña cantidad de energía al sistema, entonces β describe la cantidad en que el sistema se aleatorizará.
A través de la definición estadística de la temperatura como función de la entropía, la función de frío se puede calcular en el conjunto microcanónico a partir de la fórmula
(es decir, la derivada parcial de la entropía S con respecto a la energía E a volumen constante V y número de partículas N ).
Ventajas
Aunque es completamente equivalente en contenido conceptual a la temperatura, β generalmente se considera una cantidad más fundamental que la temperatura debido al fenómeno de temperatura negativa , en el que β es continua cuando cruza cero mientras que T tiene una singularidad. [4]
Además, β tiene la ventaja de ser más fácil de entender causalmente: si se añade una pequeña cantidad de calor a un sistema, β es el aumento de entropía dividido por el aumento de calor. La temperatura es difícil de interpretar en el mismo sentido, ya que no es posible "añadir entropía" a un sistema excepto de forma indirecta, modificando otras magnitudes como la temperatura, el volumen o el número de partículas.
Interpretación estadística
Desde el punto de vista estadístico, β es una cantidad numérica que relaciona dos sistemas macroscópicos en equilibrio. La formulación exacta es la siguiente. Considérese dos sistemas, 1 y 2, en contacto térmico, con energías respectivas E 1 y E 2 . Suponemos que E 1 + E 2 = alguna constante E . El número de microestados de cada sistema se denotará por Ω 1 y Ω 2 . Bajo nuestras suposiciones, Ω i depende solo de E i . También suponemos que cualquier microestado del sistema 1 consistente con E 1 puede coexistir con cualquier microestado del sistema 2 consistente con E 2 . Por lo tanto, el número de microestados para el sistema combinado es
Derivaremos β del supuesto fundamental de la mecánica estadística :
- Cuando el sistema combinado alcanza el equilibrio, el número Ω se maximiza.
(En otras palabras, el sistema busca naturalmente el número máximo de microestados). Por lo tanto, en equilibrio,
Pero E 1 + E 2 = E implica
Entonces
es decir
La relación anterior motiva una definición de β :
Conexión de la vista estadística con la vista termodinámica
Cuando dos sistemas están en equilibrio, tienen la misma temperatura termodinámica T . Por lo tanto, intuitivamente, se esperaría que β (tal como se define a través de microestados) esté relacionada con T de alguna manera. Este vínculo lo proporciona el supuesto fundamental de Boltzmann escrito como
donde k B es la constante de Boltzmann , S es la entropía termodinámica clásica y Ω es el número de microestados.
Sustituyendo en la definición de β la definición estadística anterior se obtiene
Comparando con la fórmula termodinámica
tenemos
donde se llama temperatura fundamental del sistema, y tiene unidades de energía.
Historia
This section's factual accuracy is disputed. (September 2024) |
La beta termodinámica fue introducida originalmente en 1971 (como Kältefunktion "función de frío") por Ingo Müller , uno de los defensores de la escuela de pensamiento de la termodinámica racional , [5] [6] basándose en propuestas anteriores de una función de "temperatura recíproca". [1] [7] [ se necesita una fuente no primaria ]
Véase también
Referencias
- ^ ab Day, WA; Gurtin, Morton E. (1969-01-01). "Sobre la simetría del tensor de conductividad y otras restricciones en la teoría no lineal de la conducción del calor". Archivo de Mecánica racional y análisis . 33 (1): 26–32. Bibcode :1969ArRMA..33...26D. doi :10.1007/BF00248154. ISSN 1432-0673.
- ^ Meixner, J. (1975-09-01). "Frío y temperatura". Archivo de Mecánica Racional y Análisis . 57 (3): 281–290. Código Bibliográfico :1975ArRMA..57..281M. doi :10.1007/BF00280159. ISSN 1432-0673.
- ^ Fraundorf, P. (1 de noviembre de 2003). "Capacidad calorífica en bits". American Journal of Physics . 71 (11): 1142–1151. Código Bibliográfico :2003AmJPh..71.1142F. doi :10.1119/1.1593658. ISSN 0002-9505.
- ^ Kittel, Charles; Kroemer, Herbert (1980), Física térmica (2.ª ed.), Estados Unidos de América: WH Freeman and Company, ISBN 978-0471490302
- ^ Müller, Ingo (1971). "Die Kältefunktion, eine universelle Funktion in der Thermodynamik wärmeleitender Flüssigkeiten" [La función del frío, una función universal en la termodinámica de los líquidos conductores de calor]. Archivo de Análisis y Mecánica Racional . 40 : 1–36. doi :10.1007/BF00281528.
- ^ Müller, Ingo (1971). "El frío, una función universal en los cuerpos termoelásticos". Archivo de Mecánica Racional y Análisis . 41 (5): 319–332. Código Bibliográfico :1971ArRMA..41..319M. doi :10.1007/BF00281870.
- ^ Castle, J.; Emmenish, W.; Henkes, R.; Miller, R.; Rayne, J. (1965). Ciencia por grados: Temperatura de cero a cero . Nueva York: Walker and Company.

![{\displaystyle [\beta ]={\textrm {J}}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/95d75d6e2e60e9f106f17e91bd18a413a3a9d6e9)














