Fototropismo

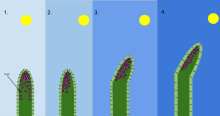
En biología , el fototropismo es el crecimiento de un organismo en respuesta a un estímulo luminoso . El fototropismo se observa con mayor frecuencia en plantas , pero también puede ocurrir en otros organismos como los hongos . Las células de la planta que están más alejadas de la luz contienen una hormona llamada auxina que reacciona cuando se produce el fototropismo. Esto hace que la planta tenga células alargadas en el lado más alejado de la luz. El fototropismo es uno de los muchos tropismos o movimientos de las plantas que responden a estímulos externos. El crecimiento hacia una fuente de luz se denomina fototropismo positivo , mientras que el crecimiento lejos de la luz se denomina fototropismo negativo . El fototropismo negativo no debe confundirse con el escototropismo, que se define como el crecimiento hacia la oscuridad, mientras que el fototropismo negativo puede referirse al crecimiento lejos de una fuente de luz o hacia la oscuridad. [1] La mayoría de los brotes de las plantas exhiben fototropismo positivo y reorganizan sus cloroplastos en las hojas para maximizar la energía fotosintética y promover el crecimiento. [2] [3] Algunas puntas de los sarmientos presentan fototropismo negativo, lo que les permite crecer hacia objetos sólidos y oscuros y trepar por ellos. La combinación de fototropismo y gravitropismo permite que las plantas crezcan en la dirección correcta. [4]
Mecanismo
Existen varias moléculas de señalización que ayudan a la planta a determinar de dónde proviene la fuente de luz, y estas activan varios genes, que cambian los gradientes hormonales permitiendo que la planta crezca hacia la luz. La punta de la planta se conoce como coleoptilo , que es necesaria para la detección de la luz. [2] La porción media del coleoptilo es el área donde se produce la curvatura del brote. La hipótesis de Cholodny-Went , desarrollada a principios del siglo XX, predice que en presencia de luz asimétrica, la auxina se moverá hacia el lado sombreado y promoverá la elongación de las células de ese lado para hacer que la planta se curve hacia la fuente de luz. [5] Las auxinas activan las bombas de protones, disminuyendo el pH en las células del lado oscuro de la planta. Esta acidificación de la región de la pared celular activa enzimas conocidas como expansinas que interrumpen los enlaces de hidrógeno en la estructura de la pared celular, haciendo que las paredes celulares sean menos rígidas. Además, el aumento de la actividad de la bomba de protones hace que entren más solutos en las células vegetales del lado oscuro de la planta, lo que aumenta el gradiente osmótico entre el simplasto y el apoplasto de estas células vegetales. [6] Luego, el agua entra en las células a lo largo de su gradiente osmótico, lo que genera un aumento de la presión de turgencia. La disminución de la fuerza de la pared celular y el aumento de la presión de turgencia por encima de un umbral de rendimiento [7] hacen que las células se hinchen, ejerciendo la presión mecánica que impulsa el movimiento fototrópico.
Se ha descubierto que las proteínas codificadas por un segundo grupo de genes, los genes PIN , desempeñan un papel importante en el fototropismo. Son transportadores de auxina y se cree que son responsables de la polarización de la ubicación de la auxina. Específicamente, PIN3 se ha identificado como el transportador de auxina primario. [8] Es posible que las fototropinas reciban luz e inhiban la actividad de la quinasa PINOID (PID), que luego promueve la actividad de PIN3 . Esta activación de PIN3 conduce a una distribución asimétrica de la auxina, que luego conduce a una elongación asimétrica de las células en el tallo. Los mutantes pin3 tenían hipocótilos y raíces más cortos que el tipo salvaje, y se observó el mismo fenotipo en plantas cultivadas con inhibidores de eflujo de auxina. [9] Usando el marcaje inmunogold anti-PIN3, se observó el movimiento de la proteína PIN3. PIN3 normalmente se localiza en la superficie del hipocótilo y el tallo, pero también se internaliza en presencia de Brefeldin A (BFA), un inhibidor de la exocitosis. Este mecanismo permite que el PIN3 se reposicione en respuesta a un estímulo ambiental. Se pensaba que las proteínas PIN3 y PIN7 desempeñaban un papel en el fototropismo inducido por pulsos. Las respuestas de curvatura en el mutante "pin3" se redujeron significativamente, pero solo ligeramente en los mutantes "pin7". Hay cierta redundancia entre "PIN1", "PIN3" y "PIN7", pero se cree que el PIN3 desempeña un papel más importante en el fototropismo inducido por pulsos. [10]
Existen fototropinas que se expresan en gran medida en la región superior de los coleóptilos. Existen dos fototropismos principales: phot1 y phot2. Los mutantes simples de phot2 tienen respuestas fototrópicas como las del tipo salvaje, pero los mutantes dobles de phot1 y phot2 no muestran ninguna respuesta fototrópica. [4] Las cantidades de PHOT1 y PHOT2 presentes son diferentes según la edad de la planta y la intensidad de la luz. Hay una gran cantidad de PHOT2 presente en las hojas maduras de Arabidopsis y esto también se observó en los ortólogos del arroz. La expresión de PHOT1 y PHOT2 cambia según la presencia de luz azul o roja. Hubo una regulación negativa del ARNm de PHOT1 en presencia de luz, pero una regulación positiva de la transcripción de PHOT2. Los niveles de ARNm y proteína presentes en la planta dependían de la edad de la planta. Esto sugiere que los niveles de expresión de fototropina cambian con la maduración de las hojas. [11] Las hojas maduras contienen cloroplastos que son esenciales para la fotosíntesis. La reorganización de los cloroplastos se produce en diferentes entornos de luz para maximizar la fotosíntesis. Hay varios genes implicados en el fototropismo de las plantas, incluidos los genes NPH1 y NPL1 . Ambos están involucrados en la reorganización de los cloroplastos. [3] Se descubrió que los mutantes dobles nph1 y npl1 tenían respuestas fototrópicas reducidas. De hecho, ambos genes son redundantes a la hora de determinar la curvatura del tallo.
Estudios recientes revelan que múltiples quinasas AGC, excepto PHOT1 y PHOT2, están involucradas en el fototropismo de las plantas. En primer lugar, PINOID, que exhibe un patrón de expresión inducible por la luz, determina la reubicación subcelular de PIN3 durante las respuestas fototrópicas a través de una fosforilación directa. En segundo lugar, D6PK y sus homólogos D6PKL modulan la actividad de transporte de auxina de PIN3, probablemente también a través de la fosforilación. En tercer lugar, aguas arriba de D6PK/D6PKL, PDK1.1 y PDK1.2 actúan como activadores esenciales para estas quinasas AGC. Curiosamente, diferentes quinasas AGC podrían participar en diferentes pasos durante la progresión de una respuesta fototrópica. D6PK/D6PKL exhiben una capacidad para fosforilar más fosfositios que PINOID.
Cinco modelos de distribución de auxinas en el fototropismo
En 2012, Sakai y Haga [12] describieron cómo podrían surgir diferentes concentraciones de auxina en el lado sombreado e iluminado del tallo, lo que da lugar a una respuesta fototrópica. Se han propuesto cinco modelos con respecto al fototropismo del tallo , utilizando Arabidopsis thaliana como planta de estudio.

- Primer modelo
En el primer modelo, la luz entrante desactiva la auxina en el lado iluminado de la planta, lo que permite que la parte sombreada continúe creciendo y eventualmente doble la planta hacia la luz. [12]
- Segundo modelo
En el segundo modelo, la luz inhibe la biosíntesis de auxina en el lado luminoso de la planta, disminuyendo así la concentración de auxina en relación con el lado no afectado. [12]
- Tercer modelo
En el tercer modelo, hay un flujo horizontal de auxina tanto del lado iluminado como del lado oscuro de la planta. La luz entrante hace que fluya más auxina del lado expuesto al lado sombreado, lo que aumenta la concentración de auxina en el lado sombreado y, por lo tanto, se produce un mayor crecimiento. [12]
- Cuarto modelo
En el cuarto modelo se muestra la planta que recibe luz para inhibir la auxina basipetal hasta el lado expuesto, lo que hace que la auxina solo fluya hacia el lado sombreado. [12]
- Quinto modelo
El modelo cinco abarca elementos de los modelos 3 y 4. El flujo principal de auxina en este modelo proviene de la parte superior de la planta verticalmente hacia la base de la planta, y parte de la auxina viaja horizontalmente desde el flujo principal de auxina hacia ambos lados de la planta. La recepción de luz inhibe el flujo horizontal de auxina desde el flujo vertical principal de auxina hacia el lado expuesto irradiado. Y según el estudio de Sakai y Haga, la distribución asimétrica de auxina observada y la respuesta fototrópica posterior en los hipocótilos parecen más consistentes con este quinto escenario. [12]
Efectos de la longitud de onda
El fototropismo en plantas como Arabidopsis thaliana está dirigido por receptores de luz azul llamados fototropinas . [13] Otros receptores fotosensibles en las plantas incluyen fitocromos que detectan la luz roja [14] y criptocromos que detectan la luz azul. [15] Diferentes órganos de la planta pueden exhibir diferentes reacciones fototrópicas a diferentes longitudes de onda de luz. Las puntas de los tallos exhiben reacciones fototrópicas positivas a la luz azul, mientras que las puntas de las raíces exhiben reacciones fototrópicas negativas a la luz azul. Tanto las puntas de las raíces como la mayoría de las puntas de los tallos exhiben fototropismo positivo a la luz roja. [ cita requerida ] Los criptocromos son fotorreceptores que absorben la luz azul / UV-A, y ayudan a controlar el ritmo circadiano en las plantas y el momento de la floración. Los fitocromos son fotorreceptores que detectan la luz roja / roja lejana, pero también absorben la luz azul; pueden controlar la floración en plantas adultas y la germinación de semillas, entre otras cosas. La combinación de respuestas de fitocromos y criptocromos permite que la planta responda a varios tipos de luz. [16] Juntos, los fitocromos y criptocromos inhiben el gravitropismo en los hipocótilos y contribuyen al fototropismo. [2]
Galería
- El berro Thale ( Arabidopsis thaliana ) se regula mediante luz azul a ultravioleta.
- Phycomyces , un hongo, también exhibe fototropismo.
- Ejemplo de una Phalaenopsis
- Ejemplo sobre frijoles azuki
- Ravenalas creciendo entre dos edificios en Kinshasa , República Democrática del Congo . El plano (aquí perpendicular al eje norte-sur) de estas dos plantas está orientado para maximizar la absorción de la luz natural.
Véase también
Referencias
- ^ Fuerte y Ray 1975.
- ^ abc Goyal, A., Szarzynska, B., Fankhauser C. (2012). Fototropismo: en la encrucijada de las vías de señalización lumínica. Célula 1-9.
- ^ ab Sakai, T.; Kagawa, T.; Kasahara, M.; Swartz, TE; Christie, JM; Briggs, WR; Wada, M.; Okada, K. (2001). "Arabidopsis nph1 y npl1: receptores de luz azul que median tanto el fototropismo como la reubicación del cloroplasto". PNAS . 98 (12): 6969–6974. Bibcode :2001PNAS...98.6969S. doi : 10.1073/pnas.101137598 . PMC 34462 . PMID 11371609.
- ^ ab Liscum, E. (2002). Fototropismo: mecanismos y resultados. Arabidopsis Libro 1-21.
- ^ Christie, JM; Murphy, AS (2013). "Fototropismo de los brotes en plantas superiores: nueva luz a través de viejos conceptos". American Journal of Botany . 100 (1): 35–46. doi :10.3732/ajb.1200340. PMID 23048016.
- ^ Hager, Achim (1 de diciembre de 2003). "El papel de la H+-ATPasa de la membrana plasmática en el crecimiento por elongación inducida por auxina: aspectos históricos y nuevos". Journal of Plant Research . 116 (6): 483–505. Bibcode :2003JPlR..116..483H. doi :10.1007/s10265-003-0110-x. ISSN 1618-0860. PMID 12937999. S2CID 23781965.
- ^ Cosgrove, Daniel J.; Van Volkenburgh, Elizabeth; Cleland, Robert E. (septiembre de 1984). "Relajación de las paredes celulares por tensión y umbral de rendimiento para el crecimiento: demostración y medición mediante técnicas de sonda de micropresión y psicrómetro". Planta . 162 (1): 46–54. doi :10.1007/BF00397420. ISSN 0032-0935. PMID 11540811. S2CID 6870501.
- ^ Ding, Z.; Galván-Ampudia, CS; Demarsy, E.; Langowski, L.; Kleine-Vehn, J.; Fan, Y.; Morita, MT; Tasaka, M.; Fankhauser, C.; Offringa, R.; Friml, J. (2011). "Polarización mediada por luz del transportador de auxinas PIN3 para la respuesta fototrópica en Arabidopsis". Biología celular de la naturaleza . 13 (4): 447–453. doi :10.1038/ncb2208. PMID 21394084. S2CID 25049558.
- ^ Friml, J.; Wisniewska, J.; Benkova, E.; Mendgen, K.; Palme, K. (2002). "La reubicación lateral del regulador de eflujo de auxina PIN3 media el tropismo en Arabidopsis". Nature . 415 (6873): 806–809. Bibcode :2002Natur.415..806F. doi :10.1038/415806a. PMID 11845211. S2CID 4348635.
- ^ Haga, K.; Sakai, T. (2012). "Los portadores de eflujo de auxina PIN son necesarios para el fototropismo inducido por pulsos pero no continuo inducido por luz en Arabidopsis". Fisiología vegetal . 160 (2): 763–776. doi : 10.1104/pp.112.202432 . PMC 3461554 . PMID 22843667.
- ^ Labuz, J.; Sztatelman, O.; Banas, AK; Gabrys, H. (2012). "La expresión de fototropinas en hojas de Arabidopsis: regulación del desarrollo y la luz". Journal of Experimental Botany . 63 (4): 1763–1771. doi :10.1093/jxb/ers061. PMID 22371325.
- ^ abcdef Sakai, T; Haga, K (2012). "Análisis genético molecular del fototropismo en Arabidopsis". Plant & Cell Physiology . 53 (9): 1517–34. doi :10.1093/pcp/pcs111. PMC 3439871 . PMID 22864452.
- ^ "Fototropinas: fotorreceptores que proporcionan un nuevo mecanismo fotoquímico para la señalización". Archivado desde el original el 18 de noviembre de 2015. Consultado el 16 de abril de 2016 .
- ^ "Fitocromo". plantphys.info . Consultado el 16 de abril de 2016 .
- ^ Eckardt, NA (1 de mayo de 2003). "Un componente de la vía de señalización de luz azul del criptocromo". The Plant Cell Online . 15 (5): 1051–1052. doi :10.1105/tpc.150510. PMC 526038 .
- ^ McCoshum, S., Kiss, JZ (2011). La luz verde afecta el fototropismo basado en la luz azul en hipocótilos de Arabidopsis thaliana . Journal of the Torrey Botanical Society 138(4), 409-417. doi :10.3159/TORREY-D-11-00040.1. JSTOR 41475107.
Bibliografía
- Strong, Donald R.; Ray, Thomas S. (1 de enero de 1975). "Comportamiento de la ubicación del árbol huésped de una enredadera tropical ( Monstera gigantea ) por escototropismo". Science . 190 (4216): 804–806. Bibcode :1975Sci...190..804S. doi :10.1126/science.190.4216.804. JSTOR 1741614. S2CID 84386403.




