Fotoheterótrofo
Los fotoheterótrofos ( del griego : foto = luz, hetero = (otro) y trofo = alimento) son fotótrofos heterótrofos , es decir, son organismos que utilizan la luz como fuente de energía, pero no pueden utilizar el dióxido de carbono como única fuente de carbono. En consecuencia, utilizan compuestos orgánicos del medio ambiente para satisfacer sus necesidades de carbono; estos compuestos incluyen carbohidratos , ácidos grasos y alcoholes . Entre los ejemplos de organismos fotoheterótrofos se incluyen las bacterias púrpuras no azufradas , las bacterias verdes no azufradas y las heliobacterias . [1] Estos microorganismos son omnipresentes en los hábitats acuáticos, ocupan nichos únicos y contribuyen al ciclo biogeoquímico global. Investigaciones recientes también han indicado que la avispa oriental y algunos pulgones pueden utilizar la luz para complementar su suministro de energía. [2]
Investigación
Los estudios han demostrado que las mitocondrias de los mamíferos también pueden capturar luz y sintetizar ATP cuando se mezclan con feofórbido , un metabolito de la clorofila que captura la luz. [3] La investigación demostró que el mismo metabolito cuando se alimenta al gusano Caenorhabditis elegans conduce a un aumento en la síntesis de ATP tras la exposición a la luz, junto con un aumento en la esperanza de vida. [4]
Además, los experimentos de inoculación sugieren que la Ochromonas danica mixotrófica (es decir, las algas doradas) y los eucariotas comparables favorecen la fotoheterotrofía en hábitats acuáticos oligotróficos (es decir, limitados en nutrientes). [5] Esta preferencia puede aumentar la eficiencia del uso de energía y el crecimiento al reducir la inversión en la fijación de carbono inorgánico (por ejemplo, la producción de maquinarias autótrofas como RuBisCo y PSII).
Metabolismo
Los fotoheterótrofos generan ATP usando luz, de una de dos maneras: [6] [7] usan un centro de reacción basado en bacterioclorofila , o usan una bacteriorodopsina . El mecanismo basado en la clorofila es similar al usado en la fotosíntesis, donde la luz excita las moléculas en un centro de reacción y causa un flujo de electrones a través de una cadena de transporte de electrones (ETS). Este flujo de electrones a través de las proteínas hace que los iones de hidrógeno sean bombeados a través de una membrana. La energía almacenada en este gradiente de protones se usa para impulsar la síntesis de ATP . A diferencia de los fotoautótrofos , los electrones fluyen solo en una vía cíclica: los electrones liberados del centro de reacción fluyen a través de la ETS y regresan al centro de reacción. No se utilizan para reducir ningún compuesto orgánico. Las bacterias púrpuras sin azufre , las bacterias verdes sin azufre y las heliobacterias son ejemplos de bacterias que llevan a cabo este esquema de fotoheterotrofia.
Otros organismos, incluidas las halobacterias y flavobacterias [8] y los vibrios [9] tienen bombas de protones basadas en rodopsina púrpura que complementan su suministro de energía. La versión arqueal se llama bacteriorrodopsina , mientras que la versión eubacteriana se llama proteorrodopsina . La bomba consiste en una sola proteína unida a un derivado de la vitamina A, retinal . La bomba puede tener pigmentos accesorios (por ejemplo, carotenoides ) asociados con la proteína. Cuando la luz es absorbida por la molécula de retinal, la molécula se isomeriza. Esto impulsa a la proteína a cambiar de forma y bombear un protón a través de la membrana. El gradiente de iones de hidrógeno puede usarse entonces para generar ATP, transportar solutos a través de la membrana o impulsar un motor flagelar . Una flavobacteria en particular no puede reducir el dióxido de carbono usando luz, pero usa la energía de su sistema de rodopsina para fijar el dióxido de carbono a través de la fijación anaplerótica . [8] La flavobacteria sigue siendo un heterótrofo , ya que necesita compuestos de carbono reducido para vivir y no puede subsistir solo con luz y CO 2 . No puede llevar a cabo reacciones en forma de
- n CO 2 + 2n H 2 D + fotones → (CH 2 O) n + 2n D + n H 2 O,
donde H 2 D puede ser agua, H 2 S u otro compuesto/compuestos que proporcionen los electrones y protones reductores; el par 2D + H 2 O representa una forma oxidada.
Sin embargo, puede fijar el carbono en reacciones como:
donde el malato u otras moléculas útiles se obtienen de otro modo descomponiendo otros compuestos por
- carbohidrato + O 2 → malato + CO 2 + energía.
Este método de fijación de carbono es útil cuando los compuestos de carbono reducido son escasos y no pueden desperdiciarse como CO2 durante las interconversiones, pero la energía es abundante en forma de luz solar.
Ecología

Distribución y partición de nichos
Los fotoheterótrofos, ya sean 1) cianobacterias (es decir, heterótrofos facultativos en entornos con nutrientes limitados como Synechococcus y Prochlorococcus), 2) bacterias fotoheterotróficas anoxigénicas aeróbicas (AAP; que emplean centros de reacción basados en bacterioclorofila), 3) bacterias y arqueas que contienen proteorodopsina (PR), y 4) heliobacterias (es decir, el único fotótrofo con pigmentos de bacterioclorofila g , o membrana Gram-positiva) se encuentran en varios hábitats acuáticos, incluidos océanos , lagos estratificados , arrozales y extremos ambientales . [10] [11] [12] [13]
En las zonas fóticas de los océanos, hasta el 10% de las células bacterianas son capaces de AAP, mientras que más del 50% de los microorganismos marinos netos albergan PR, alcanzando hasta el 90% en los biomas costeros. [14] Como se demostró en experimentos de inoculación, la fotoheterotrofía puede proporcionar a estos microbios planctónicos ventajas competitivas 1) en relación con los quimioheterótrofos en entornos oligotróficos (es decir, pobres en nutrientes) a través de una mayor eficiencia en el uso de nutrientes (es decir, biosíntesis de combustibles de carbono orgánico, en exceso, versus producción de energía) y 2) eliminando la inversión en enzimas/complejos autótrofos fisiológicamente costosos (RuBisCo y PSII). [15] [16] Además, en los océanos Árticos, los fotoheterótrofos AAP y PR son prominentes en regiones cubiertas de hielo durante el invierno por escasez de luz. [17] Por último, se ha observado una renovación estacional en las AAP marinas a medida que los ecotipos (es decir, taxones genéticamente similares con diferentes rasgos funcionales y/o preferencias ambientales) se segregan en nichos temporales. [18]
En lagos estratificados (es decir, euxínicos) , los fotoheterótrofos, junto con otros fotótrofos anoxigénicos (por ejemplo, bacterias de azufre púrpura/verde que fijan dióxido de carbono a través de donantes de electrones como hierro ferroso, sulfuro y gas hidrógeno), a menudo ocupan la quimioclina en la columna de agua y/o sedimentos. [19] En esta zona, el oxígeno disuelto se reduce, la luz se limita a longitudes de onda largas (por ejemplo, rojo e infrarrojo) que quedan de los fotótrofos oxigénicos (por ejemplo, cianobacterias) y los metabolismos anaeróbicos (es decir, aquellos que ocurren en ausencia de oxígeno) comienzan a introducir sulfuro y nutrientes biodisponibles (por ejemplo, carbono orgánico, fosfato y amoníaco) a través de difusión ascendente. [20]
Las heliobacterias son anaerobios obligados que se encuentran principalmente en los campos de arroz , donde las bajas concentraciones de sulfuro impiden la exclusión competitiva de las bacterias de azufre púrpura/verde. [21] Estos entornos anegados pueden facilitar las relaciones simbióticas entre las heliobacterias y las plantas de arroz, ya que el nitrógeno fijado (de las primeras) se intercambia por exudados de raíces ricos en carbono.
Los estudios de observación han caracterizado a los fotoheterótrofos (por ejemplo, bacterias verdes no azufradas como Chloroflexi y AAP) dentro de tapetes fotosintéticos en extremos ambientales (por ejemplo, aguas termales y lagunas hipersalinas). [12] [22] En particular, la temperatura y el pH impulsan la composición de la comunidad de fotótrofos anoxigénicos en las características geotérmicas del Parque Nacional de Yellowstone . [12] Además, varios nichos dependientes de la luz en los tapetes hipersalinos del Gran Lago Salado sustentan la diversidad fototrófica ya que los microbios optimizan la producción de energía y combaten el estrés osmótico. [22]
Ciclo biogeoquímico
Los fotoheterótrofos influyen en el ciclo global del carbono mediante la asimilación del carbono orgánico disuelto (COD). [23] [20] Por lo tanto, al recolectar energía lumínica, el carbono se mantiene en el circuito microbiano sin la respiración correspondiente (es decir, la liberación de dióxido de carbono a la atmósfera a medida que el COD se oxida para alimentar la producción de energía). Esta desconexión, el descubrimiento de fotoheterótrofos facultativos (por ejemplo, AAP con fuentes de energía flexibles) y las mediciones previas tomadas en la oscuridad (es decir, para evitar valores sesgados de consumo de oxígeno debido a la fotooxidación , la luz ultravioleta y la fotosíntesis oxigénica) conducen a emisiones acuáticas de CO 2 sobreestimadas . Por ejemplo, se observó una disminución del 15,2% en la respiración de la comunidad en el lago Cep, Chequia, junto con la absorción preferencial de glucosa y piruvato, que se atribuye a que los fotoheterótrofos facultativos prefieren la energía lumínica durante el día, dados los beneficios de aptitud mencionados anteriormente. [23]
Diagrama de flujo
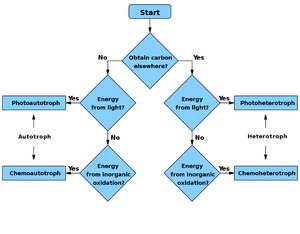
Fuente de energía Fuente de carbono | Quimiotrofo | Fotótrofo |
|---|---|---|
| Autótrofo | Quimioautotrofo | Fotoautotrofo |
| Heterótrofo | Quimioheterótrofo | Fotoheterótrofo |
Véase también
Referencias
- ^ Bryant, DA; Frigaard, N.-U. (noviembre de 2006). "Fotosíntesis y fototrofia procariotas iluminadas". Trends Microbiol . 14 (11): 488–496. doi :10.1016/j.tim.2006.09.001. PMID 16997562.
- ^ Valmalette, JC; Dombrovsky, A.; Brat, P.; Mertz, C.; Capovilla, M.; Robichon, A. (2012). "Transferencia de electrones inducida por luz y síntesis de ATP en un insecto sintetizador de caroteno". Scientific Reports . 2 : 579. Bibcode :2012NatSR...2E.579V. doi :10.1038/srep00579. PMC 3420219 . PMID 22900140.
- ^ Xu, Chen; Zhang, Junhua; Mihai, Doina M.; Washington, Ilyas (15 de enero de 2014). "Los pigmentos de clorofila que captan luz permiten a las mitocondrias de los mamíferos capturar energía fotónica y producir ATP". Journal of Cell Science . 127 (2): 388–399. doi : 10.1242/jcs.134262 . ISSN 0021-9533. PMC 6518289 . PMID 24198392.
- ^ Zhang, Dan; Robinson, Kiera; Mihai, Doina M.; Washington, Ilyas (12 de octubre de 2016). "El secuestro de pigmentos derivados de la dieta permite la detección de luz mitocondrial". Scientific Reports . 6 (1): 34320. Bibcode :2016NatSR...634320Z. doi : 10.1038/srep34320 . ISSN 2045-2322. PMC 5059631 . PMID 27731322.
- ^ Wilken, Susana; Schuurmans, J. Merijn; Matthijs, Hans CP (diciembre de 2014). "¿Los mixótrofos crecen como fotoheterótrofos? Aclimatación fotofisiológica del crisófito Ochromonas danica después de la alimentación". Nuevo fitólogo . 204 (4): 882–889. doi : 10.1111/nph.12975 . ISSN 0028-646X. PMID 25138174.
- ^ Bryant, Donald A.; Frigaard, Niels-Ulrik (noviembre de 2006). "Fotosíntesis y fototrofia procariotas iluminadas". Tendencias en microbiología . 14 (11): 488–496. doi :10.1016/j.tim.2006.09.001. ISSN 0966-842X. PMID 16997562.
- ^ Zubkov, Mikhail V. (1 de septiembre de 2009). "Fotoheterotrofia en procariotas marinos". Revista de investigación del plancton . 31 (9): 933–938. doi : 10.1093/plankt/fbp043 . ISSN 0142-7873.
- ^ ab González, José M.; Fernández-Gómez, Beatriz; Fernández-Guerra, Antoni; Gómez-Consarnau, Laura; Sánchez, Olga; Coll-Lladó, Montserrat; et al. (24 de junio de 2008). "Análisis del genoma de la bacteria marina que contiene proteorodopsina Polaribacter Sp. MED152 (flavobacterias)". Actas de la Academia Nacional de Ciencias . 105 (25): 8724–8729. doi : 10.1073/pnas.0712027105 . ISSN 0027-8424. PMC 2438413 . PMID 18552178.
- ^ Gómez-Consarnau, Laura; Akram, Neelam; Lindell, Kristoffer; Pedersen, Anders; Neutze, Richard; Milton, Debra L.; González, José M.; Pinhassi, Jarone (2010). "La fototrofia de proteorodopsina promueve la supervivencia de bacterias marinas durante la inanición". PLOS Biol . 8 (4): e1000358. doi : 10.1371/journal.pbio.1000358 . PMC 2860489 . PMID 20436956.
- ^ Zubkov, MV (18 de junio de 2009). "Fotoheterotrofia en procariotas marinos". Revista de investigación del plancton . 31 (9): 933–938. doi : 10.1093/plankt/fbp043 . ISSN 0142-7873.
- ^ Jagannathan, B.; Golbeck, JH (1 de enero de 2009), "Fotosíntesis: microbiana", en Schaechter, Moselio (ed.), Enciclopedia de microbiología (tercera edición) , Oxford: Academic Press, págs. 325–341, ISBN 978-0-12-373944-5, consultado el 15 de abril de 2023
- ^ abc Hamilton, Trinity L.; Bennett, Annastacia C.; Murugapiran, Senthil K.; Havig, Jeff R. (17 de diciembre de 2019). Flynn, Theodore M. (ed.). "Los fotótrofos anoxigénicos abarcan gradientes geoquímicos y morfologías diversas en manantiales geotérmicos terrestres". mSystems . 4 (6): e00498–19. doi :10.1128/mSystems.00498-19. ISSN 2379-5077. PMC 6832021 . PMID 31690593.
- ^ Boeuf, D.; Humily, F.; Jeanthon, C. (20 de junio de 2014). "Diversidad de bacterias pelágicas del Ártico con énfasis en fotoheterótrofos: una revisión". Biogeosciences . 11 (12): 3309–3322. Bibcode :2014BGeo...11.3309B. doi : 10.5194/bg-11-3309-2014 . ISSN 1726-4189.
- ^ Arandia-Gorostidi, Nestor; González, José M.; Huete-Stauffer, Tamara M.; Ansari, Mohd I.; Morán, Xosé Anxelu G.; Alonso-Sáez, Laura (2020-08-02). "La luz favorece la integridad celular y las tasas de crecimiento de fotoheterótrofos costeros taxonómicamente diversos". Microbiología ambiental . 22 (9): 3823–3837. Bibcode :2020EnvMi..22.3823A. doi :10.1111/1462-2920.15158. hdl : 10754/664249 . ISSN 1462-2912. PMID 32643243. S2CID 220435352.
- ^ Wilken, Susanne; Schuurmans, J. Merijn; Matthijs, Hans CP (19 de agosto de 2014). "¿Los mixótrofos crecen como fotoheterótrofos? Aclimatación fotofisiológica de la crisófita Ochromonas danica después de la alimentación". New Phytologist . 204 (4): 882–889. doi : 10.1111/nph.12975 . ISSN 0028-646X. PMID 25138174.
- ^ Fenchel, T.; King, GM; Blackburn, TH (2012), "Ciclos biogeoquímicos en suelos", Bacterial Biogeochemistry , Elsevier, págs. 89-120, doi :10.1016/b978-0-12-415836-8.00006-2, ISBN 9780124158368, consultado el 15 de abril de 2023
- ^ Cottrell, Matthew T.; Kirchman, David L. (2009). "Microbios fotoheterotróficos en el océano Ártico en verano e invierno". Microbiología aplicada y ambiental . 75 (15): 4958–4966. Bibcode :2009ApEnM..75.4958C. doi :10.1128/aem.00117-09. ISSN 0099-2240. PMC 2725502 . PMID 19502441.
- ^ Auladell, Adriá; Sánchez, Pablo; Sánchez, Olga; Gasol, Josep M.; Ferrera, Isabel (2019). "Variabilidad estacional e interanual a largo plazo de bacterias fotoheterotróficas anoxigénicas aeróbicas marinas". La Revista ISME . 13 (8): 1975–1987. Código Bib : 2019ISMEJ..13.1975A. doi :10.1038/s41396-019-0401-4. ISSN 1751-7370. PMC 6776013 . PMID 30914777. S2CID 256555570.
- ^ Posth, NR; Bristow, Luisiana; Cox, RP; Habicht, KS; Danza, F.; Tonolla, M.; Frigaard, N.-U.; Canfield, DE (2017). "Fraccionamiento de isótopos de carbono por bacterias fototróficas anoxigénicas en el lago euxínico Cadagno". Geobiología . 15 (6): 798–816. Código Bib : 2017Gbio...15..798P. doi :10.1111/gbi.12254. ISSN 1472-4669. PMID 28866873. S2CID 11132075.
- ^ ab Fedonkin, MA (diciembre de 2009). "Eucariotización de la biosfera temprana: un aspecto biogeoquímico". Geochemistry International . 47 (13): 1265–1333. Bibcode :2009GeocI..47.1265F. doi :10.1134/s0016702909130011. ISSN 0016-7029. S2CID 98430905.
- ^ Madigan, Michael T.; Ormerod, John G. (2004), Taxonomía, fisiología y ecología de las heliobacterias, Avances en la fotosíntesis y la respiración, vol. 2, Dordrecht: Kluwer Academic Publishers, págs. 17-30, doi :10.1007/0-306-47954-0_2, ISBN 0-7923-3681-X, consultado el 16 de abril de 2023
- ^ ab Kanik, Mert; Munro-Ehrlich, Mason; Fernandes-Martins, Maria Clara; Payne, Devon; Gianoulias, Kathryn; Keller, Lisa; Kubacki, Alexander; Lindsay, Melody R.; Baxter, Bonnie K.; Vanden Berg, Michael D.; Colman, Daniel R.; Boyd, Eric S. (5 de mayo de 2020). "Abundancia y diversidad inesperadas de fotótrofos en tapetes de microbialitos morfológicamente variables en el Gran Lago Salado, Utah". Microbiología aplicada y ambiental . 86 (10): e00165–20. Código Bibliográfico :2020ApEnM..86E.165K. doi :10.1128/AEM.00165-20. ISSN 1098-5336. Número de modelo : PMID 32198176 .
- ^ ab Piwosz, Kasia; Villena-Alemany, Cristian; Mujakić, Izabela (2022). "La fotoheterotrofia por bacterias aeróbicas anoxigénicas modula los flujos de carbono en un lago de agua dulce". The ISME Journal . 16 (4): 1046–1054. Bibcode :2022ISMEJ..16.1046P. doi :10.1038/s41396-021-01142-2. ISSN 1751-7370. PMC 8941148 . PMID 34802055.
Fuentes
"Microbiología en línea" (libro de texto). Universidad de Wisconsin, Madison.