Mineral de silicato

Los minerales de silicato son minerales formadores de rocas compuestos por grupos de silicatos . Son la clase de minerales más grande e importante y constituyen aproximadamente el 90 por ciento de la corteza terrestre . [1] [2] [3]
En mineralogía , la sílice (dióxido de silicio, SiO2 ) suele considerarse un mineral de silicato más que un mineral de óxido . La sílice se encuentra en la naturaleza como el mineral cuarzo y sus polimorfos .
En la Tierra, existe una amplia variedad de minerales de silicato en una gama aún más amplia de combinaciones como resultado de los procesos que han estado formando y reestructurando la corteza durante miles de millones de años. Estos procesos incluyen la fusión parcial , la cristalización , el fraccionamiento , el metamorfismo , la meteorización y la diagénesis .

Los organismos vivos también contribuyen a este ciclo geológico . Por ejemplo, un tipo de plancton conocido como diatomeas construye sus exoesqueletos ("frústulas") a partir de sílice extraída del agua de mar . Las frústulas de diatomeas muertas son un componente importante de los sedimentos de las profundidades oceánicas y de la tierra de diatomeas . [ cita requerida ]
Estructura general
Un mineral de silicato es generalmente un compuesto inorgánico que consiste en subunidades con la fórmula [SiO 2+ n ] 2 n − . Aunque se representa como tal, la descripción de los silicatos como aniones es una simplificación. Balanceando las cargas de los aniones de silicato están los cationes metálicos, M x + . Los cationes típicos son Mg 2+ , Fe 2+ y Na + . El enlace Si-OM entre los silicatos y los metales son fuertes enlaces covalentes polares. Los aniones de silicato ([SiO 2+ n ] 2 n − ) son invariablemente incoloros, o cuando se trituran hasta formar un polvo fino, blancos. Los colores de los minerales de silicato surgen del componente metálico, comúnmente hierro.
En la mayoría de los minerales de silicato, el silicio es tetraédrico y está rodeado por cuatro óxidos. El número de coordinación de los óxidos es variable, excepto cuando une dos centros de silicio, en cuyo caso el óxido tiene un número de coordinación de dos.
Algunos centros de silicio pueden ser reemplazados por átomos de otros elementos, todavía unidos a los cuatro vértices de oxígeno. Si el átomo sustituido no es normalmente tetravalente, generalmente aporta una carga adicional al anión, que luego requiere cationes adicionales . Por ejemplo, en el mineral ortoclasa [KAlSi
3Oh
8]
norteEl anión es una red tridimensional de tetraedros en la que todos los vértices de oxígeno son compartidos. Si todos los tetraedros tuvieran centros de silicio, el anión sería simplemente sílice neutro [SiO
2]
norteLa sustitución de uno de cada cuatro átomos de silicio por un átomo de aluminio da como resultado el anión [AlSi
3Oh−
8]
norte, cuya carga está neutralizada por los cationes potasio K+
.
Grupos principales
En mineralogía , los minerales de silicato se clasifican en siete grupos principales según la estructura de su anión silicato: [4] [5]
| Grupo mayor | Estructura | Fórmula química | Ejemplo |
|---|---|---|---|
| Nesosilicatos | tetraedros de silicio aislados | [SiO 4 ] 4− | olivino , granate , circón ... |
| Sorosilicatos | tetraedros dobles | [ Si2O7 ] 6− | epidota , grupo de la melilita |
| Ciclosilicatos | anillos | [Si n O 3 n ] 2 n − | grupo del berilo , grupo de la turmalina |
| Inosilicatos | cadena simple | [Si n O 3 n ] 2 n − | grupo piroxeno |
| Inosilicatos | doble cadena | [Si 4 n O 11 n ] 6 n − | grupo anfibol |
| Filosilicatos | hojas | [ Si2nO5n ] 2n − | micas y arcillas |
| Tectosilicatos | Marco 3D | [Al x Si y O (2 x +2 y ) ] x − | cuarzo , feldespatos , zeolitas |
Los tectosilicatos solo pueden tener cationes adicionales si una parte del silicio se reemplaza por un átomo de menor valencia, como el aluminio. La sustitución de Al por Si es común.
Nesosilicatos u ortosilicatos
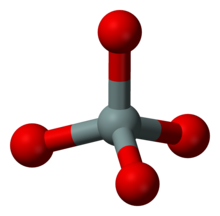
4La bola gris representa el átomo de silicio y las bolas rojas son los átomos de oxígeno.

Los nesosilicatos (del griego νῆσος nēsos 'isla'), u ortosilicatos, tienen el ion ortosilicato , presente como tetraedros [SiO 4 ] 4− aislados (insulares) conectados solo por cationes intersticiales . La clasificación de Nickel-Strunz es 09.A; algunos ejemplos incluyen:
- Grupo de fenacitas
- Grupo de olivino
- Forsterita – Mg2SiO4
- Fayalita – Fe2SiO4
- Tefroita – Mn2SiO4
- Grupo de granates
- Piropo – Mg 3 Al 2 (SiO 4 ) 3
- Almandino – Fe 3 Al 2 (SiO 4 ) 3
- Espesartina – Mn 3 Al 2 (SiO 4 ) 3
- Grossularia – Ca 3 Al 2 (SiO 4 ) 3
- Andradita – Ca 3 Fe 2 (SiO 4 ) 3
- Uvarovita – Ca 3 Cr 2 (SiO 4 ) 3
- Hidrogrosularia – Ca
3Alabama
2Si
2Oh
8(SiO
4)
3− metros(OH)
4 metros
- Grupo del circón

- Grupo Al2SiO5
- Andalucita – Al 2 SiO 5
- Cianita – Al2SiO5
- Silimanita – Al2SiO5
- Dumortierita – Al
6.5–7BIENVENIDOS
3(SiO
4)
3(OH)
3 - Topacio – Al2SiO4 ( F , OH) 2
- Estaurolita – Fe 2 Al 9 (SiO 4 ) 4 (O,OH) 2
- Grupo humita – (Mg,Fe) 7 (SiO 4 ) 3 (F,OH) 2
- Norbergita – Mg3 (SiO4 ) ( F,OH) 2
- Condrodita – Mg 5 (SiO 4 ) 2 (F,OH) 2
- Humita – Mg 7 (SiO 4 ) 3 (F,OH) 2
- Clinohumita – Mg 9 (SiO 4 ) 4 (F,OH) 2
- Datolita – CaBSiO 4 (OH)
- Titanita – CaTiSiO 5
- Cloritoide – ( Fe ,Mg, Mn ) 2Al4Si2O10 ( OH ) 4
- Mullita (también conocida como porcelanaita) – Al 6 Si 2 O 13
Sorosilicatos
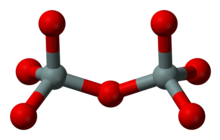
2Oh6−
7

Los sorosilicatos (del griego σωρός sōros 'montón, montículo') tienen aniones pirosilicatos aislados Si
2Oh6−
7, que consta de tetraedros dobles con un vértice de oxígeno compartido (una relación silicio:oxígeno de 2:7). La clasificación de Nickel-Strunz es 09.B. Algunos ejemplos incluyen:
- Thortveitita – (Sc,Y) 2 (Si 2 O 7 )
- Hemimorfita ( calamina ) – Zn 4 (Si 2 O 7 )(OH) 2 ·H 2 O
- Lawsonita – CaAl2 ( Si2O7 ) ( OH ) 2 · H2O
- Axinita – (Ca,Fe,Mn) 3 Al 2 (BO 3 )(Si 4 O 12 )(OH)
- Ilvaita – CaFe II 2 Fe III O(Si 2 O 7 )(OH)
- Grupo epidota (tiene grupos (SiO 4 ) 4− y (Si 2 O 7 ) 6− )
- Epidota – Ca 2 (Al,Fe) 3 O(SiO 4 )(Si 2 O 7 )(OH)
- Zoisita - Ca 2 Al 3 O (SiO 4 )(Si 2 O 7 )(OH)
- Tanzanita - Ca 2 Al 3 O (SiO 4 )(Si 2 O 7 )(OH)
- Clinozoisita – Ca 2 Al 3 O(SiO 4 )(Si 2 O 7 )(OH)
- Allanita – Ca(Ce,La,Y,Ca)Al 2 (Fe II , Fe III ) O (SiO 4 ) (Si 2 O 7 ) (OH)
- Dollaseita-(Ce) – CaCeMg 2 AlSi 3 O 11 F(OH)
- Vesuvianita ( idocrasa ) – Ca 10 (Mg,Fe) 2 Al 4 (SiO 4 ) 5 (Si 2 O 7 ) 2 (OH) 4
Ciclosilicatos



Los ciclosilicatos (del griego κύκλος kýklos 'círculo') o silicatos anulares tienen tres o más tetraedros unidos en un anillo. La fórmula general es (Si x O 3 x ) 2 x − , donde uno o más átomos de silicio pueden ser reemplazados por otros átomos 4-coordinados. La relación silicio:oxígeno es 1:3. Los anillos dobles tienen la fórmula (Si 2 x O 5 x ) 2 x − o una relación 2:5. La clasificación de Nickel-Strunz es 09.C. Los tamaños de anillo posibles incluyen:
Algunos ejemplos de minerales son:
- Anillo simple de 3 miembros
- Benitoíta – BaTi ( Si3O9 )
- Anillo único de 4 miembros
- Papagoíta – CaCuAlSi
2Oh
6(OH)
3.
- Papagoíta – CaCuAlSi
- Anillo único de 6 miembros
- Berilo – Be 3 Al 2 (Si 6 O 18 )
- Bazzita – Be 3 Sc 2 (Si 6 O 18 )
- Sugilita – KNa 2 (Fe,Mn,Al) 2 Li 3 Si 12 O 30
- Turmalina – (Na,Ca)(Al,Li,Mg)
3–(Aluminio, Fe, Mn)
6(Si
6Oh
18)(BO
3)
3(OH)
4 - Pezzottaita – Cs(Be 2 Li)Al 2 Si 6 O 18
- Osumilita – (K,Na)(Fe,Mg) 2 (Al,Fe) 3 (Si,Al) 12 O 30
- Cordierita – (Mg,Fe) 2 Al 4 Si 5 O 18
- Sekaninaita – (Fe +2 , Mg) 2 Al 4 Si 5 O 18
- Anillo único de 9 miembros
- Eudialita – Na
15California
6(Fe,Mn)
3Zr
3SiO(O,OH,H
2O)
3(Si
3Oh
9)
2(Si
9Oh
27)
2(OH,Cl)
2
- Eudialita – Na
- Anillo doble de 6 miembros
- Milarita – K 2 Ca 4 Al 2 Be 4 (Si 24 O 60 ) H 2 O
El anillo de axinita contiene dos tetraedros de B y cuatro de Si y está muy distorsionado en comparación con los otros ciclosilicatos de anillo de 6 miembros.
Inosilicatos
Los inosilicatos (del griego ἴς is [genitivo: ἰνός inos ] 'fibra'), o silicatos en cadena, tienen cadenas entrelazadas de tetraedros de silicato con SiO 3 , proporción 1:3, para cadenas simples o Si 4 O 11 , proporción 4:11, para cadenas dobles. La clasificación de Nickel-Strunz es 09.D – algunos ejemplos incluyen:
Inosilicatos de cadena simple
- Grupo de piroxenos
- Enstatita – serie ortoferrosilita
- Enstatita – MgSiO3
- Ferrosilita – FeSiO3
- Pigeonita – Ca 0,25 (Mg,Fe) 1,75 Si 2 O 6
- Serie diópsido-hedenbergita
- Diópsido – CaMgSi2O6
- Hedenbergita – CaFeSi2O6
- Augita – (Ca,Na)(Mg,Fe,Al)(Si,Al) 2 O 6
- Serie de piroxenos de sodio
- Espodumena – LiAlSi 2 O 6
- Piroxferroíta - (Fe,Ca)SiO 3
- Enstatita – serie ortoferrosilita
- Grupo piroxenoides
- Wollastonita – CaSiO3
- Rodonita – MnSiO3
- Pectolita – NaCa 2 (Si 3 O 8 )(OH)
Inosilicatos de doble cadena
- Grupo de los anfíboles
- Antofilita – ( Mg , Fe ) 7Si8O22 (OH) 2
- Serie Cummingtonita
- Cummingtonita – Fe2Mg5Si8O22 ( OH ) 2
- Grunerita – Fe 7 Si 8 O 22 (OH) 2
- Serie tremolita
- Tremolita – Ca 2 Mg 5 Si 8 O 22 (OH) 2
- Actinolita – Ca2 ( Mg , Fe ) 5Si8O22 ( OH ) 2
- Hornblenda – (Ca,Na)
2–3(Mg, Fe, Al)
5Si
6(Al,Si)
2Oh
22(OH)
2 - Grupo anfibólico de sodio
- Glaucofano – Na 2 Mg 3 Al 2 Si 8 O 22 (OH) 2
- Riebeckita ( amianto ) – Na 2 Fe II 3 Fe III 2 Si 8 O 22 (OH) 2
- Arfvedsonita – Na 3 (Fe,Mg) 4 FeSi 8 O 22 (OH) 2
- Inosilicato, cadena simple triperiódica no ramificada de wollastonita
- Inosilicato con cadena simple periódica 5, rodonita
- Inosilicato con cadena periódica cíclica ramificada de 8 átomos, pellyita
Filosilicatos
Los filosilicatos (del griego φύλλον phýllon 'hoja') o silicatos laminares forman láminas paralelas de tetraedros de silicato con Si2O5 en una proporción de 2:5. La clasificación de Nickel-Strunz es 09.E. Todos los minerales filosilicatos están hidratados , con agua o grupos hidroxilo unidos.

Algunos ejemplos incluyen:
- Subgrupo serpentino
- Antigorita – Mg 3 Si 2 O 5 (OH) 4
- Crisotilo – Mg3Si2O5 ( OH ) 4
- Lizardita – Mg 3 Si 2 O 5 (OH) 4
- Grupo de minerales arcillosos
- Minerales arcillosos 1:1 (TO)
- Halloysita – Al 2 Si 2 O 5 (OH) 4
- Caolinita – Al 2 Si 2 O 5 (OH) 4
- Minerales arcillosos 2:1 (TOT)
- Pirofilita – Al 2 Si 4 O 10 (OH) 2
- Talco – Mg 3 Si 4 O 10 (OH) 2
- Illita – (K,H 3 O)(Al,Mg,Fe) 2 (Si,Al) 4 O 10 [(OH) 2 ,(H 2 O)]
- Montmorillonita (esmectita) – (Na,Ca) 0,33 (Al,Mg) 2 Si 4 O 10 (OH) 2 · n H 2 O
- Clorito – (Mg,Fe) 3 (Si,Al) 4 O 10 (OH) 2 ·(Mg,Fe) 3 (OH) 6
- Vermiculita – (Mg,Fe,Al) 3 (Al,Si) 4 O 10 (OH) 2 ·4H 2 O
- Otros minerales arcillosos
- Sepiolita – Mg 4 Si 6 O 15 (OH) 2 ·6H 2 O
- Palygorskita (o atapulgita) – (Mg,Al) 2 Si 4 O 10 (OH)·4(H 2 O)
- Minerales arcillosos 1:1 (TO)
- Grupo de mica
- Biotita – K(Mg,Fe) 3 (AlSi3 ) O10 ( OH) 2
- Fucsita – K(Al,Cr) 2 (AlSi 3 )O 10 (OH) 2
- Moscovita – KAl 2 (AlSi 3 )O 10 (OH) 2
- Flogopita – KMg 3 (AlSi 3 )O 10 (OH) 2
- Lepidolita – K(Li,Al)
2–3(AlSi
3)O
10(OH)
2 - Margarita – CaAl 2 (Al 2 Si 2 )O 10 (OH) 2
- Glauconita – (K,Na)(Al,Mg,Fe) 2 (Si,Al) 4 O 10 (OH) 2
- Filosilicato, grupo de la mica, moscovita (rojo: Si, azul: O)
- Filosilicato, red simple de tetraedros con anillos de 4 miembros, serie apofilita- (KF)-apofilita-(KOH)
- Filosilicato, redes tetraédricas simples de anillos de 6 miembros, serie pirosmalita-(Fe)-pirosmalita-(Mn)
- Filosilicato, redes tetraédricas simples de anillos de 6 miembros, zeofilita
- Filosilicato, redes dobles con anillos de 4 y 6 miembros, carletonita
Tectosilicatos


.jpg/440px-Lunar_Ferroan_Anorthosite_(60025).jpg)
Los tectosilicatos, o "silicatos de estructura", tienen una estructura tridimensional de tetraedros de silicato con SiO 2 en una proporción de 1:2. Este grupo comprende casi el 75% de la corteza terrestre . [6] Los tectosilicatos, con excepción del grupo del cuarzo, son aluminosilicatos . Las clasificaciones de Nickel-Strunz son 09.F y 09.G, 04.DA (familia del cuarzo/sílice). Algunos ejemplos son:
- Silicatos 3D, familia del cuarzo
- Cuarzo – SiO2
- Tridimita – SiO2
- Cristobalita – SiO 2
- Coesita – SiO2
- Stishovita – SiO2
- Moganita – SiO2
- Calcedonia – SiO 2
- Tectosilicatos, grupo de los feldespatos
- Feldespatos alcalinos (feldespatos potásicos)
- Microclina – KAlSi3O8
- Ortoclasa – KAlSi3O8
- Anortoclasa – (Na,K)AlSi 3 O 8
- Sanidina – KAlSi3O8
- Feldespatos de plagioclasa
- Albita – NaAlSi3O8
- Oligoclasa – (Na,Ca)(Si,Al) 4 O 8 (Na:Ca 4:1)
- Andesina – (Na,Ca)(Si,Al) 4 O 8 (Na:Ca 3:2)
- Labradorita – (Ca,Na)(Si,Al) 4 O 8 (Na:Ca 2:3)
- Bytownita – (Ca,Na)(Si,Al) 4 O 8 (Na:Ca 1:4)
- Anortita – CaAl2Si2O8
- Feldespatos alcalinos (feldespatos potásicos)
- Tectosilicatos, familia de los feldespatoides
- Tectosilicatos, grupo escapolita .
- Tectosilicatos, familia de las zeolitas.
- Natrolita – Na 2 Al 2 Si 3 O 10 ·2H 2 O
- Erionita – (Na 2 ,K 2 ,Ca) 2 Al 4 Si 14 O 36 ·15H 2 O
- Chabazita – CaAl 2 Si 4 O 12 ·6H 2 O
- Heulandita – CaAl 2 Si 7 O 18 ·6H 2 O
- Estilbita – NaCa 2 Al 5 Si 13 O 36 ·17H 2 O
- Escolecita – CaAl 2 Si 3 O 10 ·3H 2 O
- Mordenita – (Ca,Na 2 ,K 2 )Al 2 Si 10 O 24 ·7H 2 O
- Analcima – NaAlSi 2 O 6 ·H 2 O
Véase también
- Clasificación de minerales no silicatados – Lista de minerales y agrupaciones reconocidas por la IMA
- Clasificación de los minerales de silicato – Lista de minerales y grupos reconocidos por la IMA
- Pintura mineral de silicato – Capas de pintura con aglutinantes minerales
Referencias
- ^ "Mineral - Silicatos". britannica.com . Archivado desde el original el 25 de octubre de 2017 . Consultado el 8 de mayo de 2018 .
- ^ Deer, WA; Howie, RA; Zussman, J. (1992). Introducción a los minerales formadores de rocas (2.ª ed.). Londres: Longman. ISBN 0-582-30094-0.
- ^ Hurlbut, Cornelius S.; Klein, Cornelis (1985). Manual de mineralogía (20.ª edición). Wiley. ISBN 0-47180580-7.
- ^ Deer, WA; Howie, RA y Zussman, J. (1992). Introducción a los minerales formadores de rocas (segunda edición). Londres: Longman ISBN 0-582-30094-0
- ^ Hurlbut, Cornelius S.; Klein, Cornelis ||1985). Manual de mineralogía , Wiley, (20.ª edición). ISBN 0-471-80580-7
- ^ Deer, WA; Howie, RA; Wise, WS; Zussman, J. (2004). Minerales formadores de rocas. Volumen 4B. Silicatos estructurales: minerales de sílice. Feldespatoides y zeolitas (2.ª ed.). Londres: Geological Society of London. pág. 982 pp.
Enlaces externos
- Mindat.org, clasificación de Dana
- Webmineral: La nueva clasificación de silicatos de Dana
![6 unidades [Si6O18], berilo (rojo: Si, azul: O)](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Beryll.ring.combined.png/120px-Beryll.ring.combined.png)
![3 unidades [Si3O9], benitoíta](http://upload.wikimedia.org/wikipedia/commons/thumb/6/60/Benitoid.2200.png/120px-Benitoid.2200.png)
![4 unidades [Si4O12], papagoíta](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Papagoite.2200.png/120px-Papagoite.2200.png)
![9 unidades [Si9O27], eudialita](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5d/Eudialyte.2200.png/120px-Eudialyte.2200.png)
![12 unidades, doble anillo [Si12O30], milarita](http://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Milarite.png/120px-Milarite.png)