Electrón de valencia
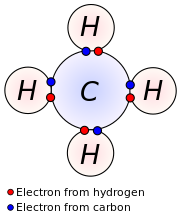
En química y física , los electrones de valencia son electrones que se encuentran en la capa más externa de un átomo y que pueden participar en la formación de un enlace químico si la capa más externa no está cerrada. En un enlace covalente simple , se forma un par compartido con ambos átomos del enlace, cada uno de los cuales aporta un electrón de valencia.
La presencia de electrones de valencia puede determinar las propiedades químicas del elemento , como su valencia (si puede unirse con otros elementos y, de ser así, con qué facilidad y con cuántos). De esta manera, la reactividad de un elemento determinado depende en gran medida de su configuración electrónica . En el caso de un elemento del grupo principal , un electrón de valencia solo puede existir en la capa electrónica más externa ; en el caso de un metal de transición , un electrón de valencia también puede estar en una capa interna.
Un átomo con una capa cerrada de electrones de valencia (que corresponde a una configuración de gas noble ) tiende a ser químicamente inerte . Los átomos con uno o dos electrones de valencia más que una capa cerrada son altamente reactivos debido a la energía relativamente baja para eliminar los electrones de valencia adicionales para formar un ion positivo . Un átomo con uno o dos electrones menos que una capa cerrada es reactivo debido a su tendencia a ganar los electrones de valencia faltantes y formar un ion negativo, o bien a compartir electrones de valencia y formar un enlace covalente.
De manera similar a un electrón central , un electrón de valencia tiene la capacidad de absorber o liberar energía en forma de fotón . Una ganancia de energía puede hacer que el electrón se mueva (salte) a una capa exterior; esto se conoce como excitación atómica . O el electrón puede incluso liberarse de la capa de su átomo asociado; esto es ionización para formar un ion positivo. Cuando un electrón pierde energía (lo que provoca la emisión de un fotón), puede moverse a una capa interior que no está completamente ocupada.
Descripción general
Configuración electrónica
Los electrones que determinan la valencia (cómo reacciona químicamente un átomo) son aquellos con mayor energía .
Para un elemento del grupo principal , los electrones de valencia se definen como aquellos electrones que residen en la capa electrónica de mayor número cuántico principal n . [1] Por lo tanto, el número de electrones de valencia que puede tener depende de la configuración electrónica de una manera sencilla. Por ejemplo, la configuración electrónica del fósforo (P) es 1s 2 2s 2 2p 6 3s 2 3p 3 de modo que hay 5 electrones de valencia (3s 2 3p 3 ), correspondientes a una valencia máxima para P de 5 como en la molécula PF 5 ; esta configuración normalmente se abrevia a [Ne] 3s 2 3p 3 , donde [Ne] significa los electrones del núcleo cuya configuración es idéntica a la del gas noble neón .
Sin embargo, los elementos de transición tienen niveles de energía ( n −1)d que son muy cercanos en energía al nivel n s . [2] Por lo tanto, a diferencia de los elementos del grupo principal, un electrón de valencia para un metal de transición se define como un electrón que reside fuera de un núcleo de gas noble. [3] Por lo tanto, generalmente, los electrones d en los metales de transición se comportan como electrones de valencia aunque no estén en la capa más externa. Por ejemplo, el manganeso (Mn) tiene configuración 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 ; esto se abrevia a [Ar] 4s 2 3d 5 , donde [Ar] denota una configuración de núcleo idéntica a la del gas noble argón . En este átomo, un electrón 3d tiene energía similar a la de un electrón 4s, y mucho mayor que la de un electrón 3s o 3p. En efecto, posiblemente haya siete electrones de valencia (4s 2 3d 5 ) fuera del núcleo tipo argón; esto es consistente con el hecho químico de que el manganeso puede tener un estado de oxidación tan alto como +7 (en el ion permanganato : MnO−
4). (Pero tenga en cuenta que el mero hecho de tener esa cantidad de electrones de valencia no implica que exista el estado de oxidación correspondiente. Por ejemplo, no se conoce el estado de oxidación +7 del flúor ; y aunque la cantidad máxima conocida de electrones de valencia es 16 en el iterbio y el nobelio , no se conoce ningún estado de oxidación superior a +9 para ningún elemento).
Cuanto más a la derecha se encuentre en cada serie de metales de transición, menor será la energía de un electrón en la subcapa d y menos propiedades de valencia tendrá dicho electrón. Por lo tanto, aunque un átomo de níquel tiene, en principio, diez electrones de valencia (4s 2 3d 8 ), su estado de oxidación nunca supera los cuatro. En el caso del zinc , la subcapa 3d está completa en todos los compuestos conocidos, aunque sí contribuye a la banda de valencia en algunos compuestos. [4] Se mantienen patrones similares para los niveles de energía ( n −2)f de los metales de transición internos.
El recuento de electrones d es una herramienta alternativa para comprender la química de un metal de transición.
El número de electrones de valencia
El número de electrones de valencia de un elemento se puede determinar a partir del grupo de la tabla periódica (columna vertical) en el que se clasifica el elemento. En los grupos 1 a 12, el número de grupo coincide con el número de electrones de valencia; en los grupos 13 a 18, el dígito de las unidades del número de grupo coincide con el número de electrones de valencia. (El helio es la única excepción). [5]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H1 | El 2 | ||||||||||||||||||||||||||||||
| 2 | 1 año | Ser 2 | B3 | C 4 | N° 5 | El 6 | F7 | No 8 | ||||||||||||||||||||||||
| 3 | El 1 | Mg2 | Al 3 | Sí 4 | Pág. 5 | S 6 | Clase 7 | 8 de abril | ||||||||||||||||||||||||
| 4 | K1 | Ca 2 | Sc 3 | Ti 4 | V.5 | Cr6 | Mn7 | Fe 8 | Compañía 9 | Ni 10 | Cu 11 | Zinc 12 | Ga 3 | 4 de julio | Como 5 | Se 6 | Br 7 | Kr 8 | ||||||||||||||
| 5 | Rb1 | Sr 2 | Año 3 | Zr 4 | Número 5 | Lunes 6 | Tc7 | Ru 8 | Rh 9 | Pd10 | 11 de agosto | CD 12 | En 3 | Sn 4 | Sb 5 | El 6 | Yo 7 | Xe8 | ||||||||||||||
| 6 | Cs 1 | Ba 2 | La 3 | El 4 | Pr 5 | N° 6 | 7 pm | Pequeño 8 | UE 9 | Dios 10 | tuberculosis 11 | Día 12 | 13 de mayo | Era 14 | TM 15 | Año 16 | Lunes 3 | Hf4 | 5 de mayo | W 6 | Re 7 | Os 8 | Ir 9 | Parte 10 | 11 de agosto | Hg12 | Número 3 | Pb4 | Bi 5 | Po 6 | A las 7 | Carrera 8 |
| 7 | Es 1 | Ra 2 | Ac 3 | Jueves 4 | Pa 5 | U 6 | np 7 | 8 de mayo | Tengo 9 años | cm10 | Libro 11 | Cf. 12 | Es 13 | Fm 14 | 15 de marzo | N° 16 | Lr 3 | Rf 4 | Db5 | Sg6 | 7 bh | 8º grado | Monte 9 | Ds10 | Rg11 | Cn 12 | Nh3 | Piso 4 | Mc 5 | Nivel 6 | Ts7 | Ocho |
El helio es una excepción: a pesar de tener una configuración 1s 2 con dos electrones de valencia, y por lo tanto tener algunas similitudes con los metales alcalinotérreos con sus configuraciones de valencia n s 2 , su capa está completamente llena y por lo tanto es químicamente muy inerte y generalmente se coloca en el grupo 18 con los otros gases nobles.
Capa de valencia
La capa de valencia es el conjunto de orbitales que son energéticamente accesibles para aceptar electrones para formar enlaces químicos .
En el caso de los elementos del grupo principal, la capa de valencia consta de los orbitales n s y n p en la capa electrónica más externa . En el caso de los metales de transición , se incluyen los orbitales de la subcapa incompleta ( n −1)d, y en el caso de los lantánidos y actínidos, las subcapas incompletas ( n −2)f y ( n −1)d. Los orbitales involucrados pueden estar en una capa electrónica interna y no todos corresponden a la misma capa electrónica o número cuántico principal n en un elemento dado, pero todos tienen energías similares. [5]
| Tipo de elemento | Hidrógeno y helio | Bloques s y p ( elementos del grupo principal ) | Bloque d ( metales de transición ) | Bloque f ( lantánidos y actínidos ) |
|---|---|---|---|---|
| Orbitales de valencia [6] |
|
|
|
|
| Reglas de conteo de electrones | Regla del dúo/duplete | Regla del octeto | Regla de los 18 electrones | Regla de los 32 electrones |
Como regla general, un elemento del grupo principal (excepto el hidrógeno o el helio) tiende a reaccionar para formar una configuración electrónica 2 p 6. Esta tendencia se denomina regla del octeto , porque cada átomo enlazado tiene 8 electrones de valencia, incluidos los electrones compartidos. De manera similar, un metal de transición tiende a reaccionar para formar una configuración electrónica 2 p 6 ad 10 s . Esta tendencia se denomina regla de los 18 electrones , porque cada átomo enlazado tiene 18 electrones de valencia, incluidos los electrones compartidos.
Los elementos pesados del grupo 2, calcio, estroncio y bario , también pueden utilizar la subcapa ( n −1)d, lo que les confiere algunas similitudes con los metales de transición. [7] [8] [9]
Reacciones químicas
La cantidad de electrones de valencia de un átomo determina su comportamiento de enlace . Por lo tanto, los elementos cuyos átomos tienen la misma cantidad de electrones de valencia suelen agruparse en la tabla periódica de los elementos, especialmente si también tienen los mismos tipos de orbitales de valencia. [10]
El tipo más reactivo de elemento metálico es un metal alcalino del grupo 1 (p. ej., sodio o potasio ); esto se debe a que dicho átomo tiene un solo electrón de valencia. Durante la formación de un enlace iónico , que proporciona la energía de ionización necesaria , este electrón de valencia se pierde fácilmente para formar un ion positivo (catión) con una capa cerrada (p. ej., Na + o K + ). Un metal alcalinotérreo del grupo 2 (p. ej., magnesio ) es algo menos reactivo, porque cada átomo debe perder dos electrones de valencia para formar un ion positivo con una capa cerrada (p. ej., Mg2 + ). [ cita requerida ]
Dentro de cada grupo (cada columna de la tabla periódica) de metales, la reactividad aumenta con cada fila inferior de la tabla (de un elemento ligero a un elemento más pesado), porque un elemento más pesado tiene más capas de electrones que un elemento más ligero; los electrones de valencia de un elemento más pesado existen en números cuánticos principales más altos (están más lejos del núcleo del átomo y, por lo tanto, tienen energías potenciales más altas, lo que significa que están menos fuertemente unidos). [ cita requerida ]
Un átomo no metálico tiende a atraer electrones de valencia adicionales para alcanzar una capa de valencia completa; esto se puede lograr de una de dos maneras: un átomo puede compartir electrones con un átomo vecino (un enlace covalente ), o puede quitar electrones de otro átomo (un enlace iónico ). El tipo más reactivo de elemento no metálico es un halógeno (por ejemplo, flúor (F) o cloro (Cl)). Un átomo de este tipo tiene la siguiente configuración electrónica: s 2 p 5 ; esto requiere solo un electrón de valencia adicional para formar una capa cerrada. Para formar un enlace iónico, un átomo de halógeno puede quitar un electrón de otro átomo para formar un anión (por ejemplo, F − , Cl − , etc.). Para formar un enlace covalente, un electrón del halógeno y un electrón de otro átomo forman un par compartido (por ejemplo, en la molécula H–F, la línea representa un par compartido de electrones de valencia, uno de H y uno de F). [ cita requerida ]
Dentro de cada grupo de no metales, la reactividad disminuye con cada fila inferior de la tabla periódica (de un elemento ligero a un elemento pesado), porque los electrones de valencia están a energías cada vez más altas y, por lo tanto, están ligados de forma progresivamente menos firme. De hecho, el oxígeno (el elemento más ligero del grupo 16) es el no metal más reactivo después del flúor, aunque no sea un halógeno, porque las capas de valencia de los halógenos más pesados están a números cuánticos principales más altos.
En estos casos sencillos en los que se cumple la regla del octeto, la valencia de un átomo es igual al número de electrones ganados, perdidos o compartidos para formar el octeto estable. Sin embargo, también hay muchas moléculas que son excepciones y para las que la valencia está menos claramente definida.
Conductividad eléctrica
Los electrones de valencia también son responsables del enlace en los elementos químicos puros y de si su conductividad eléctrica es característica de los metales, semiconductores o aislantes.
MetálicoRed covalenteCovalente molecularÁtomos individualesDesconocidoEl color de fondo muestra la unión de sustancias simples en la tabla periódica . Si hay varias, se considera el alótropo más estable.
Los elementos metálicos tienen generalmente una conductividad eléctrica alta cuando están en estado sólido . En cada fila de la tabla periódica , los metales aparecen a la izquierda de los no metales y, por lo tanto, un metal tiene menos electrones de valencia posibles que un no metal. Sin embargo, un electrón de valencia de un átomo de metal tiene una energía de ionización pequeña y, en estado sólido, este electrón de valencia es relativamente libre de abandonar un átomo para asociarse con otro cercano. Esta situación caracteriza el enlace metálico . Un electrón "libre" de este tipo puede moverse bajo la influencia de un campo eléctrico y su movimiento constituye una corriente eléctrica ; es responsable de la conductividad eléctrica del metal. El cobre , el aluminio , la plata y el oro son ejemplos de buenos conductores.
Un elemento no metálico tiene baja conductividad eléctrica; actúa como aislante . Un elemento de este tipo se encuentra hacia la derecha de la tabla periódica y tiene una capa de valencia que está al menos medio llena (la excepción es el boro ). Su energía de ionización es grande; un electrón no puede abandonar un átomo fácilmente cuando se le aplica un campo eléctrico y, por lo tanto, un elemento de este tipo solo puede conducir corrientes eléctricas muy pequeñas. Ejemplos de aislantes elementales sólidos son el diamante (un alótropo del carbono ) y el azufre . Estos forman estructuras enlazadas covalentemente, ya sea con enlaces covalentes que se extienden a lo largo de toda la estructura (como en el diamante) o con moléculas covalentes individuales atraídas débilmente entre sí por fuerzas intermoleculares (como en el azufre). (Los gases nobles permanecen como átomos individuales, pero también experimentan fuerzas de atracción intermoleculares, que se vuelven más fuertes a medida que se desciende en el grupo: el helio hierve a −269 °C, mientras que el radón hierve a −61,7 °C).
Un compuesto sólido que contiene metales también puede ser un aislante si los electrones de valencia de los átomos de metal se utilizan para formar enlaces iónicos . Por ejemplo, aunque el sodio elemental es un metal, el cloruro de sodio sólido es un aislante, porque el electrón de valencia del sodio se transfiere al cloro para formar un enlace iónico y, por lo tanto, ese electrón no se puede mover fácilmente.
Un semiconductor tiene una conductividad eléctrica intermedia entre la de un metal y la de un no metal; un semiconductor también se diferencia de un metal en que la conductividad de un semiconductor aumenta con la temperatura . Los semiconductores elementales típicos son el silicio y el germanio , cada átomo de los cuales tiene cuatro electrones de valencia. Las propiedades de los semiconductores se explican mejor utilizando la teoría de bandas , como consecuencia de una pequeña brecha de energía entre una banda de valencia (que contiene los electrones de valencia en el cero absoluto) y una banda de conducción (a la que los electrones de valencia son excitados por la energía térmica).
Referencias
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Química general: principios y aplicaciones modernas (8.ª ed.). Upper Saddle River, NJ: Prentice Hall. pág. 339. ISBN 978-0-13-014329-7. OCLC 46872308 .
- ^ El orden de llenado de los orbitales 3d y 4s. chemguide.co.uk
- ^ Miessler GL y Tarr, DA, Química inorgánica (2.ª ed. Prentice-Hall 1999). pág. 48.
- ^ Tossell, JA (1 de noviembre de 1977). "Estudios teóricos de las energías de enlace de los orbitales de valencia en sulfuro de cinc sólido, óxido de cinc y fluoruro de cinc". Química inorgánica . 16 (11): 2944–2949. doi :10.1021/ic50177a056.
- ^ ab Keeler, James; Wothers, Peter (2014). Estructura y reactividad química (2.ª ed.). Oxford University Press. págs. 257–260. ISBN 978-0-19-9604135.
- ^ Chi, Chaoxian; Pan, Sudip; Jin, Jiaye; Meng, Luyan; Luo, Mingbiao; Zhao, Lili; Zhou, Mingfei; Frenking, Gernot (2019). "Complejos de iones octacarbonilo de actínidos [An(CO)8]+/− (An=Th, U) y el papel de los orbitales f en la unión metal-ligando". Química. Revista Europea de Química. 25 (50): 11772–11784. doi : 10.1002/chem.201902625 . PMC 6772027 . PMID 31276242.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 117. ISBN 978-0-08-037941-8.
- ^ Zhou, Mingfei; Frenking, Gernot (2021). "Química de metales de transición de los átomos alcalinotérreos más pesados Ca, Sr y Ba". Accounts of Chemical Research . 54 (15): 3071–3082. doi :10.1021/acs.accounts.1c00277. PMID 34264062. S2CID 235908113.
- ^ Fernández, Israel; Holzmann, Nicole; Frenking, Gernot (2020). "Los orbitales de valencia de los átomos alcalinotérreos". Química: una revista europea . 26 (62): 14194–14210. doi : 10.1002/chem.202002986 . PMC 7702052 . PMID 32666598.
- ^ Jensen, William B. (2000). "La ley y la tabla periódica" (PDF) . Archivado desde el original (PDF) el 2020-11-10 . Consultado el 10 de diciembre de 2022 .
Enlaces externos
- Francis, Eden. Electrones de valencia.