Espectroscopia infrarroja

La espectroscopia infrarroja ( espectroscopia IR o espectroscopia vibracional ) es la medición de la interacción de la radiación infrarroja con la materia por absorción , emisión o reflexión . Se utiliza para estudiar e identificar sustancias químicas o grupos funcionales en forma sólida, líquida o gaseosa. Se puede utilizar para caracterizar nuevos materiales o identificar y verificar muestras conocidas y desconocidas. El método o técnica de la espectroscopia infrarroja se lleva a cabo con un instrumento llamado espectrómetro infrarrojo (o espectrofotómetro) que produce un espectro infrarrojo . Un espectro IR se puede visualizar en un gráfico de absorbancia (o transmitancia ) de luz infrarroja en el eje vertical frente a frecuencia , número de onda o longitud de onda en el eje horizontal. Las unidades típicas de número de onda utilizadas en los espectros IR son centímetros recíprocos , con el símbolo cm −1 . Las unidades de longitud de onda IR se dan comúnmente en micrómetros (antes llamados "micrones"), símbolo μm, que están relacionados con el número de onda de forma recíproca . Un instrumento de laboratorio común que utiliza esta técnica es un espectrómetro infrarrojo por transformada de Fourier (FTIR) . También es posible la técnica de infrarrojos bidimensional, como se explica a continuación.
La porción infrarroja del espectro electromagnético se divide generalmente en tres regiones: el infrarrojo cercano , medio y lejano , llamados así por su relación con el espectro visible. El infrarrojo cercano de mayor energía, aproximadamente 14.000–4.000 cm −1 (longitud de onda de 0,7–2,5 μm) puede excitar modos armónicos o combinados de vibraciones moleculares . El infrarrojo medio, aproximadamente 4.000–400 cm −1 (2,5–25 μm) se utiliza generalmente para estudiar las vibraciones fundamentales y la estructura rotacional-vibratoria asociada . El infrarrojo lejano, aproximadamente 400–10 cm −1 (25–1.000 μm) tiene baja energía y puede utilizarse para espectroscopia rotacional y vibraciones de baja frecuencia. La región de 2–130 cm −1 , que bordea la región de microondas , se considera la región de terahercios y puede sondear vibraciones intermoleculares. [1] Los nombres y clasificaciones de estas subregiones son convenciones y se basan vagamente en las propiedades moleculares o electromagnéticas relativas.
Usos y aplicaciones

_(8225044148).jpg/440px-Portable_Screening_Devices_(1435)_(8225044148).jpg)
La espectroscopia infrarroja es una técnica sencilla y fiable que se utiliza ampliamente tanto en química orgánica como inorgánica, en investigación y en la industria. En la investigación en catálisis es una herramienta muy útil para caracterizar el catalizador [2] [3] [4] , así como para detectar intermediarios [5] y productos durante la reacción catalítica. Se utiliza en aplicaciones de control de calidad, medición dinámica y monitorización, como la medición desatendida a largo plazo de concentraciones de CO2 en invernaderos y cámaras de crecimiento mediante analizadores de gases infrarrojos. [ cita requerida ]
También se utiliza en análisis forenses en casos civiles y penales, por ejemplo, para identificar la degradación de polímeros . Se puede utilizar para determinar el contenido de alcohol en sangre de un presunto conductor ebrio.
La espectroscopia IR se ha utilizado con éxito en el análisis e identificación de pigmentos en pinturas [6] y otros objetos de arte [7] como manuscritos iluminados . [8]
La espectroscopia infrarroja también es útil para medir el grado de polimerización en la fabricación de polímeros . Los cambios en el carácter o la cantidad de un enlace en particular se evalúan midiendo a una frecuencia específica a lo largo del tiempo. Los instrumentos de investigación modernos pueden tomar mediciones infrarrojas en todo el rango de interés con una frecuencia de hasta 32 veces por segundo. Esto se puede hacer mientras se realizan mediciones simultáneas utilizando otras técnicas. Esto hace que las observaciones de reacciones y procesos químicos sean más rápidas y precisas. [ cita requerida ]
La espectroscopia infrarroja también se ha utilizado con éxito en el campo de la microelectrónica de semiconductores: [9] por ejemplo, la espectroscopia infrarroja se puede aplicar a semiconductores como silicio , arseniuro de galio , nitruro de galio , seleniuro de zinc , silicio amorfo, nitruro de silicio , etc.
Otra aplicación importante de la espectroscopia infrarroja es en la industria alimentaria para medir la concentración de diversos compuestos en diferentes productos alimenticios. [10] [11]
Los instrumentos ahora son pequeños y pueden transportarse, incluso para su uso en ensayos de campo. [ cita requerida ]
La espectroscopia infrarroja también se utiliza en dispositivos de detección de fugas de gas como el DP-IR y el EyeCGAs. [12] Estos dispositivos detectan fugas de gas de hidrocarburos en el transporte de gas natural y petróleo crudo.
En febrero de 2014, la NASA anunció una base de datos muy mejorada, [13] basada en espectroscopia IR, para rastrear hidrocarburos aromáticos policíclicos (HAP) en el universo . Según los científicos, más del 20% del carbono en el universo puede estar asociado con HAP, posibles materiales de partida para la formación de la vida . Los HAP parecen haberse formado poco después del Big Bang , están ampliamente distribuidos por todo el universo y están asociados con nuevas estrellas y exoplanetas . [14]
La espectroscopia infrarroja es un método de análisis importante en el proceso de reciclaje de residuos plásticos domésticos y un método conveniente para separar plásticos de diferentes polímeros ( PET , HDPE , ...). [15]
Otros desarrollos incluyen un espectrómetro IR en miniatura que está vinculado a una base de datos basada en la nube y es adecuado para el uso personal diario [16] , y chips espectroscópicos NIR [17] que se pueden integrar en teléfonos inteligentes y varios dispositivos.
La espectroscopia infrarroja combinada con el aprendizaje automático y la inteligencia artificial también tiene potencial para la detección rápida, precisa y no invasiva de bacterias. [18] La compleja composición química de las bacterias, que incluye ácidos nucleicos, proteínas, carbohidratos y ácidos grasos, da como resultado conjuntos de datos de alta dimensión donde las características esenciales están efectivamente ocultas bajo el espectro total. Por lo tanto, la extracción de las características esenciales requiere métodos estadísticos avanzados como el aprendizaje automático y las redes neuronales profundas. El potencial de esta técnica para la clasificación de bacterias se ha demostrado para la diferenciación a nivel taxonómico de género [19] , especie [20] y serotipo [21] , y también se ha mostrado prometedora para las pruebas de susceptibilidad a los antimicrobianos, [22] [23] [24] lo cual es importante para muchos entornos clínicos donde una prueba de susceptibilidad más rápida disminuiría el tratamiento ciego innecesario con antibióticos de amplio espectro. La principal limitación de esta técnica para aplicaciones clínicas es la alta sensibilidad a los equipos técnicos y las técnicas de preparación de muestras, lo que dificulta la construcción de bases de datos a gran escala. Sin embargo, Bruker ha realizado intentos en esta dirección con el IR Biotyper para la microbiología de alimentos. [25]
Teoría

La espectroscopia infrarroja aprovecha el hecho de que las moléculas absorben frecuencias que son características de su estructura . Estas absorciones se producen a frecuencias resonantes , es decir, la frecuencia de la radiación absorbida coincide con la frecuencia vibracional. Las energías se ven afectadas por la forma de las superficies de energía potencial molecular , las masas de los átomos y el acoplamiento vibrónico asociado . [ cita requerida ]

En particular, en las aproximaciones de Born-Oppenheimer y armónicas (es decir, cuando el hamiltoniano molecular correspondiente al estado fundamental electrónico puede aproximarse mediante un oscilador armónico en la vecindad de la geometría molecular de equilibrio ), las frecuencias resonantes están asociadas con los modos normales de vibración correspondientes a la superficie de energía potencial del estado fundamental electrónico molecular . Por lo tanto, depende tanto de la naturaleza de los enlaces como de la masa de los átomos involucrados. El uso de la ecuación de Schrödinger conduce a la regla de selección para el número cuántico vibracional en el sistema que experimenta cambios vibracionales:
La compresión y extensión de un enlace puede compararse con el comportamiento de un resorte , pero las moléculas reales no son perfectamente elásticas por naturaleza. Si se estira un enlace entre átomos, por ejemplo, llega un punto en el que el enlace se rompe y la molécula se disocia en átomos. Por lo tanto, las moléculas reales se desvían del movimiento armónico perfecto y su movimiento vibracional molecular es anarmónico . Una expresión empírica que ajusta la curva de energía de una molécula diatómica que experimenta una extensión y compresión anarmónicas con una buena aproximación fue derivada por PM Morse , y se llama función de Morse . El uso de la ecuación de Schrödinger conduce a la regla de selección para el sistema que experimenta cambios vibracionales:
[26]
Número de modos vibracionales
Para que un modo vibracional en una muestra sea "activo en el infrarrojo", debe estar asociado con cambios en el momento dipolar molecular. No es necesario un dipolo permanente, ya que la regla solo requiere un cambio en el momento dipolar. [27]
Una molécula puede vibrar de muchas maneras, y cada una de ellas se denomina modo vibracional . En el caso de moléculas con un número N de átomos, las moléculas geométricamente lineales tienen 3 N – 5 grados de modos vibracionales, mientras que las moléculas no lineales tienen 3 N – 6 grados de modos vibracionales (también llamados grados de libertad vibracionales). Como ejemplos, el dióxido de carbono lineal (CO 2 ) tiene 3 × 3 – 5 = 4, mientras que el agua no lineal (H 2 O) tiene solo 3 × 3 – 6 = 3. [ cita requerida ]

Las moléculas diatómicas simples tienen un solo enlace y una sola banda vibracional. Si la molécula es simétrica, p. ej. N 2 , la banda no se observa en el espectro IR, sino solo en el espectro Raman . Las moléculas diatómicas asimétricas, p. ej. monóxido de carbono ( CO ), absorben en el espectro IR. Las moléculas más complejas tienen muchos enlaces y sus espectros vibracionales son correspondientemente más complejos, es decir, las moléculas grandes tienen muchos picos en sus espectros IR. [ cita requerida ]
Los átomos de un grupo CH 2 X 2 , que se encuentra comúnmente en compuestos orgánicos y donde X puede representar cualquier otro átomo, pueden vibrar de nueve maneras diferentes. Seis de estas vibraciones involucran solo la porción CH 2 : dos modos de estiramiento (ν): simétrico (ν s ) y antisimétrico (ν as ); y cuatro modos de flexión : tijera (δ), balanceo (ρ), meneo (ω) y torsión (τ), como se muestra a continuación. Las estructuras que no tienen los dos grupos X adicionales unidos tienen menos modos porque algunos modos están definidos por relaciones específicas con esos otros grupos unidos. Por ejemplo, en el agua, los modos de balanceo, meneo y torsión no existen porque estos tipos de movimientos de los átomos de H representan una simple rotación de toda la molécula en lugar de vibraciones dentro de ella. En el caso de moléculas más complejas, también pueden estar presentes modos vibracionales fuera del plano (γ). [28]
Simetría Dirección | Simétrico | Antisimétrico |
|---|---|---|
| Radial |  Estiramiento simétrico (ν s ) |  Estiramiento antisimétrico (ν as ) |
| Latitudinal |  Tijera (δ) |  Balanceándose (ρ) |
| Longitudinal |  Meneando (ω) |  Torsión (τ) |
Estas cifras no representan el " retroceso " de los átomos de C , que, aunque están necesariamente presentes para equilibrar los movimientos generales de la molécula, son mucho menores que los movimientos de los átomos de H, más ligeros .
Las bandas IR más simples e importantes o fundamentales surgen de las excitaciones de los modos normales, las distorsiones más simples de la molécula, desde el estado fundamental con número cuántico vibracional v = 0 hasta el primer estado excitado con número cuántico vibracional v = 1. En algunos casos, se observan bandas de sobretonos . Una banda de sobretonos surge de la absorción de un fotón que conduce a una transición directa del estado fundamental al segundo estado vibracional excitado ( v = 2 ). Dicha banda aparece aproximadamente a una energía dos veces mayor que la banda fundamental para el mismo modo normal. Algunas excitaciones, llamadas modos de combinación , implican la excitación simultánea de más de un modo normal. El fenómeno de la resonancia de Fermi puede surgir cuando dos modos son similares en energía; la resonancia de Fermi da como resultado un cambio inesperado en la energía y la intensidad de las bandas, etc. [ cita requerida ]
Espectroscopia IR práctica
El espectro infrarrojo de una muestra se registra al pasar un haz de luz infrarroja a través de la muestra. Cuando la frecuencia de la luz infrarroja es la misma que la frecuencia vibratoria de un enlace o conjunto de enlaces, se produce la absorción. El examen de la luz transmitida revela cuánta energía se absorbió en cada frecuencia (o longitud de onda). Esta medición se puede lograr escaneando el rango de longitud de onda utilizando un monocromador . Alternativamente, se mide todo el rango de longitud de onda utilizando un instrumento de transformada de Fourier y luego se genera un espectro de transmitancia o absorbancia utilizando un procedimiento dedicado. [ cita requerida ]
Esta técnica se utiliza habitualmente para analizar muestras con enlaces covalentes . Los espectros simples se obtienen a partir de muestras con pocos enlaces activos IR y altos niveles de pureza. Las estructuras moleculares más complejas dan lugar a más bandas de absorción y espectros más complejos. [ cita requerida ]

Preparación de muestras
Muestras de gas
Las muestras gaseosas requieren una celda de muestra con un largo camino óptico para compensar la dilución. El camino óptico de la celda de muestra depende de la concentración del compuesto de interés. Se puede utilizar un simple tubo de vidrio con una longitud de 5 a 10 cm equipado con ventanas transparentes a los rayos infrarrojos en ambos extremos del tubo para concentraciones de hasta varios cientos de ppm. Las concentraciones de gas de muestra muy por debajo de ppm se pueden medir con una celda de White en la que la luz infrarroja se guía con espejos para viajar a través del gas. Las celdas de White están disponibles con un camino óptico que va desde 0,5 m hasta cientos de metros. [ cita requerida ]
Muestras liquidas
Las muestras líquidas se pueden colocar entre dos placas de una sal (comúnmente cloruro de sodio o sal común, aunque también se utilizan otras sales como el bromuro de potasio o el fluoruro de calcio ). [29] Las placas son transparentes a la luz infrarroja y no introducen ninguna línea en los espectros. Con el aumento de la tecnología en el filtrado informático y la manipulación de los resultados, las muestras en solución ahora se pueden medir con precisión (el agua produce una amplia absorbancia en todo el rango de interés y, por lo tanto, hace que los espectros sean ilegibles sin este tratamiento informático). [ cita requerida ]
Muestras sólidas
Las muestras sólidas se pueden preparar de diversas maneras. Un método común es triturar la muestra con un agente de trituración oleoso (generalmente aceite mineral Nujol ). Se aplica una película delgada de la mezcla sobre placas de sal y se mide. El segundo método es moler una cantidad de la muestra con una sal especialmente purificada (generalmente bromuro de potasio ) finamente (para eliminar los efectos de dispersión de los cristales grandes). Esta mezcla de polvo se prensa luego en una prensa mecánica para formar un gránulo translúcido a través del cual puede pasar el haz del espectrómetro. [29] Una tercera técnica es la técnica de "película fundida", que se utiliza principalmente para materiales poliméricos. La muestra se disuelve primero en un disolvente adecuado, no higroscópico . Una gota de esta solución se deposita en la superficie de una celda de KBr o NaCl . Luego, la solución se evapora a sequedad y la película formada en la celda se analiza directamente. Es importante tener cuidado de asegurar que la película no sea demasiado gruesa, de lo contrario, la luz no puede pasar a través. Esta técnica es adecuada para el análisis cualitativo. El último método consiste en utilizar la microtomía para cortar una película fina (de 20 a 100 μm) de una muestra sólida. Esta es una de las formas más importantes de analizar productos plásticos defectuosos, por ejemplo, porque se preserva la integridad del sólido. [ cita requerida ]
En la espectroscopia fotoacústica, la necesidad de tratamiento de la muestra es mínima. La muestra, líquida o sólida, se coloca en un recipiente para muestras que se inserta en la celda fotoacústica y que luego se sella para la medición. La muestra puede ser una pieza sólida, polvo o básicamente cualquier forma para la medición. Por ejemplo, se puede insertar un trozo de roca en el recipiente para muestras y medir el espectro a partir de él. [ cita requerida ]
Una forma útil de analizar muestras sólidas sin necesidad de cortarlas es mediante la espectroscopia de reflectancia total atenuada (ATR) . Con este método, las muestras se presionan contra la cara de un solo cristal. La radiación infrarroja pasa a través del cristal y solo interactúa con la muestra en la interfaz entre los dos materiales. [ cita requerida ]
Comparando con una referencia
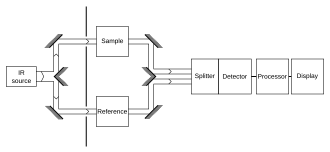
Es habitual registrar el espectro tanto de la muestra como de una "referencia". Este paso controla una serie de variables, por ejemplo, el detector de infrarrojos , que pueden afectar al espectro. La medición de referencia permite eliminar la influencia del instrumento. [ cita requerida ]
La "referencia" adecuada depende de la medición y su objetivo. La medición de referencia más sencilla consiste simplemente en retirar la muestra (reemplazándola por aire). Sin embargo, a veces es más útil una referencia diferente. Por ejemplo, si la muestra es un soluto diluido disuelto en agua en un vaso de precipitados, una buena medición de referencia podría ser medir agua pura en el mismo vaso de precipitados. En ese caso, la medición de referencia anularía no solo todas las propiedades instrumentales (como la fuente de luz utilizada), sino también las propiedades de absorción y reflexión de la luz del agua y del vaso de precipitados, y el resultado final solo mostraría las propiedades del soluto (al menos de forma aproximada). [ cita requerida ]
Una forma habitual de comparar con una referencia es de forma secuencial: primero se mide la referencia, luego se reemplaza la referencia por la muestra y se mide la muestra. Esta técnica no es totalmente fiable; si la lámpara infrarroja es un poco más brillante durante la medición de referencia y luego un poco más tenue durante la medición de la muestra, la medición estará distorsionada. Métodos más elaborados, como una configuración de "dos haces" (ver figura), pueden corregir este tipo de efectos para dar resultados muy precisos. El método de adición estándar se puede utilizar para cancelar estadísticamente estos errores.
Sin embargo, entre las diferentes técnicas basadas en absorción que se utilizan para la detección de especies gaseosas, la espectroscopia de cavidad de anillo descendente (CRDS) puede utilizarse como un método sin calibración. El hecho de que la CRDS se base en las mediciones de los tiempos de vida de los fotones (y no en la intensidad del láser) hace que no sea necesaria ninguna calibración ni comparación con una referencia [30].
Algunos instrumentos también identifican automáticamente la sustancia que se está midiendo a partir de un conjunto de miles de espectros de referencia guardados en memoria.
Transmisor de infrarrojos
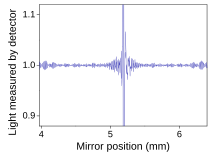
La espectroscopia infrarroja por transformada de Fourier (FTIR) es una técnica de medición que permite registrar espectros infrarrojos. La luz infrarroja se guía a través de un interferómetro y luego a través de la muestra (o viceversa). Un espejo móvil dentro del aparato altera la distribución de la luz infrarroja que pasa a través del interferómetro. La señal registrada directamente, llamada "interferograma", representa la salida de luz en función de la posición del espejo. Una técnica de procesamiento de datos llamada transformada de Fourier convierte estos datos sin procesar en el resultado deseado (el espectro de la muestra): la salida de luz en función de la longitud de onda infrarroja (o equivalentemente, el número de onda ). Como se describió anteriormente, el espectro de la muestra siempre se compara con una referencia. [ cita requerida ]
Un método alternativo para adquirir espectros es el método "dispersivo" o " monocromador de barrido ". En este enfoque, la muestra se irradia secuencialmente con varias longitudes de onda individuales. El método dispersivo es más común en la espectroscopia UV-Vis , pero es menos práctico en el infrarrojo que el método FTIR. Una razón por la que se favorece el FTIR se llama " ventaja de Fellgett " o "ventaja multiplex": la información en todas las frecuencias se recopila simultáneamente, mejorando tanto la velocidad como la relación señal-ruido . Otra se llama "ventaja de rendimiento de Jacquinot": una medición dispersiva requiere detectar niveles de luz mucho más bajos que una medición FTIR. [31] Hay otras ventajas, así como algunas desventajas, [31] pero prácticamente todos los espectrómetros infrarrojos modernos son instrumentos FTIR.
Microscopía infrarroja
Existen varias formas de microscopía infrarroja , entre ellas, las versiones IR de la microscopía de subdifracción [32], como la IR NSOM , [33] la microespectroscopia fototérmica , la nano-FTIR y la espectroscopia infrarroja basada en microscopio de fuerza atómica (AFM-IR).
Otros métodos en espectroscopia vibracional molecular
La espectroscopia infrarroja no es el único método para estudiar los espectros vibracionales moleculares. La espectroscopia Raman implica un proceso de dispersión inelástica en el que solo una parte de la energía de un fotón incidente es absorbida por la molécula, y la parte restante se dispersa y se detecta. La diferencia de energía corresponde a la energía vibracional absorbida. [ cita requerida ]
Las reglas de selección para la espectroscopia infrarroja y la espectroscopia Raman son diferentes al menos para algunas simetrías moleculares , de modo que los dos métodos son complementarios en el sentido de que observan vibraciones de diferentes simetrías. [ cita requerida ]
Otro método es la espectroscopia de pérdida de energía de electrones (EELS), en la que la energía absorbida la proporciona un electrón dispersado de forma inelástica en lugar de un fotón. Este método es útil para estudiar las vibraciones de las moléculas adsorbidas en una superficie sólida.
Recientemente, la EELS de alta resolución (HREELS) ha surgido como una técnica para realizar espectroscopia vibracional en un microscopio electrónico de transmisión (TEM). [34] En combinación con la alta resolución espacial del TEM, se han realizado experimentos sin precedentes, como mediciones de temperatura a escala nanométrica, [35] [36] mapeo de moléculas marcadas isotópicamente, [37] mapeo de modos de fonón en el espacio de posición y momento, [38] [39] mapeo de modos vibracionales superficiales y en masa en nanocubos, [40] e investigaciones de modos de polaritón en cristales de van der Waals. [41] El análisis de modos vibracionales que son inactivos en IR pero que aparecen en dispersión de neutrones inelástica también es posible con alta resolución espacial utilizando EELS. [42] Aunque la resolución espacial de los HREEL es muy alta, las bandas son extremadamente amplias en comparación con otras técnicas. [34]
Microscopía infrarroja computacional
Mediante simulaciones por computadora y análisis de modo normal es posible calcular frecuencias teóricas de moléculas. [43]
Bandas de absorción
La espectroscopia IR se utiliza a menudo para identificar estructuras porque los grupos funcionales dan lugar a bandas características tanto en términos de intensidad como de posición (frecuencia). Las posiciones de estas bandas se resumen en tablas de correlación como se muestra a continuación.
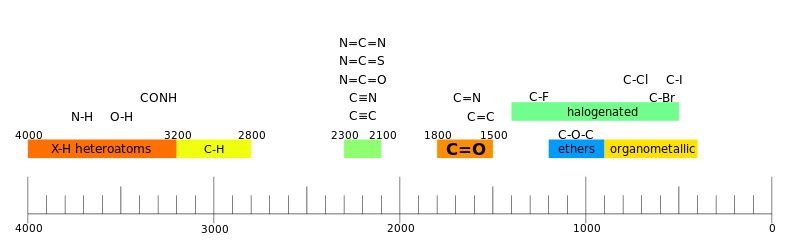
Regiones
A menudo se interpreta que un espectrógrafo tiene dos regiones. [44]
- región del grupo funcional
En la región funcional hay de uno a unos pocos valles por grupo funcional. [44]
- región de huellas dactilares
En la región de las huellas dactilares hay muchos canales que forman un patrón intrincado que puede usarse como una huella dactilar para determinar el compuesto. [44]
Regla del tejón
Para muchos tipos de muestras, se conocen las asignaciones, es decir, qué deformación(es) de enlace están asociadas con qué frecuencia. En tales casos, se puede obtener más información sobre la fuerza de un enlace, basándose en la directriz empírica llamada regla de Badger . Publicada originalmente por Richard McLean Badger en 1934, [45] esta regla establece que la fuerza de un enlace (en términos de constante de fuerza) se correlaciona con la longitud del enlace. Es decir, el aumento de la fuerza del enlace conduce al acortamiento correspondiente del enlace y viceversa.
Efectos isotópicos
Los diferentes isótopos de una especie particular pueden mostrar distintos detalles finos en la espectroscopia infrarroja. Por ejemplo, se determinó experimentalmente que la frecuencia de estiramiento O–O (en centímetros recíprocos) de la oxihemocianina es de 832 y 788 cm −1 para ν( 16 O– 16 O) y ν( 18 O– 18 O), respectivamente.
Considerando el enlace O–O como un resorte, la frecuencia de absorbancia se puede calcular como un número de onda [= frecuencia/(velocidad de la luz)]
donde k es la constante elástica del enlace, c es la velocidad de la luz y μ es la masa reducida del sistema A–B:
( es la masa del átomo ).
Las masas reducidas de 16 O– 16 O y 18 O– 18 O pueden aproximarse como 8 y 9 respectivamente. Por lo tanto
Se ha descubierto que el efecto de los isótopos, tanto en la vibración como en la dinámica de desintegración, es más fuerte de lo que se creía anteriormente. En algunos sistemas, como el silicio y el germanio, la desintegración del modo de estiramiento antisimétrico del oxígeno intersticial implica el modo de estiramiento simétrico con una fuerte dependencia isotópica. Por ejemplo, se ha demostrado que para una muestra de silicio natural, la vida útil de la vibración antisimétrica es de 11,4 ps. Cuando el isótopo de uno de los átomos de silicio aumenta a 29 Si, la vida útil aumenta a 19 ps. De manera similar, cuando el átomo de silicio cambia a 30 Si, la vida útil se convierte en 27 ps. [46]
IR bidimensional
El análisis de espectroscopia de correlación infrarroja bidimensional combina múltiples muestras de espectros infrarrojos para revelar propiedades más complejas. Al ampliar la información espectral de una muestra perturbada, se simplifica el análisis espectral y se mejora la resolución. Los espectros sincrónicos 2D y asincrónicos 2D representan una descripción gráfica de los cambios espectrales debidos a una perturbación (como un cambio de concentración o de temperatura), así como la relación entre los cambios espectrales en dos números de onda diferentes. [ cita requerida ]

La espectroscopia infrarroja bidimensional no lineal [47] [48] es la versión infrarroja de la espectroscopia de correlación . La espectroscopia infrarroja bidimensional no lineal es una técnica que se ha vuelto disponible con el desarrollo de pulsos láser infrarrojos de femtosegundos . En este experimento, primero se aplica un conjunto de pulsos de bombeo a la muestra. A esto le sigue un tiempo de espera durante el cual se permite que el sistema se relaje. El tiempo de espera típico dura de cero a varios picosegundos, y la duración se puede controlar con una resolución de decenas de femtosegundos. Luego se aplica un pulso de sonda, lo que da como resultado la emisión de una señal de la muestra. El espectro infrarrojo bidimensional no lineal es un gráfico de correlación bidimensional de la frecuencia ω 1 que fue excitada por los pulsos de bombeo iniciales y la frecuencia ω 3 excitada por el pulso de sonda después del tiempo de espera. Esto permite la observación del acoplamiento entre diferentes modos vibracionales; debido a su resolución temporal extremadamente fina, se puede utilizar para monitorear la dinámica molecular en una escala de tiempo de picosegundos. Es una técnica todavía en gran parte inexplorada y cada vez es más popular para la investigación fundamental.
Al igual que con la espectroscopia de resonancia magnética nuclear bidimensional ( 2DNMR ), esta técnica extiende el espectro en dos dimensiones y permite la observación de picos cruzados que contienen información sobre el acoplamiento entre diferentes modos. A diferencia de la 2DNMR, la espectroscopia infrarroja bidimensional no lineal también implica la excitación de armónicos. Estas excitaciones dan como resultado picos de absorción de estado excitado ubicados debajo de los picos diagonales y cruzados. En 2DNMR, se utilizan con frecuencia dos técnicas distintas, COSY y NOESY . Los picos cruzados en la primera están relacionados con el acoplamiento escalar, mientras que en la segunda están relacionados con la transferencia de espín entre diferentes núcleos. En la espectroscopia infrarroja bidimensional no lineal, se han establecido análogos a estas técnicas de 2DNMR. La espectroscopia infrarroja bidimensional no lineal con tiempo de espera cero corresponde a COSY, y la espectroscopia infrarroja bidimensional no lineal con tiempo de espera finito que permite la transferencia de población vibracional corresponde a NOESY. La variante COSY de la espectroscopia infrarroja bidimensional no lineal se ha utilizado para determinar el contenido de estructura secundaria de las proteínas. [49]
Véase también
- Espectroscopia aplicada
- Astroquímica
- Astrofísica atómica y molecular
- Espectroscopia infrarroja basada en microscopía de fuerza atómica (AFM-IR)
- Cosmoquímica
- Astronomía de infrarrojo lejano
- Química forense
- Ingeniería forense
- Ingeniería forense de polímeros
- Astronomía infrarroja
- Microscopía infrarroja
- Disociación multifotónica infrarroja
- Espectroscopia de fotodisociación infrarroja
- Tabla de correlación de espectroscopia infrarroja
- Espectroscopia infrarroja de carbonilos metálicos
- Espectroscopia de infrarrojo cercano
- Espectroscopia vibracional por resonancia nuclear
- Microespectroscopia fototérmica
- Espectroscopia Raman
- Espectroscopia rotacional-vibratoria
- Espectroscopia resuelta en el tiempo
- Espectroscopia vibracional de moléculas lineales
Referencias
- ^ Zeitler JA, Taday PF, Newnham DA, Pepper M, Gordon KC, Rades T (febrero de 2007). "Espectroscopia y obtención de imágenes con pulsos de terahercios en el ámbito farmacéutico: una revisión". The Journal of Pharmacy and Pharmacology . 59 (2): 209–23. doi :10.1211/jpp.59.2.0008. PMID 17270075. S2CID 34705104.
- ^ Boosa, Venu; Varimalla, Shirisha; Dumpalapally, Mahesh; Guta, Naresh; Velisoju, Vijay Kumar; Nama, Narender; Akula, Venugopal (5 de septiembre de 2021). "Influencia de los sitios ácidos de Brønsted en la síntesis quimioselectiva de pirrolidonas sobre catalizador de cobre soportado H-ZSM-5". Catálisis Aplicada B: Ambiental . 292 : 120177. Código Bib : 2021AppCB.29220177B. doi : 10.1016/j.apcatb.2021.120177. ISSN 0926-3373.
- ^ Fajdek-Bieda, Anna; Wróblewska, Agnieszka; Miądlicki, Piotr; Tołpa, Jadwiga; Michalkiewicz, Beata (1 de agosto de 2021). "Clinoptilolita como catalizador de zeolita activo natural para las transformaciones químicas del geraniol". Cinética, Mecanismos y Catálisis de Reacción . 133 (2): 997–1011. doi : 10.1007/s11144-021-02027-3 . ISSN 1878-5204. S2CID 236149569.
- ^ Azancot, Lola; Bobadilla, Luis F.; Centeno, Miguel A.; Odriozola, José A. (15 de mayo de 2021). "Información espectroscópica IR sobre el efecto de resistencia a la coquización del potasio en un catalizador basado en níquel durante el reformado en seco de metano". Catálisis Aplicada B: Medioambiental . 285 : 119822. Bibcode :2021AppCB.28519822A. doi :10.1016/j.apcatb.2020.119822. hdl : 10261/251396 . ISSN 0926-3373. S2CID 232627637.
- ^ Nuguid, Rob Jeremiah G.; Elsener, Martin; Ferri, Davide; Kröcher, Oliver (5 de diciembre de 2021). "Operando detección infrarroja por reflectancia difusa de especies intermedias de cianuro durante la reacción de formaldehído con amoníaco sobre V2O5/WO3-TiO2". Catálisis Aplicada B: Medio Ambiente . 298 : 120629. doi : 10.1016/j.apcatb.2021.120629 . ISSN 0926-3373.
- ^ "Espectroscopia infrarroja". ColourLex . 12 de marzo de 2021 . Consultado el 19 de enero de 2022 .
- ^ Derrick MR, Stulik D, Landry JM (1999). Espectroscopia infrarroja en la ciencia de la conservación (PDF) . Herramientas científicas para la conservación. Getty Publications. ISBN 0-89236-469-6.
- ^ Ricciardi P. "Descubriendo los secretos de los manuscritos iluminados" . Consultado el 11 de diciembre de 2015 .
- ^ Lau WS (1999). Caracterización infrarroja para microelectrónica. World Scientific. ISBN 978-981-02-2352-6.
- ^ Osborne BG (2006). "Espectroscopia de infrarrojo cercano en el análisis de alimentos". Enciclopedia de química analítica . John Wiley & Sons. doi :10.1002/9780470027318.a1018. ISBN . 9780470027318.
- ^ Villar A, Gorritxategi E, Aranzabe E, Fernández S, Otaduy D, Fernández LA (diciembre de 2012). "Sensor de infrarrojo cercano visible de bajo coste para la monitorización en línea del contenido de grasa y ácidos grasos durante el proceso de fabricación de la leche". Química alimentaria . 135 (4): 2756–60. doi :10.1016/j.foodchem.2012.07.074. PMID 22980869.
- ^ www.TRMThemes.com, tema TRM de. «Archivos basados en infrarrojos (IR)/ópticos - Heath Consultants». Heath Consultants . Archivado desde el original el 2022-01-20 . Consultado el 2016-04-12 .
- ^ "Base de datos espectroscópica de infrarrojos PAH de la NASA Ames". Laboratorio de Astrofísica y Astroquímica . 12 de septiembre de 2019 . Consultado el 19 de enero de 2022 .
- ^ Hoover R (21 de febrero de 2014). "¿Necesitas rastrear nanopartículas orgánicas en todo el universo? La NASA tiene una aplicación para eso". NASA . Archivado desde el original el 6 de septiembre de 2015 . Consultado el 22 de febrero de 2014 .
- ^ Becker, Wolfgang; Sachsenheimer, Kerstin; Klemenz, Melanie (2017). "Detección de plásticos negros en el espectro infrarrojo medio (MIR) utilizando la técnica de conversión ascendente de fotones para el proceso de reciclado de polímeros". Polímeros . 9 (9). MDPI. doi : 10.3390/polym9090435 . PMC 6418689 . PMID 30965736.
- ^ Perry, Tekla S. (14 de marzo de 2017). "Qué sucedió cuando llevamos el analizador de alimentos SCiO a la tienda de comestibles". IEEE Spectrum: noticias sobre tecnología, ingeniería y ciencia . Consultado el 23 de marzo de 2017 .
- ^ Coates, John (18 de junio de 2014). "Una revisión de nuevas tecnologías a pequeña escala para mediciones en el infrarrojo cercano". American Pharmaceutical Review . Coates Consulting LLC . Consultado el 23 de marzo de 2017 .
- ^ Sockalingum, GD; Bouhedja, W.; Pina, P.; Allouch, P.; Bloy, C.; Manfait, M. (febrero de 1998). "La espectroscopia FT-IR como método emergente para la caracterización rápida de microorganismos". Biología celular y molecular (Noisy-Le-Grand, Francia) . 44 (1): 261–269. ISSN 0145-5680. PMID 9551657.
- ^ Helm, D.; Labischinski, H.; Schallehn, Gisela; Naumann, D. (1991-01-01). "Clasificación e identificación de bacterias mediante espectroscopia infrarroja por transformada de Fourier". Microbiología . 137 (1): 69–79. doi : 10.1099/00221287-137-1-69 . ISSN 1350-0872. PMID 1710644.
- ^ Holt, C; Hirst, D; Sutherland, A; MacDonald, F (enero de 1995). "Discriminación de especies en el género Listeria mediante espectroscopia infrarroja por transformada de Fourier y análisis de variables canónicas". Microbiología aplicada y ambiental . 61 (1): 377–378. Bibcode :1995ApEnM..61..377H. doi :10.1128/aem.61.1.377-378.1995. ISSN 0099-2240. PMC 167294 . PMID 7887620.
- ^ Campos, Juana; Sousa, Clara; Mourão, Joana; Lopes, João; Antunes, Patricia; Peixe, Luísa (noviembre 2018). "Discriminación de serogrupos y serotipos de Salmonella no tifoidea mediante espectroscopia infrarroja por transformada de Fourier: un análisis completo". Revista Internacional de Microbiología de Alimentos . 285 : 34–41. doi :10.1016/j.ijfoodmicro.2018.07.005. PMID 30015261.
- ^ Sharaha, Uraib; Rodriguez-Diaz, Eladio; Sagi, Orli; Riesenberg, Klaris; Salman, Ahmad; Bigio, Irving J.; Huleihel, Mahmoud (julio de 2019). "Determinación rápida y confiable de la susceptibilidad de Escherichia coli a los antibióticos: microscopía infrarroja en conjunto con algoritmos de aprendizaje automático". Journal of Biophotonics . 12 (7): e201800478. doi :10.1002/jbio.201800478. ISSN 1864-063X. PMID 30916881.
- ^ Wijesinghe, Hewa GS; Hare, Dominic J.; Mohamed, Ahmed; Shah, Alok K.; Harris, Patrick NA; Hill, Michelle M. (2021). "Detección de resistencia a los antimicrobianos en Escherichia coli mediante espectroscopia infrarroja de transformada de Fourier de reflectancia total atenuada de sobremesa y aprendizaje automático". The Analyst . 146 (20): 6211–6219. Bibcode :2021Ana...146.6211W. doi :10.1039/D1AN00546D. ISSN 0003-2654. PMID 34522918.
- ^ Suleiman, Manal; Abu-Aqil, George; Sharaha, Uraib; Riesenberg, Klaris; Lapidot, Itshak; Salman, Ahmad; Huleihel, Mahmoud (junio de 2022). "La espectroscopia infrarroja combinada con algoritmos de aprendizaje automático permite la determinación temprana de la susceptibilidad de Pseudomonas aeruginosa a los antibióticos". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy . 274 : 121080. Bibcode :2022AcSpA.27421080S. doi :10.1016/j.saa.2022.121080. PMID 35248858.
- ^ "IR Biotyper® para microbiología de alimentos". www.bruker.com . Consultado el 20 de marzo de 2024 .
- ^ Banwell, Colin N. (1966). Fundamentos de espectroscopia molecular . Serie de química europea. Londres: McGraw-Hill. ISBN 978-0-07-094020-8.
- ^ Atkins P, de Paula J (2002). Química física (7.ª ed.). Nueva York: WHFreeman. pág. 513. ISBN 0-7167-3539-3.|quote=El momento dipolar eléctrico de la molécula debe cambiar cuando los átomos se desplazan entre sí.
- ^ Schrader B (1995). Espectroscopia infrarroja y Raman: métodos y aplicaciones . Nueva York: VCH, Weinheim. p. 787. ISBN 978-3-527-26446-9.
- ^ ab Harwood LM, Moody CJ (1989). Química orgánica experimental: principios y práctica (edición ilustrada). Wiley-Blackwell. pág. 292. ISBN 978-0-632-02017-1.
- ^ Shadman S, Rose C, Yalin AP (2016). "Sensor de espectroscopia de cavidad de trayectoria abierta con anillo descendente para amoníaco atmosférico". Applied Physics B . 122 (7): 194. Bibcode :2016ApPhB.122..194S. doi :10.1007/s00340-016-6461-5. S2CID 123834102.
- ^ ab Cromatografía/espectroscopia infrarroja por transformada de Fourier y sus aplicaciones, por Robert White, pág. 7
- ^ Pollock, Hubert M; Kazarian, SG (2014). "Microespectroscopia en el infrarrojo medio". En Meyers, Robert A. (ed.). Enciclopedia de química analítica . John Wiley & Sons Ltd. págs. 1–26. doi :10.1002/9780470027318.a5609.pub2. ISBN 9780470027318.
- ^ HM Pollock y DA Smith, El uso de sondas de campo cercano para espectroscopia vibracional e imágenes fototérmicas, en Handbook of vibrational spectroscopy, JM Chalmers y PR Griffiths (eds), John Wiley & Sons Ltd, Vol. 2, págs. 1472 - 1492 (2002)
- ^ ab Krivanek OL, Lovejoy TC, Dellby N, Aoki T, Carpenter RW, Rez P, et al. (octubre de 2014). "Espectroscopia vibracional en el microscopio electrónico". Nature . 514 (7521): 209–12. Bibcode :2014Natur.514..209K. doi :10.1038/nature13870. PMID 25297434. S2CID 4467249.
- ^ Idrobo JC, Lupini AR, Feng T, Unocic RR, Walden FS, Gardiner DS, et al. (marzo de 2018). "Medición de temperatura mediante una sonda electrónica a escala nanométrica utilizando espectroscopia de ganancia y pérdida de energía". Physical Review Letters . 120 (9): 095901. Bibcode :2018PhRvL.120i5901I. doi : 10.1103/PhysRevLett.120.095901 . PMID 29547334.
- ^ Lagos MJ, Batson PE (julio de 2018). "Termometría con resolución subnanométrica en el microscopio electrónico utilizando el principio de equilibrio detallado". Nano Letters . 18 (7): 4556–4563. Bibcode :2018NanoL..18.4556L. doi :10.1021/acs.nanolett.8b01791. PMID 29874456. S2CID 206748146.
- ^ Hachtel JA, Huang J, Popovs I, Jansone-Popova S, Keum JK, Jakowski J, et al. (febrero de 2019). "Identificación de etiquetas isotópicas específicas del sitio mediante espectroscopia vibracional en el microscopio electrónico". Science . 363 (6426): 525–528. Bibcode :2019Sci...363..525H. doi : 10.1126/science.aav5845 . PMID 30705191.
- ^ Hage FS, Nicholls RJ, Yates JR, McCulloch DG, Lovejoy TC, Dellby N, et al. (junio de 2018). "Espectroscopia vibracional resuelta por momento a nanoescala". Science Advances . 4 (6): eaar7495. Bibcode :2018SciA....4.7495H. doi :10.1126/sciadv.aar7495. PMC 6018998 . PMID 29951584.
- ^ Senga R, Suenaga K, Barone P, Morishita S, Mauri F, Pichler T (septiembre de 2019). "Mapeo de posición y momento de vibraciones en nanoestructuras de grafeno". Naturaleza . 573 (7773): 247–250. arXiv : 1812.08294 . Código Bib :2019Natur.573..247S. doi :10.1038/s41586-019-1477-8. PMID 31406319. S2CID 118999071.
- ^ Lagos MJ, Trügler A, Hohenester U, Batson PE (marzo de 2017). "Mapeo de los modos vibracionales superficiales y volumétricos en un único nanocubo". Nature . 543 (7646): 529–532. Bibcode :2017Natur.543..529L. doi :10.1038/nature21699. PMID 28332537. S2CID 4459728.
- ^ Govyadinov AA, Konečná A, Chuvilin A, Vélez S, Dolado I, Nikitin AY, et al. (julio de 2017). "Sondeo de polaritones hiperbólicos de baja energía en cristales de van der Waals con un microscopio electrónico". Comunicaciones de la naturaleza . 8 (1): 95. arXiv : 1611.05371 . Código Bib : 2017NatCo...8...95G. doi :10.1038/s41467-017-00056-y. PMC 5522439 . PMID 28733660.
- ^ Venkatraman K, Levin BD, March K, Rez P, Crozier PA (2019). "Espectroscopia vibracional a resolución atómica con dispersión de impacto de electrones". Nature Physics . 15 (12): 1237–1241. arXiv : 1812.08895 . Código Bibliográfico :2019NatPh..15.1237V. doi :10.1038/s41567-019-0675-5. S2CID 119452520.
- ^ Henschel H, Andersson AT, Jespers W, Mehdi Ghahremanpour M, van der Spoel D (mayo de 2020). "Espectros infrarrojos teóricos: medidas de similitud cuantitativa y campos de fuerza". Revista de teoría y computación química . 16 (5): 3307–3315. doi :10.1021/acs.jctc.0c00126. PMC 7304875 . PMID 32271575.
- ^ abc Smith JG (2011). "Capítulo 13 Espectrometría de masas y espectroscopia infrarroja". En Hodge T, Nemmers D, Klein J (eds.). Química orgánica (3.ª ed.). Nueva York, NY: McGraw-Hill. págs. 463–488. ISBN 978-0-07-337562-5Archivado desde el original (libro) el 28 de junio de 2018. Consultado el 30 de junio de 2018 .
- ^ Badger R (1934). "Una relación entre las distancias internucleares y las constantes de fuerza de enlace" (PDF) . The Journal of Chemical Physics . 2 (3): 128. Bibcode :1934JChPh...2..128B. doi :10.1063/1.1749433.
- ^ Kohli KK, Davies G, Vinh NQ, West D, Estreicher SK, Gregorkiewicz T, et al. (junio de 2006). "Dependencia isotópica de la duración de la vibración del oxígeno en silicio". Physical Review Letters . 96 (22): 225503. Bibcode :2006PhRvL..96v5503K. doi :10.1103/PhysRevLett.96.225503. PMID 16803320.
- ^ Hamm P, Lim MH, Hochstrasser RM (1998). "Estructura de la banda amida I de péptidos medida mediante espectroscopia infrarroja no lineal de femtosegundos". J. Phys. Chem. B . 102 (31): 6123–6138. doi :10.1021/jp9813286.
- ^ Mukamel S (2000). "Espectroscopias de correlación de femtosegundos multidimensionales de excitaciones electrónicas y vibracionales". Revisión anual de química física . 51 (1): 691–729. Bibcode :2000ARPC...51..691M. doi :10.1146/annurev.physchem.51.1.691. PMID 11031297. S2CID 31230696.
- ^ Demirdöven N, Cheatum CM, Chung HS, Khalil M, Knoester J, Tokmakoff A (junio de 2004). "Espectroscopia infrarroja bidimensional de la estructura secundaria de láminas beta antiparalelas" (PDF) . Journal of the American Chemical Society . 126 (25): 7981–90. doi :10.1021/ja049811j. PMID 15212548.
Enlaces externos
- Espectroscopia infrarroja para químicos orgánicos
- Base de datos del espectro de compuestos orgánicos Archivado el 14 de enero de 2013 en Wayback Machine











