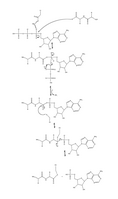
- La figura 1 muestra la secuencia de unión de la enzima activadora de la ubiquitina al ATP y al sustrato de ubiquitina. También muestra cómo dos sustratos de ubiquitina pueden unirse al mismo tiempo. [6]
- Figura 2. La proteína E1 se une a una molécula de ubiquitina en cada uno de dos sitios activos idénticos (resaltados). Los residuos importantes, cisteína y arginina, están marcados en rojo. [2]
- Figura 3. Vista en primer plano del sitio activo no unido. Se cree que Arg (603) recarga la Cys catalítica (600) una vez que la ubiquitina se ha transferido a la enzima E2. [2]
- Figura 4. Mecanismo completo de adenilación de la ubiquitina y posterior unión de la ubiquitina a E1.
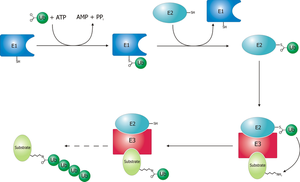
- Diagrama esquemático del sistema de ubiquitinación.
Enzima activadora de ubiquitina
| Enzimas activadoras de ubiquitina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina del complejo ubiquitina/enzima activadora de ubiquitina E1 de levadura. [1] | |||||||||
| Identificadores | |||||||||
| N.º CE | 6.2.1.45 | ||||||||
| N.º CAS | 74812-49-0 | ||||||||
| Nombres alternativos | Enzimas E1 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
Las enzimas activadoras de ubiquitina , también conocidas como enzimas E1 , catalizan el primer paso en la reacción de ubiquitinación , que (entre otras cosas) puede dirigir una proteína para su degradación a través de un proteasoma . Este enlace covalente de la ubiquitina o proteínas similares a la ubiquitina a proteínas diana es un mecanismo importante para regular la función de las proteínas en organismos eucariotas . [2] Muchos procesos como la división celular , las respuestas inmunes y el desarrollo embrionario también están regulados por la modificación postraduccional por la ubiquitina y las proteínas similares a la ubiquitina. [2]
Ubiquitinación (ubiquitilación)
La enzima activadora de ubiquitina (E1) inicia el proceso de ubiquitinación (Figura 1). La enzima E1, junto con el ATP , se une a la proteína ubiquitina. Luego, la enzima E1 pasa la proteína ubiquitina a una segunda proteína, llamada proteína transportadora o de conjugación de ubiquitina (E2). La proteína E2 forma un complejo con una proteína ligasa de ubiquitina (E3). Esta proteína ligasa de ubiquitina reconoce qué proteína necesita ser marcada y cataliza la transferencia de ubiquitina a esa proteína. Esta vía se repite hasta que la proteína objetivo tiene una cadena completa de ubiquitina unida a sí misma. [3]
Estructura y mecanismo
Al comienzo de la cascada de ubiquitinación, la enzima E1 (Figura 2) se une al ATP-Mg2 + y a la ubiquitina y cataliza la adenilación del acilo C-terminal de la ubiquitina. [4] En el siguiente paso, una cisteína catalítica (Figura 3) en la enzima E1 ataca al complejo ubiquitina-AMP a través de la sustitución de acilo, creando simultáneamente un enlace tioéster y un grupo saliente AMP. [2] Finalmente, el complejo E1-ubiquitina transfiere ubiquitina a una enzima E2 a través de una reacción de transtioesterificación, en la que una cisteína catalítica E2 ataca la parte posterior del complejo E1-ubiquitina. [5] Sin embargo, el proceso de transtioesterificación es muy complicado, ya que tanto las enzimas E1 como E2 forman un complejo intermedio en el que ambas enzimas experimentan una serie de cambios conformacionales para unirse entre sí. [5]
A lo largo de este mecanismo, la enzima E1 se une a dos moléculas de ubiquitina. Aunque esta ubiquitina secundaria está adenilada de manera similar, no forma el mismo complejo de tioéster descrito anteriormente. La función de la ubiquitina secundaria sigue siendo en gran medida desconocida, sin embargo, se cree que puede facilitar los cambios conformacionales observados en la enzima E1 durante el proceso de transtioesterificación. [2]
Isoenzimas
Los siguientes genes codifican enzimas activadoras de la ubiquitina:
Asociación de enfermedades
El sistema ubiquitina-proteasoma es fundamental para la degradación adecuada de proteínas dentro de las células. Las disfunciones de este sistema pueden alterar la homeostasis celular y dar lugar a una serie de trastornos. En células que funcionan normalmente, el enlace covalente de la ubiquitina o proteína similar a la ubiquitina a una proteína diana cambia la superficie de la proteína diana. Estas proteínas ubiquitinadas están sujetas a degradación por vías proteolíticas y no proteolíticas. [7] Si este sistema funciona mal, pueden producirse numerosas enfermedades hereditarias y adquiridas, como cáncer, diabetes , accidente cerebrovascular , enfermedad de Alzheimer , esclerosis lateral amiotrófica , esclerosis múltiple , asma , enfermedad inflamatoria intestinal , tiroiditis autoinmune , artritis inflamatoria , lupus y síndrome de VEXAS . [7]
Sin sentido enUBE1y atrofia muscular espinal infantil ligada al cromosoma X (XL-SMA)
Entre los diversos trastornos asociados con la vía ubiquitina-proteasoma se encuentra la atrofia muscular espinal infantil ligada al cromosoma X (XL-SMA). [8] Este trastorno fatal de la niñez está asociado con la pérdida de células del asta anterior y la muerte infantil. Las características clínicas incluyen hipotonía, arreflexia y contracturas congénitas múltiples. En un análisis de mutaciones a gran escala, la detección de seis familias XL-SMA proporcionó resultados que indicaban dos nuevas mutaciones sin sentido en dos familias y una nueva sustitución sinónima C→T en otras tres familias. Todas estas mutaciones detectadas se ubicaron en el exón 15 del gen UBE1 (el gen que codifica la enzima activadora de la ubiquitina) y se observó que se segregaban con la enfermedad en las familias. En breve, la mutación sin sentido de UBE1 puede conducir a una construcción compleja alterada con gigaxonina , una proteína involucrada en la estructura axonal y el mantenimiento neuronal. Esto puede conducir a una degradación deteriorada de la proteína 1B asociada a microtúbulos (MAP1B), lo que resulta en la acumulación de proteína MAP1B, que puede aumentar la muerte celular neuronal. [8] Por lo tanto, se sospecha que las mutaciones en UBE1 son la causa de defectos genéticos en individuos con AME-XL.
Referencias
- ^ PDB : 3CMM ; Lee I, Schindelin H (julio de 2008). "Información estructural sobre la activación de la ubiquitina catalizada por E1 y su transferencia a enzimas conjugadoras". Cell . 134 (2): 268–78. doi : 10.1016/j.cell.2008.05.046 . PMID 18662542.
- ^ abcdef Schulman BA, Harper JW (mayo de 2009). "Activación de proteínas similares a la ubiquitina por enzimas E1: el punto culminante de las vías de señalización descendentes". Nature Reviews Molecular Cell Biology . 10 (5): 319–31. doi :10.1038/nrm2673. PMC 2712597 . PMID 19352404.
- ^ Lecker SH, Goldberg AL, Mitch WE (julio de 2006). "Degradación de proteínas por la vía ubiquitina-proteasoma en estados normales y patológicos" (PDF) . Journal of the American Society of Nephrology . 17 (7): 1807–19. doi : 10.1681/ASN.2006010083 . PMID 16738015.
- ^ Tokgöz Z, Bohnsack RN, Haas AL (mayo de 2006). "Efectos pleiotrópicos de la unión de ATP.Mg2+ en el ciclo catalítico de la enzima activadora de la ubiquitina". The Journal of Biological Chemistry . 281 (21): 14729–37. doi : 10.1074/jbc.M513562200 . PMID 16595681.
- ^ ab Lee I, Schindelin H (julio de 2008). "Información estructural sobre la activación de la ubiquitina catalizada por E1 y su transferencia a enzimas conjugadoras". Cell . 134 (2): 268–78. doi : 10.1016/j.cell.2008.05.046 . PMID 18662542.
- ^ Esta figura es una adaptación del Esquema 1 de "El mecanismo de la enzima activadora de la ubiquitina: un análisis cinético y de equilibrio" de Arthur Haas. Haas AL, Rose IA (septiembre de 1982). "El mecanismo de la enzima activadora de la ubiquitina. Un análisis cinético y de equilibrio". The Journal of Biological Chemistry . 257 (17): 10329–37. PMID 6286650.
- ^ ab Wang J, Maldonado MA (agosto de 2006). "El sistema ubiquitina-proteasoma y su papel en enfermedades inflamatorias y autoinmunes" (PDF) . Inmunología celular y molecular . 3 (4): 255–61. PMID 16978533.
- ^ ab Ramser J, Ahearn ME, Lenski C, et al. (enero de 2008). "Las variantes sin sentido y sinónimas raras en UBE1 están asociadas con la atrofia muscular espinal infantil ligada al cromosoma X". American Journal of Human Genetics . 82 (1): 188–93. doi :10.1016/j.ajhg.2007.09.009. PMC 2253959 . PMID 18179898.
Enlaces externos
- Enzimas activadoras de ubiquitina en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
![La figura 1 muestra la secuencia de unión de la enzima activadora de la ubiquitina al ATP y al sustrato de ubiquitina. También muestra cómo dos sustratos de ubiquitina pueden unirse al mismo tiempo.[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/01/Ubiquitin-activating_enzyme_bound_to_ATP_and_ubiquitin_substrate.png/300px-Ubiquitin-activating_enzyme_bound_to_ATP_and_ubiquitin_substrate.png)
![Figura 2. La proteína E1 se une a una molécula de ubiquitina en cada uno de dos sitios activos idénticos (resaltados). Los residuos importantes, cisteína y arginina, están marcados en rojo.[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/91/Ubiquitin_activating_enzyme_cysteine_highlighted.png/300px-Ubiquitin_activating_enzyme_cysteine_highlighted.png)
![Figura 3. Vista en primer plano del sitio activo no unido. Se cree que Arg (603) recarga la Cys catalítica (600) una vez que la ubiquitina se ha transferido a la enzima E2.[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Cys_and_Arg_active_site_of_ubiquitin_activating_enzyme.png/300px-Cys_and_Arg_active_site_of_ubiquitin_activating_enzyme.png)