Geometría molecular en forma de T
| Geometría molecular en forma de T | |
|---|---|
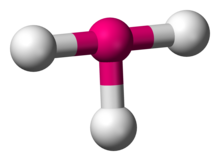 | |
| Ejemplos | ClF3 |
| Grupo de puntos | C2v |
| Número de coordinación | 3 |
| Ángulo(s) de enlace | 90°, 180° |
| μ (Polaridad) | >0 |

En química, la geometría molecular en forma de T describe las estructuras de algunas moléculas en las que un átomo central tiene tres ligandos . Por lo general, los compuestos tricoordinados adoptan geometrías trigonales planas o piramidales . Ejemplos de moléculas en forma de T son los trifluoruros de halógeno, como el ClF 3 . [1]
Según la teoría VSEPR , la geometría en forma de T resulta cuando tres ligandos y dos pares solitarios de electrones están unidos al átomo central, escrito en notación AXE como AX 3 E 2 . La geometría en forma de T está relacionada con la geometría molecular bipiramidal trigonal para moléculas AX 5 con tres ligandos ecuatoriales y dos axiales. En una molécula AX 3 E 2 , los dos pares solitarios ocupan dos posiciones ecuatoriales, y los tres átomos de ligando ocupan las dos posiciones axiales, así como una posición ecuatorial. Los tres átomos se unen en ángulos de 90° en un lado del átomo central, produciendo la forma de T. [2]
El anión trifluoroxenato(II), XeF−
3, se ha investigado como un posible primer ejemplo de una molécula AX 3 E 3 , que podría esperarse por razonamiento VSEPR que tenga seis pares de electrones en una disposición octaédrica con los tres pares solitarios y los tres ligandos en una orientación en forma de mero o T. [3] Aunque este anión se ha detectado en la fase gaseosa, los intentos de síntesis en solución y determinación experimental de la estructura no tuvieron éxito. Un estudio de química computacional mostró una geometría en forma de Y plana distorsionada con el ángulo de enlace F–Xe–F más pequeño igual a 69°, en lugar de 90° como en una geometría en forma de T. [3]
Véase también
Referencias
- ^ Greenwood, NN; Earnshaw, A. (1997). Química de los elementos (2.ª ed.). Oxford: Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ Housecroft, CE; Sharpe, AG (2004). Química inorgánica (2.ª ed.). Prentice Hall. pág. 47. ISBN 978-0-13-039913-7.
- ^ ab Vasdev, Neil ; Morán, Mateo D.; Tuononen, Heikki M.; Chirakal, Raman; Suontamo, Reijo J.; Bain, Alex D.; Schrobilgen, Gary J. (2010). "Evidencia espectroscópica de RMN de la intermediación de XeF-3 en el intercambio XeF2 / F-, intentos de síntesis y termoquímica de sales de XeF-3 y estudios teóricos del anión XeF-3". Inorg. Química. 49 (19): 8997–9004. doi :10.1021/ic101275m. PMID 20799721. S2CID 25413351.
Enlaces externos
- Química, estructuras y moléculas en 3D [ enlace muerto permanente ]
- Centro de Estructura Molecular de la Universidad de Indiana
- Ejemplos moleculares interactivos para grupos puntuales
- Modelado molecular
- Visualización plana trigonal animada
