Electroquímica bipolar

La electroquímica bipolar es un fenómeno de la electroquímica basado en la polarización de objetos conductores en campos eléctricos . De hecho, esta polarización genera una diferencia de potencial entre los dos extremos del sustrato que es igual al valor del campo eléctrico multiplicado por el tamaño del objeto. Si esta diferencia de potencial es lo suficientemente importante, entonces se pueden generar reacciones redox en los extremos del objeto, se producirán oxidaciones en un extremo acopladas simultáneamente a reducciones en el otro extremo. [1] [2] En una configuración experimental simple que consiste en un alambre de platino en una navecilla de pesaje que contiene una solución indicadora de pH , un voltaje de 30 V a través de dos electrodos provocará una reducción de agua en un extremo del alambre (el cátodo) y un aumento de pH (formación de OH − ) y oxidación de agua en el extremo anódico y una disminución de pH. Los polos del electrodo bipolar también se alinean con el campo eléctrico aplicado. [3]
Fundamentos
Cuando un electrodo conductor de electricidad se coloca sin conexión directa, en el mismo electrolito, entre un ánodo y un cátodo en una celda electroquímica con suficiente voltaje aplicado; el electrodo experimentará una reacción catódica y anódica simultánea en ambos extremos. Esto significa que el electrodo conductor se convertirá en un electrodo bipolar (BPE); un material conductor de electricidad en contacto con un electrolito iónicamente conductor sin conexión electrónica directa con la fuente de alimentación, que promueve reacciones electroquímicas (reducción y oxidación) en sus dos extremos (polos); lo que significa que es un cátodo y un ánodo al mismo tiempo. [4] [5] Esto ocurre debido a:
Caso (A)
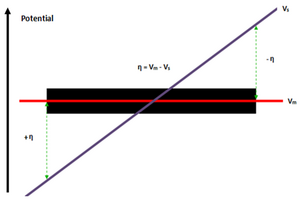
La diferencia de potencial (η) entre el electrodo eléctricamente conductor (V m ) y el electrolito (V s ) provoca un gradiente de potencial que se distribuye posteriormente a través de la interfaz BPE-electrolito, con un extremo que tiene el potencial más alto (ánodo + η) y el otro extremo que tiene el potencial más bajo (cátodo - η). [5] En comparación con el gradiente/caída del potencial del electrolito (V s ); el potencial del electrodo (V m ) no cambia entre los polos BPE, esto se debe a la alta conductividad de los electrodos que es superior a 10 6 S/m para la mayoría de las aleaciones de acero, en comparación con la conductividad de la solución en el rango de 5,5 μS/m para agua ionizada y 5 S/m para agua de mar . [5]
Caso (B)

La corriente fluye en el BPE porque proporciona una ruta de corriente menos resistiva que el electrolito. Como se ilustra en la Figura; como consecuencia de la corriente que ingresa por el lado (D/Azul) desde el ánodo, el lado D se polarizará catódicamente (el potencial se volverá más negativo). Por otro lado, el lado (B/Rojo) por donde sale la corriente, se polarizará anódicamente (el potencial se volverá más positivo) y se corroerá. Esto se debe a la polarización que ocurre en sentido opuesto a la dirección de la corriente. [6]
Esta teoría es casi aceptada en todos los libros clásicos [7] y recientes sobre protección catódica, [8] y en las publicaciones y normas NACE , [9] como explicación de la corrosión y el desprendimiento del revestimiento causados por la interferencia de CC entre tuberías y diferentes estructuras (por ejemplo, estructuras protegidas o no protegidas catódicamente, ferrocarriles y HVDC ). Esto se debe a que es más adecuada para estructuras a gran escala en entornos heterogéneos y altamente resistivos donde el potencial de solución (V s ) juega un papel menos fundamental y las reacciones se concentran principalmente solo en los polos (donde la corriente entra y sale). [7]
Caso (C)
La diferencia de potencial en cada polo del BPE (que puede o no ser suficiente para las reacciones electroquímicas). [4]
Tenga en cuenta que el potencial de la solución no está controlado directamente por una fuente de energía (por ejemplo, un potenciostato ) porque también depende de la composición de la solución. Por lo tanto, para que los electrones se transfieran a especies reducidas en la solución, el potencial del electrodo de trabajo debe establecerse en un valor más negativo que el de una molécula electroactiva en la solución y, luego, dependiendo de la cinética, los electrones pueden transferirse. De manera similar, ocurren reacciones de oxidación. [4] Además, de acuerdo con la ley de Ohm , el campo eléctrico y el potencial de la solución (V s ) aumentarán con el aumento de la resistividad de la solución y la corriente aplicada en el circuito externo. [6]
Utilizaciones
El fenómeno de la electroquímica bipolar se conoce desde la década de 1970 [10] y se utiliza en la industria en algunos reactores electrolíticos. El interés de la comunidad científica por este concepto parece aumentar mucho desde que Martin Fleischmann y sus colaboradores demostraron que la división del agua era posible utilizando electrodos bipolares de tamaño micrométrico. [11] Recientemente, se han desarrollado varias aplicaciones en dominios como la síntesis de micro y nanoestructuras disimétricas [12] [13], la química analítica [14] [15] [16] , la ciencia de los materiales [17] [6] , la microelectrónica [18] y la propulsión de microobjetos [19] [20] .
Referencias
- ^ G. Loget; A. Kuhn (2011). "Dar forma y explorar el micro y nanomundo usando electroquímica bipolar". Química analítica y bioanalítica . 400 (6): 1691–704. doi :10.1007/s00216-011-4862-1. PMID 21455656. S2CID 44000438.
- ^ F. Mavré; RK Anand; DR Laws; K.-F. Chow; B.-Y. Chang; JA Crooks; RM Crooks (2010). "Electrodos bipolares de características: una herramienta útil para la concentración, separación y detección de analitos en sistemas microelectroquímicos". Anal. Chem. 82 (21): 8766–74. doi :10.1021/ac101262v. PMID 20815405.
- ^ Fosdick, SE; Knust, KN; Scida, K.; Crooks, RM (2013). "Electroquímica bipolar". Angew. Chem. Int. Ed . 52 (40): 10438–10456. doi :10.1002/anie.201300947. PMID 23843205.
- ^ abc Mavré, François; Anand, Robbyn K.; Laws, Derek R.; Chow, Kwok-Fan; Chang, Byoung-Yong; Crooks, John A.; Crooks, Richard M. (3 de septiembre de 2010). "Electrodos bipolares: una herramienta útil para la concentración, separación y detección de analitos en sistemas microelectroquímicos". Química analítica . 82 (21): 8766–8774. doi :10.1021/ac101262v. ISSN 0003-2700. PMID 20815405.
- ^ abc Ulrich, cristiano; Andersson, Olof; Nyholm, Leif; Björefors, Fredrik (7 de abril de 2008). "Formación de gradientes moleculares en electrodos bipolares". Angewandte Chemie . 120 (16): 3076–3078. Código bibliográfico : 2008AngCh.120.3076U. doi : 10.1002/ange.200705824. ISSN 0044-8249.
- ^ abcd Abdalrhaman, Mohamed Koko (2017). Aplicación de la electroquímica bipolar para la detección de corrosión de acero inoxidable tipo 420 en solución de cloruro de sodio (tesis de maestría). Laboratorio Nacional de Física. doi :10.13140/RG.2.2.31999.71845.
- ^ ab Bohnes, H.; Richter, B. (1997), "Protección catódica de los buques", Manual de protección contra la corrosión catódica , Elsevier, págs. 391–414, doi :10.1016/b978-088415056-5/50024-1, ISBN 978-0-88415-056-5, consultado el 12 de febrero de 2023
- ^ Ahmad, Zaki (2006), "Prevención de la corrosión mediante el diseño", Principios de ingeniería de corrosión y control de la corrosión , Elsevier, págs. 438–478, doi :10.1016/b978-075065924-6/50009-x, ISBN 978-0-7506-5924-6, consultado el 12 de febrero de 2023
- ^ Winston., Revisión, R. (2011). Manual de corrosión de Uhlig. Wiley. ISBN 978-1-118-11003-4.OCLC 927504000 .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Goodridge, F.; King, CJH; Wright, AR (1 de abril de 1977). "El comportamiento de los electrodos bipolares de lecho empacado". Electrochimica Acta . 22 (4): 347–352. doi :10.1016/0013-4686(77)85085-8. ISSN 0013-4686.
- ^ M. Fleischmann; J. Ghoroghchian; D. Rolison; S. Pons (1986). "Comportamiento electroquímico de dispersiones de ultramicroelectrodos esféricos". J. Phys. Chem. 90 (23): 6392. doi :10.1021/j100281a065. Archivado desde el original el 23 de septiembre de 2017.
- ^ G. Loget; V. Lapeyre; P. Garrigue; C. Warakulwit; J. Limtrakul; M.-H. Delville; A. Kuhn (2011). "Procedimiento versátil para la síntesis de tubos de carbono de tipo Janus". Química. Mater. 23 (10): 2595. doi :10.1021/cm2001573.
- ^ C. Warakulwit; T. Nguyen; J. Majimel; M.-H. Delville; V. Lapeyre; P. Garrigue; V.Ravaine; J. Limtrakul; A. Kuhn (2008). "Nanotubos de carbono disimétricos por electroquímica bipolar". Nano Lett. 8 (2): 500–4. Código Bib : 2008NanoL...8..500W. doi :10.1021/nl072652s. PMID 18189438.
- ^ K.-F. Chow; B.-Y. Chang; BA Zaccheo; F. Mavré; RM Crooks (2010). "Una plataforma de detección basada en la electrodisolución de un electrodo bipolar de Ag". J. Am. Chem. Soc. 132 (27): 9228–9229. doi :10.1021/ja103715u. PMID 20557051.
- ^ Hlushkou D, Perdue RK, Dhopeshwarkar R, Crooks RM, Tallarek U (2009). "Enfoque de gradiente de campo eléctrico en microcanales con electrodo bipolar incorporado". Lab Chip . 9 (13): 1903–1913. doi :10.1039/b822404h. PMID 19532966.
- ^ Ulrich C, Andersson O, Nyholm L, Björefors F (2009). "Distribuciones de densidad de corriente y potencial en electrodos destinados a patrones bipolares". Anal. Química. 81 (1): 453–459. doi :10.1021/ac801871c. PMID 19125451.
- ^ Ramakrishnan S, Shannon C (2010). "Visualización de materiales en estado sólido mediante electroquímica bipolar". Langmuir . 26 (7): 4602–4606. doi :10.1021/la100292u. PMID 20229995.
- ^ JC Bradley; HM Chen; J. Crawford; J. Eckert; K. Ernazarova; T. Kurzeja; M. Lin; M. McGee; W. Nadler; SG Stephens (1997). "Creación de contactos eléctricos entre partículas metálicas mediante crecimiento electroquímico dirigido". Nature . 389 (6648): 268. Bibcode :1997Natur.389..268B. doi :10.1038/38464. S2CID 4329476.
- ^ G. Loget; A. Kuhn (2010). "Propulsión de microobjetos mediante autorregeneración bipolar dinámica". J. Am. Chem. Soc. 132 (45): 15918–9. doi :10.1021/ja107644x. PMID 20964295.
- ^ G. Loget; A. Kuhn (2011). "Locomoción química de objetos conductores inducida por campos eléctricos". Nature Communications . 2 (11): 535. Bibcode :2011NatCo...2E.535L. doi : 10.1038/ncomms1550 . PMID 22086336.