Electronegatividad

La electronegatividad , simbolizada como χ , es la tendencia de un átomo de un elemento químico dado a atraer electrones compartidos (o densidad electrónica ) al formar un enlace químico . [1] La electronegatividad de un átomo se ve afectada tanto por su número atómico como por la distancia a la que residen sus electrones de valencia del núcleo cargado. Cuanto mayor sea la electronegatividad asociada, más atrae electrones un átomo o un grupo sustituyente. La electronegatividad sirve como una forma sencilla de estimar cuantitativamente la energía de enlace y el signo y la magnitud de la polaridad química de un enlace , que caracteriza a un enlace a lo largo de la escala continua desde el enlace covalente hasta el iónico . El término electropositividad, definido de forma vaga , es lo opuesto a la electronegatividad: caracteriza la tendencia de un elemento a donar electrones de valencia.
En el nivel más básico, la electronegatividad está determinada por factores como la carga nuclear (cuanto más protones tenga un átomo, más "atracción" tendrá sobre los electrones) y el número y la ubicación de otros electrones en las capas atómicas (cuanto más electrones tenga un átomo, más lejos del núcleo estarán los electrones de valencia y, como resultado, menos carga positiva experimentarán, tanto por su mayor distancia del núcleo como porque los otros electrones en los orbitales centrales de menor energía actuarán para proteger a los electrones de valencia del núcleo cargado positivamente).
El término "electronegatividad" fue introducido por Jöns Jacob Berzelius en 1811, [2] aunque el concepto ya se conocía antes y fue estudiado por muchos químicos, incluido Avogadro . [2] A pesar de su larga historia, no se desarrolló una escala precisa de electronegatividad hasta 1932, cuando Linus Pauling propuso una escala de electronegatividad que depende de las energías de enlace, como un desarrollo de la teoría del enlace de valencia . [3] Se ha demostrado que se correlaciona con varias otras propiedades químicas. La electronegatividad no se puede medir directamente y debe calcularse a partir de otras propiedades atómicas o moleculares. Se han propuesto varios métodos de cálculo y, aunque puede haber pequeñas diferencias en los valores numéricos de la electronegatividad, todos los métodos muestran las mismas tendencias periódicas entre los elementos . [4]
El método de cálculo más utilizado es el propuesto originalmente por Linus Pauling. Este da una cantidad adimensional , comúnmente denominada escala de Pauling ( χ r ), en una escala relativa que va de 0,79 a 3,98 ( hidrógeno = 2,20). Cuando se utilizan otros métodos de cálculo, es convencional (aunque no obligatorio) citar los resultados en una escala que cubra el mismo rango de valores numéricos: esto se conoce como electronegatividad en unidades de Pauling .
Como se calcula habitualmente, la electronegatividad no es una propiedad de un átomo solo, sino más bien una propiedad de un átomo en una molécula . [5] Aun así, la electronegatividad de un átomo está fuertemente correlacionada con la primera energía de ionización . La electronegatividad está ligeramente correlacionada negativamente (para valores de electronegatividad más pequeños) y bastante fuertemente correlacionada positivamente (para la mayoría y mayores valores de electronegatividad) con la afinidad electrónica . [6] Es de esperar que la electronegatividad de un elemento varíe con su entorno químico, [7] pero generalmente se considera una propiedad transferible , es decir, que valores similares serán válidos en una variedad de situaciones.
El cesio es el elemento menos electronegativo (0,79); el flúor es el más (3,98).
Métodos de cálculo
Electronegatividad de Pauling
Pauling propuso por primera vez [3] el concepto de electronegatividad en 1932 para explicar por qué el enlace covalente entre dos átomos diferentes (A–B) es más fuerte que el promedio de los enlaces A–A y B–B. Según la teoría del enlace de valencia , de la que Pauling fue un destacado defensor, esta "estabilización adicional" del enlace heteronuclear se debe a la contribución de las formas canónicas iónicas al enlace.
La diferencia de electronegatividad entre los átomos A y B viene dada por: donde las energías de disociación , E d , de los enlaces A–B, A–A y B–B se expresan en electronvoltios , incluyéndose el factor (eV) − 1 ⁄ 2 para asegurar un resultado adimensional. Por lo tanto, la diferencia de electronegatividad de Pauling entre el hidrógeno y el bromo es 0,73 (energías de disociación: H–Br, 3,79 eV; H–H, 4,52 eV; Br–Br 2,00 eV)
Como sólo se definen las diferencias en electronegatividad, es necesario elegir un punto de referencia arbitrario para construir una escala. Se eligió el hidrógeno como referencia, ya que forma enlaces covalentes con una gran variedad de elementos: su electronegatividad se fijó primero [3] en 2,1, y luego se revisó [8] a 2,20. También es necesario decidir cuál de los dos elementos es el más electronegativo (equivale a elegir uno de los dos signos posibles para la raíz cuadrada). Esto se hace generalmente utilizando "intuición química": en el ejemplo anterior, el bromuro de hidrógeno se disuelve en agua para formar iones H + y Br − , por lo que se puede suponer que el bromo es más electronegativo que el hidrógeno. Sin embargo, en principio, dado que se deben obtener las mismas electronegatividades para dos compuestos enlazantes cualesquiera, los datos están de hecho sobredeterminados y los signos son únicos una vez que se ha fijado un punto de referencia (generalmente, para H o F).
Para calcular la electronegatividad de Pauling de un elemento, es necesario disponer de datos sobre las energías de disociación de al menos dos tipos de enlaces covalentes formados por ese elemento. AL Allred actualizó los valores originales de Pauling en 1961 para tener en cuenta la mayor disponibilidad de datos termodinámicos [8] , y son estos valores de electronegatividad de Pauling "revisados" los que se utilizan con más frecuencia.
El punto esencial de la electronegatividad de Pauling es que existe una fórmula semiempírica subyacente, bastante precisa, para las energías de disociación, a saber: o, a veces, un ajuste más preciso
Se trata de ecuaciones aproximadas, pero que se cumplen con bastante exactitud. Pauling obtuvo la primera ecuación al observar que un enlace puede representarse aproximadamente como una superposición mecánico-cuántica de un enlace covalente y dos estados de enlace iónicos. La energía covalente de un enlace es aproximadamente, mediante cálculos mecánico-cuánticos, la media geométrica de las dos energías de los enlaces covalentes de las mismas moléculas, y hay energía adicional que proviene de factores iónicos, es decir, el carácter polar del enlace.
La media geométrica es aproximadamente igual a la media aritmética —que se aplica en la primera fórmula anterior— cuando las energías son de un valor similar, por ejemplo, excepto para los elementos altamente electropositivos, donde hay una diferencia mayor entre las dos energías de disociación; la media geométrica es más precisa y casi siempre da un exceso de energía positiva, debido al enlace iónico. La raíz cuadrada de este exceso de energía, señala Pauling, es aproximadamente aditiva y, por lo tanto, se puede introducir la electronegatividad. Por lo tanto, son estas fórmulas semiempíricas para la energía de enlace las que sustentan el concepto de electronegatividad de Pauling.
Las fórmulas son aproximadas, pero esta aproximación es relativamente buena y proporciona la intuición correcta, con la noción de la polaridad del enlace y cierta base teórica en mecánica cuántica. Luego se determinan las electronegatividades para que se ajusten mejor a los datos.
En compuestos más complejos, existe un error adicional, ya que la electronegatividad depende del entorno molecular de un átomo. Además, la estimación de energía solo se puede utilizar para enlaces simples, no para enlaces múltiples. La entalpía de formación de una molécula que contiene solo enlaces simples se puede estimar posteriormente en función de una tabla de electronegatividad, y depende de los constituyentes y de la suma de los cuadrados de las diferencias de electronegatividades de todos los pares de átomos enlazados. Esta fórmula para estimar la energía suele tener un error relativo del orden del 10%, pero se puede utilizar para obtener una idea cualitativa aproximada y comprender una molécula.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo → | |||||||||||||||||||
| ↓ Period | |||||||||||||||||||
| 1 | H2.20 | Él | |||||||||||||||||
| 2 | Li 0,98 | Sea 1,57 | B 2.04 | C 2,55 | N° 3.04 | El 3.44 | 3,98 euros | Nordeste | |||||||||||
| 3 | Na 0,93 | 1,31 mg | Al 1,61 | Si 1.90 | Pág. 2.19 | S 2,58 | Cl 3.16 | Arkansas | |||||||||||
| 4 | K 0,82 | Aproximadamente 1,00 | Sc 1.36 | Ti 1,54 | Versión 1.63 | 1,66 cr | Manganeso 1,55 | Fe 1,83 | Co. 1,88 | Ni 1,91 | Cu 1,90 | Zinc 1,65 | Ga 1,81 | Ge 2.01 | Como 2.18 | Se 2.55 | 2,96 dólares | 3,00 coronas | |
| 5 | 0,82 rublos | 0,95 Sr. | Y 1.22 | Zr 1,33 | Número 1.6 | Lunes 2.16 | Tc1.9 | Ruso 2.2 | Rh 2,28 | Pd2.20 | 1,93 de plata | CD 1,69 | En 1,78 | Sn1,96 | Sb 2.05 | El 2.1 | Yo 2.66 | Xe2,60 | |
| 6 | Cs 0,79 | Ba 0,89 |  | Lunes 1.27 | HF 1,3 | Ta 1,5 | 2,36 | Respecto a 1.9 | Sistema operativo 2.2 | Ir 2.20 | Parte 2.28 | Au 2,54 | Hg 2,00 | TL1.62 | Plomo 1,87 | Bi 2.02 | Po 2.0 | A las 2.2 | Rn2.2 |
| 7 | Fr >0,79 [en 1] | Ra 0,9 |  | Lr 1.3 [en 2] | Rf | Db | Sg | Bh | Hs | Monte | Ds | Rg | En | Nueva Hampshire | Florida | Mc | Nivel | Ts | Sí |
 | La 1.1 | Este 1.12 | Pr 1.13 | Nd 1.14 | Primer Ministro – | Sm 1.17 | UE - | Dios 1.2 | Tuberculosis 1.1 | Día 1.22 | Ho 1.23 | Era 1.24 | 1,25 toneladas | Yb- | |||||
 | Ac 1.1 | Jueves 1.3 | Pa 1,5 | U1.38 | Número nominal 1,36 | Pu 1,28 | Soy 1.13 | 1,28 cm | Libro 1.3 | Véase 1.3 | Es 1.3 | Fm 1.3 | MD 1.3 | N° 1.3 | |||||
Véase también: Electronegatividades de los elementos (página de datos)
No existen fuentes fiables para Pm, Eu e Yb aparte del rango de 1,1 a 1,2; véase Pauling, Linus (1960). The Nature of the Chemical Bond. 3.ª ed., Cornell University Press, pág. 93.
- ^ Pauling escogió la electronegatividad del francio como 0,7, cercana a la del cesio (que también se evaluó como 0,7 en ese momento). El valor base del hidrógeno se incrementó más tarde en 0,10 y la electronegatividad del cesio se refinó más tarde a 0,79; sin embargo, no se han realizado refinamientos para el francio ya que no se ha realizado ningún experimento. Sin embargo, se espera que el francio sea más electronegativo que el cesio y, en pequeña medida, se ha observado que lo es. Véase francio para más detalles.
- ^ Véase Brown, Geoffrey (2012). La Tierra inaccesible: una visión integrada de su estructura y composición . Springer Science & Business Media. pág. 88. ISBN. 9789401115162.
Electronegatividad de Mulliken

Robert S. Mulliken propuso que la media aritmética de la primera energía de ionización (E i ) y la afinidad electrónica (E ea ) debería ser una medida de la tendencia de un átomo a atraer electrones: [9] [10]
Como esta definición no depende de una escala relativa arbitraria, también se la ha denominado electronegatividad absoluta , [11] con las unidades de kilojulios por mol o electronvoltios . Sin embargo, es más habitual utilizar una transformación lineal para transformar estos valores absolutos en valores que se asemejen a los valores de Pauling más conocidos. Para las energías de ionización y las afinidades electrónicas en electronvoltios, [12] y para las energías en kilojulios por mol, [13]
La electronegatividad de Mulliken sólo se puede calcular para un elemento cuya afinidad electrónica se conoce. Se dispone de valores medidos para 72 elementos, mientras que se han estimado o calculado valores aproximados para los elementos restantes. [ cita requerida ]
A veces se dice que la electronegatividad de Mulliken de un átomo es el negativo del potencial químico . [14] Al insertar las definiciones energéticas del potencial de ionización y la afinidad electrónica en la electronegatividad de Mulliken, es posible demostrar que el potencial químico de Mulliken es una aproximación de diferencia finita de la energía electrónica con respecto al número de electrones, es decir,
Electronegatividad de Allred-Rochow

A. Louis Allred y Eugene G. Rochow consideraron [15] que la electronegatividad debería estar relacionada con la carga que experimenta un electrón en la "superficie" de un átomo: Cuanto mayor sea la carga por unidad de área de la superficie atómica, mayor será la tendencia de ese átomo a atraer electrones. La carga nuclear efectiva , Z eff , que experimentan los electrones de valencia se puede estimar utilizando las reglas de Slater , mientras que el área de superficie de un átomo en una molécula se puede tomar como proporcional al cuadrado del radio covalente , r cov . Cuando r cov se expresa en picómetros , [16]
Igualación de electronegatividad de Sanderson

RT Sanderson también ha notado la relación entre la electronegatividad de Mulliken y el tamaño atómico, y ha propuesto un método de cálculo basado en el recíproco del volumen atómico. [17] Con un conocimiento de las longitudes de enlace, el modelo de Sanderson permite la estimación de las energías de enlace en una amplia gama de compuestos. [18] El modelo de Sanderson también se ha utilizado para calcular la geometría molecular, la energía del electrón s , las constantes de acoplamiento espín-espín de RMN y otros parámetros para compuestos orgánicos. [19] [20] Este trabajo subyace al concepto de ecualización de electronegatividad , que sugiere que los electrones se distribuyen alrededor de una molécula para minimizar o igualar la electronegatividad de Mulliken. [21] Este comportamiento es análogo a la ecualización del potencial químico en la termodinámica macroscópica. [22]
Electronegatividad de Allen

Quizás la definición más simple de electronegatividad es la de Leland C. Allen, quien propuso que está relacionada con la energía promedio de los electrones de valencia en un átomo libre, [23] [24] [25]
donde ε s,p son las energías de un electrón de los electrones s y p en el átomo libre y n s,p son el número de electrones s y p en la capa de valencia. Es habitual aplicar un factor de escala, 1,75×10 −3 para energías expresadas en kilojulios por mol o 0,169 para energías medidas en electronvoltios, para dar valores que sean numéricamente similares a las electronegatividades de Pauling. [ cita requerida ]
Las energías de un electrón se pueden determinar directamente a partir de datos espectroscópicos , por lo que las electronegatividades calculadas por este método a veces se denominan electronegatividades espectroscópicas . Los datos necesarios están disponibles para casi todos los elementos, y este método permite la estimación de electronegatividades para elementos que no se pueden tratar con otros métodos, por ejemplo, el francio , que tiene una electronegatividad de Allen de 0,67. [26] Sin embargo, no está claro qué se debe considerar como electrones de valencia para los elementos del bloque d y f, lo que conduce a una ambigüedad para sus electronegatividades calculadas por el método de Allen.
En esta escala, el neón tiene la electronegatividad más alta de todos los elementos, seguido por el flúor , el helio y el oxígeno .
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Period | ||||||||||||||||||
| 1 | Alto 2.300 | El 4.160 | ||||||||||||||||
| 2 | Li 0,912 | Sea 1.576 | B 2.051 | C 2.544 | N° 3.066 | O 3.610 | F4.193 | No 4.787 | ||||||||||
| 3 | Na 0,869 | 1,293 mg | Al 1.613 | Si 1.916 | Pág. 2.253 | S 2.589 | Cl 2.869 | Ar 3.242 | ||||||||||
| 4 | K 0,734 | Aproximadamente 1.034 | Sc 1.19 | Ti 1.38 | Versión 1.53 | 1,65 cr | Manganeso 1,75 | Fe 1,80 | Co. 1,84 | Ni 1,88 | Cu 1,85 | Zinc 1,588 | Ga 1.756 | 1.994 de enero | Como 2.211 | Se 2.424 | 2.685 brasil | 2,966 coronas |
| 5 | 0,706 rublos | Sr. 0,963 | Y 1.12 | Zr 1,32 | Número 1,41 | Lunes 1,47 | Tc1,51 | 1,54 rupias | 1,56 RH | Pd1.58 | Ag 1,87 | CD 1.521 | En 1.656 | Número de serie 1.824 | Sb 1.984 | Te 2.158 | Yo 2.359 | Xe2.582 |
| 6 | Cs 0,659 | Ba 0,881 | Lunes 1.09 | HF 1,16 | Ta 1,34 | 1,47 ancho | Respecto a 1.60 | Sistema operativo 1.65 | Ir 1,68 | Parte 1.72 | 1,92 Au | Hg 1,765 | 1.789 liras | Peso 1,854 | Bi 2.01 | Po2.19 | A las 2,39 | Rn2,60 |
| 7 | 0,67 francos | Ra 0,89 | ||||||||||||||||
| Ver también: Electronegatividades de los elementos (página de datos) | ||||||||||||||||||
Correlación de la electronegatividad con otras propiedades

La amplia variedad de métodos de cálculo de electronegatividades, que arrojan resultados que se correlacionan bien entre sí, es una indicación de la cantidad de propiedades químicas que pueden verse afectadas por la electronegatividad. La aplicación más obvia de las electronegatividades es en el análisis de la polaridad de los enlaces , para lo cual Pauling introdujo el concepto. En general, cuanto mayor sea la diferencia de electronegatividad entre dos átomos, más polar será el enlace que se formará entre ellos, y el átomo que tenga la electronegatividad más alta estará en el extremo negativo del dipolo. Pauling propuso una ecuación para relacionar el "carácter iónico" de un enlace con la diferencia de electronegatividad de los dos átomos, [5] aunque esta ecuación ha caído en desuso.
Se han demostrado varias correlaciones entre las frecuencias de estiramiento infrarrojo de ciertos enlaces y las electronegatividades de los átomos involucrados: [27] sin embargo, esto no es sorprendente ya que dichas frecuencias de estiramiento dependen en parte de la fuerza del enlace, que entra en el cálculo de las electronegatividades de Pauling. Más convincentes son las correlaciones entre la electronegatividad y los desplazamientos químicos en la espectroscopia de RMN [28] o los desplazamientos de isómeros en la espectroscopia de Mössbauer [29] (ver figura). Ambas mediciones dependen de la densidad de electrones s en el núcleo, y por lo tanto son una buena indicación de que las diferentes medidas de electronegatividad realmente están describiendo "la capacidad de un átomo en una molécula para atraer electrones hacia sí mismo". [1] [5]
Tendencias en electronegatividad
Tendencias periódicas
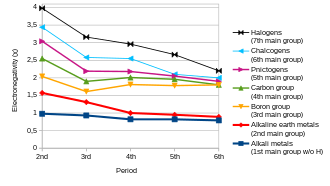
En general, la electronegatividad aumenta al pasar de izquierda a derecha a lo largo de un período y disminuye al descender en un grupo. Por lo tanto, el flúor es el más electronegativo de los elementos (sin contar los gases nobles ), mientras que el cesio es el menos electronegativo, al menos de aquellos elementos para los que se dispone de datos sustanciales. [26] Esto llevaría a creer que el fluoruro de cesio es el compuesto cuyo enlace presenta el carácter más iónico. [ cita requerida ]
Existen algunas excepciones a esta regla general. El galio y el germanio tienen electronegatividades más altas que el aluminio y el silicio , respectivamente, debido a la contracción del bloque d . Los elementos del cuarto período inmediatamente después de la primera fila de los metales de transición tienen radios atómicos inusualmente pequeños porque los electrones 3d no son efectivos para proteger la carga nuclear aumentada, y un tamaño atómico más pequeño se correlaciona con una electronegatividad más alta (ver electronegatividad de Allred-Rochow y electronegatividad de Sanderson más arriba). La electronegatividad anómalamente alta del plomo , en particular cuando se compara con el talio y el bismuto , es un artefacto de la electronegatividad que varía con el estado de oxidación: su electronegatividad se ajusta mejor a las tendencias si se cita para el estado +2 con un valor de Pauling de 1,87 en lugar del estado +4.
Variación de la electronegatividad con el número de oxidación
En química inorgánica, es común considerar que un único valor de electronegatividad es válido para la mayoría de las situaciones "normales". Si bien este enfoque tiene la ventaja de la simplicidad, es evidente que la electronegatividad de un elemento no es una propiedad atómica invariable y, en particular, aumenta con el estado de oxidación del elemento. [30]
Allred utilizó el método de Pauling para calcular electronegatividades independientes para diferentes estados de oxidación de un puñado de elementos (incluidos el estaño y el plomo) para los que había suficientes datos disponibles. [8] Sin embargo, para la mayoría de los elementos, no hay suficientes compuestos covalentes diferentes para los que se conozcan las energías de disociación de enlaces como para que este enfoque sea factible. Esto es particularmente cierto en el caso de los elementos de transición, donde los valores de electronegatividad citados suelen ser, necesariamente, promedios de varios estados de oxidación diferentes y donde, como resultado, las tendencias en electronegatividad son más difíciles de ver. [ cita requerida ]
| Ácido | Fórmula | Estado de oxidación del cloro | pK a |
|---|---|---|---|
| Ácido hipocloroso | HClO | +1 | +7.5 |
| Ácido cloroso | HClO2 | +3 | +2.0 |
| Ácido clorhídrico | HClO3 | +5 | -1.0 |
| Ácido perclórico | HClO4 | +7 | -10 |
Los efectos químicos de este aumento de electronegatividad se pueden observar tanto en las estructuras de óxidos y haluros como en la acidez de óxidos y oxoácidos. Así, CrO 3 y Mn 2 O 7 son óxidos ácidos con puntos de fusión bajos , mientras que Cr 2 O 3 es anfótero y Mn 2 O 3 es un óxido completamente básico .
El efecto también se puede ver claramente en las constantes de disociación p K a de los oxoácidos del cloro . El efecto es mucho mayor de lo que podría explicarse por la carga negativa compartida entre un mayor número de átomos de oxígeno, lo que llevaría a una diferencia en p K a de log 10 ( 1 ⁄ 4 ) = –0,6 entre el ácido hipocloroso y el ácido perclórico . A medida que aumenta el estado de oxidación del átomo de cloro central, se extrae más densidad electrónica de los átomos de oxígeno hacia el cloro, disminuyendo la carga negativa parcial de los átomos de oxígeno individuales. Al mismo tiempo, la carga parcial positiva en el hidrógeno aumenta con un estado de oxidación más alto. Esto explica la mayor acidez observada con un estado de oxidación creciente en los oxoácidos del cloro.
Esquema de electronegatividad e hibridación
La electronegatividad de un átomo cambia dependiendo de la hibridación del orbital empleado en el enlace. Los electrones en orbitales s se mantienen más fuertemente unidos que los electrones en orbitales p. Por lo tanto, un enlace a un átomo que emplea un orbital híbrido sp x para el enlace estará más fuertemente polarizado hacia ese átomo cuando el orbital híbrido tenga más carácter s. Es decir, cuando se comparan las electronegatividades para diferentes esquemas de hibridación de un elemento dado, el orden χ(sp 3 ) < χ(sp 2 ) < χ(sp) se cumple (la tendencia también debería aplicarse a los índices de hibridación no enteros ). Si bien esto es cierto en principio para cualquier elemento del grupo principal, los valores para la electronegatividad específica de la hibridación se citan con mayor frecuencia para el carbono. En química orgánica, estas electronegatividades se invocan con frecuencia para predecir o racionalizar las polaridades de enlace en compuestos orgánicos que contienen enlaces dobles y triples al carbono. [ cita requerida ]
| Hibridación | χ (Pauling) [31] |
|---|---|
| C( sp3 ) | 2.3 |
| C( sp2 ) | 2.6 |
| C(sp) | 3.1 |
| C 'genérico' | 2.5 |
Electronegatividad de grupo
En química orgánica, la electronegatividad se asocia más con diferentes grupos funcionales que con átomos individuales. Los términos electronegatividad de grupo y electronegatividad de sustituyentes se utilizan como sinónimos. Sin embargo, es común distinguir entre el efecto inductivo y el efecto de resonancia , que podrían describirse como electronegatividades σ y π, respectivamente. Hay una serie de relaciones lineales de energía libre que se han utilizado para cuantificar estos efectos, de las cuales la ecuación de Hammett es la más conocida. Los parámetros de Kabachnik son electronegatividades de grupo para su uso en la química de organofosforados .
Electropositividad
La electropositividad es una medida de la capacidad de un elemento para donar electrones y, por lo tanto, formar iones positivos ; por lo tanto, es la antípoda de la electronegatividad.
Principalmente, este es un atributo de los metales , es decir, en general, cuanto mayor es el carácter metálico de un elemento mayor es la electropositividad. Por ello, los metales alcalinos son los más electropositivos de todos. Esto se debe a que tienen un solo electrón en su capa externa y, como este se encuentra relativamente alejado del núcleo del átomo, se pierde con facilidad; en otras palabras, estos metales tienen energías de ionización bajas . [32]
Mientras que la electronegatividad aumenta a lo largo de los períodos de la tabla periódica y disminuye a medida que descienden los grupos , la electropositividad disminuye a lo largo de los períodos (de izquierda a derecha) y aumenta a medida que descienden los grupos. Esto significa que los elementos en la parte superior derecha de la tabla periódica de elementos (oxígeno, azufre, cloro, etc.) tendrán la mayor electronegatividad, y los de la parte inferior izquierda (rubidio, cesio y francio) la mayor electropositividad.
Véase también
- Polaridad química
- Afinidad electrónica
- Electronegatividades de los elementos (página de datos)
- Energía de ionización
- Unión metálica
- El modelo de Miedema
- Hibridación orbital
- Estado de oxidación
- Tabla periódica
Referencias
- ^ ab IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Electronegatividad". doi :10.1351/goldbook.E01990
- ^ ab Jensen, WB (1996). "Electronegatividad desde Avogadro hasta Pauling: Parte 1: Orígenes del concepto de electronegatividad". Revista de educación química . 73 (1): 11–20. Código Bibliográfico :1996JChEd..73...11J. doi :10.1021/ed073p11.
- ^ abc Pauling, L. (1932). "La naturaleza del enlace químico. IV. La energía de los enlaces simples y la electronegatividad relativa de los átomos". Revista de la Sociedad Química Americana . 54 (9): 3570–3582. doi :10.1021/ja01348a011.
- ^ Sproul, Gordon D. (26 de mayo de 2020). "Evaluación de escalas de electronegatividad". ACS Omega . 5 (20): 11585–11594. doi :10.1021/acsomega.0c00831. PMC 7254809 . PMID 32478249.
- ^ abc Pauling, Linus (1960). Naturaleza del enlace químico . Cornell University Press. págs. 88-107. ISBN 978-0-8014-0333-0.
- ^ "PubChem ElectroNegativity", descargado, graficado y correlacionado entre 'Electronegativity' y 'ElectronAffinity', que muestra una correlación positiva bastante fuerte de '0,712925965'. (Consultado el 16 de septiembre de 2023).
- ^ Greenwood, NN; Earnshaw, A. (1984). Química de los elementos . Pergamon. pág. 30. ISBN 978-0-08-022057-4.
- ^ abc Allred, AL (1961). "Valores de electronegatividad a partir de datos termoquímicos". Revista de química inorgánica y nuclear . 17 (3–4): 215–221. doi :10.1016/0022-1902(61)80142-5.
- ^ Mulliken, RS (1934). "Una nueva escala de electroafinidad; junto con datos sobre estados de valencia y sobre potenciales de ionización de valencia y afinidades electrónicas". Journal of Chemical Physics . 2 (11): 782–793. Bibcode :1934JChPh...2..782M. doi :10.1063/1.1749394.
- ^ Mulliken, RS (1935). "Estructuras electrónicas de moléculas XI. Electroafinidad, orbitales moleculares y momentos dipolares". J. Chem. Phys. 3 (9): 573–585. Código Bibliográfico :1935JChPh...3..573M. doi :10.1063/1.1749731.
- ^ Pearson, RG (1985). "Electronegatividad absoluta y dureza absoluta de ácidos y bases de Lewis". J. Am. Chem. Soc. 107 (24): 6801–6806. doi :10.1021/ja00310a009.
- ^ Huheey, JE; Keiter, EA; Keiter, RL (1 de diciembre de 2008) [1978]. "17". En Kauffman, GB (ed.). Química inorgánica: principios de estructura y reactividad (digitalizado) (3.ª ed.). Nueva York (publicado en 1900). pág. 167. doi :10.1021/ed050pA379.1. ISBN 9780060429874. OCLC 770736023. inorganicchemist00huhe_0. Archivado desde el original el 8 de septiembre de 2019. Consultado el 15 de diciembre de 2020 – vía Oxford University Press.
{{cite book}}: CS1 maint: location missing publisher (link)URL alternativa - ^ Esta segunda relación se ha recalculado utilizando los mejores valores de las primeras energías de ionización y afinidades electrónicas disponibles en 2006.
- ^ Franco-Pérez, Marco; Gázquez, José L. (31 de octubre de 2019). "Electronegatividades de Pauling y Mulliken en la teoría del funcional de la densidad". Journal of Physical Chemistry A . 123 (46): 10065–10071. Bibcode :2019JPCA..12310065F. doi :10.1021/acs.jpca.9b07468. PMID 31670960. S2CID 207814569.
- ^ Allred, AL; Rochow, EG (1958). "Una escala de electronegatividad basada en la fuerza electrostática". Revista de química inorgánica y nuclear . 5 (4): 264–268. doi :10.1016/0022-1902(58)80003-2.
- ^ Housecroft, CE; Sharpe, AG (1 de noviembre de 1993). Química inorgánica (libro electrónico). Vol. 3 (15.ª ed.). Suiza: Pearson Prentice-Hall. p. 38. doi :10.1021/ed070pA304.1. ISBN 9780273742753– a través de la Universidad de Basilea.URL alternativa
- ^ Sanderson, RT (1983). "Electronegatividad y energía de enlace". Revista de la Sociedad Química Americana . 105 (8): 2259–2261. doi :10.1021/ja00346a026.
- ^ Sanderson, RT (1983). Covalencia polar . Nueva York: Academic Press. ISBN 978-0-12-618080-0.
- ^ Zefirov, NS; Kirpichenok, MA; Izmailov, FF; Trofimov, MI (1987). "Esquemas de cálculo para electronegatividades atómicas en gráficos moleculares en el marco del principio de Sanderson". Doklady Akademii Nauk SSSR . 296 : 883–887.
- ^ Trofimov, MI; Smolenskii, EA (2005). "Aplicación de los índices de electronegatividad de moléculas orgánicas a tareas de informática química". Boletín químico ruso . 54 (9): 2235–2246. doi :10.1007/s11172-006-0105-6. S2CID 98716956.
- ^ SW Rick; SJ Stuart (2002). "Modelos de ecualización de electronegatividad". En Kenny B. Lipkowitz; Donald B. Boyd (eds.). Reseñas en química computacional . Wiley. pág. 106. ISBN 978-0-471-21576-9.
- ^ Robert G. Parr; Weitao Yang (1994). Teoría funcional de la densidad de átomos y moléculas. Oxford University Press. pág. 91. ISBN 978-0-19-509276-9.
- ^ Allen, Leland C. (1989). "La electronegatividad es la energía promedio de un electrón de los electrones de la capa de valencia en átomos libres en estado fundamental". Journal of the American Chemical Society . 111 (25): 9003–9014. doi :10.1021/ja00207a003.
- ^ Mann, Joseph B.; Meek, Terry L.; Allen, Leland C. (2000). "Energías de configuración de los elementos del grupo principal". Revista de la Sociedad Química Americana . 122 (12): 2780–2783. doi :10.1021/ja992866e.
- ^ Mann, Joseph B.; Meek, Terry L.; Knight, Eugene T.; Capitani, Joseph F.; Allen, Leland C. (2000). "Energías de configuración de los elementos del bloque d". Revista de la Sociedad Química Americana . 122 (21): 5132–5137. doi :10.1021/ja9928677.
- ^ ab La electronegatividad de Pauling, ampliamente citada, de 0,7 para el francio es un valor extrapolado de procedencia incierta. La electronegatividad de Allen del cesio es 0,66.
- ^ Véase, por ejemplo, Bellamy, LJ (1958). Los espectros infrarrojos de moléculas complejas. Nueva York: Wiley. pág. 392. ISBN. 978-0-412-13850-8.
- ^ Spieseke, H.; Schneider, WG (1961). "Efecto de la electronegatividad y la anisotropía magnética de los sustituyentes en los desplazamientos químicos de C13 y H1 en compuestos CH3X y CH3CH2X". Journal of Chemical Physics . 35 (2): 722. Bibcode :1961JChPh..35..722S. doi :10.1063/1.1731992.
- ^ Clasen, CA; Good, ML (1970). "Interpretación de los espectros de Moessbauer de complejos hexahalo mixtos de estaño(IV)". Química inorgánica . 9 (4): 817–820. doi :10.1021/ic50086a025.
- ^ Li, Keyan; Xue, Dongfeng (1 de octubre de 2006). "Estimación de los valores de electronegatividad de elementos en diferentes estados de valencia". The Journal of Physical Chemistry A . 110 (39): 11332–11337. Bibcode :2006JPCA..11011332L. doi :10.1021/jp062886k. ISSN 1089-5639. PMID 17004743.
- ^ Fleming, Ian (2009). Orbitales moleculares y reacciones químicas orgánicas (edición de estudiantes). Chichester, West Sussex, Reino Unido: Wiley. ISBN 978-0-4707-4660-8.OCLC 424555669 .
- ^ "Electropositividad", Enciclopedia Microsoft Encarta Online 2009. (Archivado el 31 de octubre de 2009).
Bibliografía
- Jolly, William L. (1991). Química inorgánica moderna (2.ª ed.). Nueva York: McGraw-Hill . Págs. 71–76. ISBN. 978-0-07-112651-9.
- Mullay, J. (1987). "Estimación de electronegatividades atómicas y de grupo". Electronegatividad . Estructura y enlace. Vol. 66. págs. 1–25. doi :10.1007/BFb0029834. ISBN. 978-3-540-17740-1.
Enlaces externos
 Medios relacionados con la electronegatividad en Wikimedia Commons
Medios relacionados con la electronegatividad en Wikimedia Commons- WebElements enumera los valores de electronegatividades mediante varios métodos de cálculo diferentes
- Vídeo explicativo de la electronegatividad
- Tabla de electronegatividad, una lista resumida de la electronegatividad de cada elemento junto con una tabla periódica interactiva









