Ratón modificado genéticamente
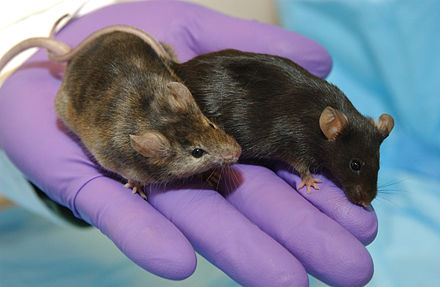
Un ratón modificado genéticamente , modelo de ratón genéticamente modificado ( GEMM ) [1] o ratón transgénico es un ratón ( Mus musculus ) al que se le ha alterado su genoma mediante el uso de técnicas de ingeniería genética . Los ratones modificados genéticamente se utilizan habitualmente para la investigación o como modelos animales de enfermedades humanas y también se utilizan para la investigación sobre genes. Junto con los xenoinjertos derivados de pacientes (PDX), los GEMM son los modelos in vivo más comunes en la investigación del cáncer . Ambos enfoques se consideran complementarios y pueden utilizarse para recapitular diferentes aspectos de la enfermedad. [2] Los GEMM también son de gran interés para el desarrollo de fármacos , ya que facilitan la validación de objetivos y el estudio de la respuesta, la resistencia, la toxicidad y la farmacodinámica . [3]
Historia
En 1974, Beatrice Mintz y Rudolf Jaenisch crearon el primer animal modificado genéticamente insertando un virus de ADN en un embrión de ratón en etapa temprana y demostrando que los genes insertados estaban presentes en cada célula. [4] Sin embargo, los ratones no pasaron el transgén a su descendencia, y el impacto y la aplicabilidad de este experimento fueron, por tanto, limitados. En 1981, los laboratorios de Frank Ruddle [5] de la Universidad de Yale , Frank Costantini y Elizabeth Lacy de Oxford , y Ralph L. Brinster y Richard Palmiter en colaboración de la Universidad de Pensilvania y la Universidad de Washington inyectaron ADN purificado en un embrión de ratón unicelular utilizando técnicas desarrolladas por Brinster en los años 1960 y 1970, mostrando la transmisión del material genético a las generaciones posteriores por primera vez. [6] [7] [8] Durante la década de 1980, Palmiter y Brinster desarrollaron y lideraron el campo de la transgénesis, refinando los métodos de modificación de la línea germinal y utilizando estas técnicas para dilucidar la actividad y la función de los genes de una manera que no era posible antes de su enfoque único. [9]
Métodos
Existen dos enfoques técnicos básicos para producir ratones modificados genéticamente. El primero implica la inyección pronuclear , una técnica desarrollada y refinada por Ralph L. Brinster en los años 1960 y 1970, en una sola célula del embrión del ratón, donde se integrará aleatoriamente en el genoma del ratón. [10] Este método crea un ratón transgénico y se utiliza para insertar nueva información genética en el genoma del ratón o para sobreexpresar genes endógenos . El segundo enfoque, iniciado por Oliver Smithies y Mario Capecchi , implica la modificación de células madre embrionarias con una construcción de ADN que contiene secuencias de ADN homólogas al gen diana. Se seleccionan células madre embrionarias que se recombinan con el ADN genómico y luego se inyectan en los blastocistos de los ratones . [11] Este método se utiliza para manipular un solo gen, en la mayoría de los casos "eliminando" el gen diana, aunque cada vez puede ocurrir una manipulación genética más sutil y compleja (por ejemplo, la humanización de una proteína específica o solo cambiando nucleótidos individuales ). También se puede crear un ratón humanizado mediante la adición directa de genes humanos, creando así una forma murina de híbrido humano-animal . Por ejemplo, los ratones modificados genéticamente pueden nacer con genes de antígeno leucocitario humano para proporcionar un entorno más realista al introducir en ellos glóbulos blancos humanos con el fin de estudiar las respuestas del sistema inmunológico . [12] Una de esas aplicaciones es la identificación de péptidos del virus de la hepatitis C (VHC) que se unen al HLA y que pueden ser reconocidos por el sistema inmunológico humano, por lo que podrían ser objetivos potenciales para futuras vacunas contra el VHC. [13]
Usos

Los ratones modificados genéticamente se utilizan ampliamente en la investigación como modelos de enfermedades humanas. [14] Los ratones son un modelo útil para la manipulación genética y la investigación, ya que sus tejidos y órganos son similares a los de un humano y llevan prácticamente todos los mismos genes que operan en los humanos. [15] También tienen ventajas sobre otros mamíferos, en lo que respecta a la investigación, en que están disponibles en cientos de cepas genéticamente homogéneas. [15] Además, debido a su tamaño, se pueden mantener y alojar en grandes cantidades, lo que reduce el costo de la investigación y los experimentos. [15] El tipo más común es el ratón knockout , donde se elimina la actividad de un solo gen (o en algunos casos múltiples). Se han utilizado para estudiar y modelar la obesidad, las enfermedades cardíacas, la diabetes, la artritis, el abuso de sustancias, la ansiedad, el envejecimiento, la recepción de la temperatura y el dolor y la enfermedad de Parkinson. [16] [17] Los ratones transgénicos generados para portar oncogenes clonados y los ratones knockout que carecen de genes supresores de tumores han proporcionado buenos modelos para el cáncer humano . Se han desarrollado cientos de estos oncólogos que cubren una amplia gama de cánceres que afectan a la mayoría de los órganos del cuerpo y se están perfeccionando para que sean más representativos del cáncer humano. [9] Los síntomas de la enfermedad y los posibles medicamentos o tratamientos se pueden probar contra estos modelos de ratón.
Un ratón ha sido modificado genéticamente para aumentar el crecimiento y la fuerza muscular mediante la sobreexpresión del factor de crecimiento similar a la insulina I (IGF-I) en fibras musculares diferenciadas . [18] [19] A otro ratón se le ha alterado un gen que está involucrado en el metabolismo de la glucosa y corre más rápido, vive más tiempo, es más activo sexualmente y come más sin engordar que el ratón promedio (ver Superratones metabólicos ). [20] [21] A otro ratón se le bloqueó o eliminó el receptor TRPM8 en un estudio que involucraba capsaicina y mentol . [17] Con el receptor TRPM8 eliminado, el ratón no pudo detectar pequeños cambios en la temperatura y el dolor asociado con ella. [17]
Se debe tener mucho cuidado al decidir cómo utilizar ratones modificados genéticamente en la investigación. [22] Incluso cuestiones básicas como la elección del ratón de control "de tipo salvaje" correcto para utilizar en la comparación a veces se pasan por alto. [23]
Véase también
Referencias
- ^ Singh, M.; Murriel, CL; Johnson, L. (16 de mayo de 2012). "Modelos de ratones genéticamente modificados: cerrando la brecha entre los datos preclínicos y los resultados de los ensayos". Cancer Research . 72 (11): 2695–2700. doi : 10.1158/0008-5472.CAN-11-2786 . PMID 22593194.
- ^ Abate-Shen, C.; Pandolfi, PP (30 de septiembre de 2013). "Utilización eficaz y selección apropiada de modelos de ratón genéticamente modificados para la integración traslacional de ensayos con ratones y humanos". Protocolos de Cold Spring Harbor . 2013 (11): 1006–1011. doi : 10.1101/pdb.top078774 . PMC 4382078. PMID 24173311 .
- ^ Sharpless, Norman E.; DePinho, Ronald A. (septiembre de 2006). "El ratón poderoso: modelos de ratón genéticamente modificados en el desarrollo de fármacos contra el cáncer". Nature Reviews Drug Discovery . 5 (9): 741–754. doi :10.1038/nrd2110. ISSN 1474-1784. PMID 16915232. S2CID 7254415.
- ^ Jaenisch, R.; Mintz, B. (1974). "Secuencias de ADN del virus simio 40 en el ADN de ratones adultos sanos derivados de blastocistos preimplantacionales inyectados con ADN viral". Proc. Natl. Sci . 71 (4): 1250–1254. Bibcode :1974PNAS...71.1250J. doi : 10.1073/pnas.71.4.1250 . PMC 388203 . PMID 4364530.
- ^ Kucherlapati, Raju; Leinwand, Leslie A. (2013). "Frank Ruddle (1929–2013". Revista estadounidense de genética humana . 92 (6): 839–840. doi :10.1016/j.ajhg.2013.05.012. PMC 3675234 . PMID 24242788.
- ^ Gordon, J.; Ruddle, F. (1981). "Integración y transmisión estable de genes inyectados en pronúcleos de ratón" en línea germinal. Science . 214 (4526): 1244–6. Bibcode :1981Sci...214.1244G. doi :10.1126/science.6272397. PMID 6272397.
- ^ Costantini, F.; Lacy, E. (1981). "Introducción de un gen de β-globina de conejo en la línea germinal del ratón". Nature . 294 (5836): 92–4. Bibcode :1981Natur.294...92C. doi :10.1038/294092a0. PMID 6945481. S2CID 4371351.
- ^ Brinster R, Chen HY, Trumbauer M, Senear AW, Warren R, Palmiter RD (1981). "Expresión somática de la timidina quinasa del herpes en ratones tras la inyección de un gen de fusión en óvulos". Cell . 27 (1 Pt 2): 223–231. doi :10.1016/0092-8674(81)90376-7. PMC 4883678 . PMID 6276022.
- ^ ab Douglas Hanahan; Erwin F. Wagner; Richard D. Palmiter (2007). "Los orígenes del oncomice: una historia de los primeros ratones transgénicos modificados genéticamente para desarrollar cáncer". Genes Dev . 21 (18): 2258–2270. doi : 10.1101/gad.1583307 . PMID: 17875663.
- ^ Gordon, JW, Scangos, GA, Plotkin, DJ, Barbosa, JA y Ruddle FH (1980). "Transformación genética de embriones de ratón mediante microinyección de ADN purificado". Proc. Natl. Sci. USA . 77 (12): 7380–7384. Bibcode :1980PNAS...77.7380G. doi : 10.1073/pnas.77.12.7380 . PMC 350507 . PMID 6261253.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Thomas KR, Capecchi MR (1987). "Mutagénesis dirigida por selección de genes en células madre derivadas de embriones de ratón". Cell . 51 (3): 503–12. doi :10.1016/0092-8674(87)90646-5. PMID 2822260. S2CID 31961262.
- ^ Yong KS, Her Z, Chen Q (agosto de 2018). "Ratones humanizados como herramientas únicas para estudios específicos sobre humanos". Archivum Immunologiae et Therapiae Experimentalis . 66 (4): 245–266. doi :10.1007/s00005-018-0506-x. PMC 6061174 . PMID 29411049.
- ^ "Cepa de ratón C57BL/6-Mcph1Tg(HLA-A2.1)1Enge". The Jackson Laboratory . Consultado el 6 de enero de 2023 .
- ^ "Antecedentes: Animales clonados y modificados genéticamente". Centro de Genética y Sociedad. 14 de abril de 2005. Archivado desde el original el 23 de noviembre de 2016. Consultado el 11 de julio de 2010 .
- ^ abc Hofker, Marten H.; Deursen, Jan van (2002). Ratón Transgénico . Totowa, Nueva Jersey: Humana Press. págs.1. ISBN 0-89603-915-3.
- ^ "Ratones knock-out". Instituto Nacional de Investigación del Genoma Humano. 2009.
- ^ abc Julius, David. "Cómo los pimientos y la menta identificaron los receptores sensoriales de la temperatura y el dolor". iBiology . Consultado el 14 de mayo de 2020 .
- ^ McPherron, A.; Lawler, A.; Lee, S. (1997). "Regulación de la masa muscular esquelética en ratones por un nuevo miembro de la superfamilia TGF-beta". Nature . 387 (6628): 83–90. Bibcode :1997Natur.387...83M. doi :10.1038/387083a0. PMID 9139826. S2CID 4271945.
- ^ Elisabeth R. Barton-Davis; Daria I. Shoturma; Antonio Musaro; Nadia Rosenthal; H. Lee Sweeney (1998). "La expresión mediada por virus del factor de crecimiento similar a la insulina I bloquea la pérdida de la función del músculo esquelético relacionada con el envejecimiento". PNAS . 95 (26): 15603–15607. Bibcode :1998PNAS...9515603B. doi : 10.1073/pnas.95.26.15603 . PMC 28090 . PMID 9861016.
- ^ "Un superratón diseñado genéticamente sorprende a los científicos". AAP . 3 de noviembre de 2007.
- ^ Hakimi P, Yang J, Casadesus G, Massillon D, Tolentino-Silva F, Nye C, Cabrera M, Hagen D, Utter C, Baghdy Y, Johnson DH, Wilson DL, Kirwan JP, Kalhan SC, Hanson RW (2007). "La sobreexpresión de la forma citosólica de la fosfoenolpiruvato carboxiquinasa (GTP) en el músculo esquelético reestructura el metabolismo energético en el ratón". Journal of Biological Chemistry . 282 (45): 32844–32855. doi : 10.1074/jbc.M706127200 . PMC 4484620 . PMID 17716967.
- ^ Crusio, WE ; Goldowitz, D.; Holmes, A.; Wolfer, D. (2009). "Estándares para la publicación de estudios sobre mutantes en ratones". Genes, cerebro y comportamiento . 8 (1): 1–4. doi : 10.1111/j.1601-183X.2008.00438.x . PMID 18778401. S2CID 205853147.
- ^ Mohammed Bourdi; John S. Davies; Lance R. Pohl (2011). "El emparejamiento incorrecto de las subcepas C57BL/6 de ratones modificados genéticamente y controles de tipo salvaje puede conducir a resultados confusos, como sucedió en los estudios de JNK2 en la lesión hepática causada por acetaminofeno y concanavalina A". Chemical Research in Toxicology . 24 (6): 794–796. doi :10.1021/tx200143x. PMC 3157912 . PMID 21557537.
Enlaces externos
- Informática del genoma del ratón (informatics.jax.org)
- Unidad de Genética de Mamíferos Harwell: modelos de ratón para enfermedades humanas