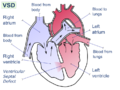
Defecto del tabique ventricular
| Defecto del tabique ventricular | |
|---|---|
 | |
| Ilustración que muestra diversas formas de defectos del tabique ventricular. 1. Conoventricular, mal alineado 2. Perimembranoso 3. Entrada 4. Muscular | |
| Especialidad | Cirugía cardíaca |
Un defecto del tabique ventricular ( VSD ) es un defecto en el tabique ventricular , la pared que divide los ventrículos izquierdo y derecho del corazón . La extensión de la abertura puede variar desde el tamaño de un alfiler hasta la ausencia total del tabique ventricular, creando un ventrículo común. El tabique ventricular consta de una porción muscular inferior y una porción membranosa superior y está ampliamente inervado por cardiomiocitos conductores .
La porción membranosa, que está cerca del nódulo auriculoventricular , es la más comúnmente afectada en adultos y niños mayores en los Estados Unidos. [1] También es el tipo que más comúnmente requerirá intervención quirúrgica, y comprende más del 80% de los casos. [2]
Los defectos del tabique ventricular membranosos son más comunes que los defectos del tabique ventricular musculares y son la anomalía cardíaca congénita más común. [3]
Signos y síntomas
La comunicación interventricular suele ser asintomática al nacer y suele manifestarse unas semanas después del nacimiento. [ cita requerida ]
La CIV es un defecto cardíaco congénito acianótico, también conocido como cortocircuito de izquierda a derecha, por lo que no hay signos de cianosis en la etapa inicial. Sin embargo, la CIV no corregida puede aumentar la resistencia pulmonar y provocar la inversión del cortocircuito y la cianosis correspondiente. [ cita requerida ]
- Soplo pansistólico (holosistólico) a lo largo del borde esternal inferior izquierdo (según el tamaño del defecto) +/- frémito palpable (turbulencia palpable del flujo sanguíneo). Los ruidos cardíacos son normales. Los VSD más grandes pueden causar un tirón paraesternal, un latido del ápice desplazado (el latido cardíaco palpable se mueve lateralmente con el tiempo, a medida que el corazón se agranda). Un bebé con un VSD grande no prosperará y se volverá sudoroso y taquipnéico (respirará más rápido) con las tomas. [4]
Los defectos restrictivos del tabique ventricular (defectos más pequeños) se asocian con un soplo más fuerte y un frémito más palpable (soplo de grado IV). Los defectos más grandes pueden eventualmente asociarse con hipertensión pulmonar debido al aumento del flujo sanguíneo. Con el tiempo, esto puede conducir a un síndrome de Eisenmenger: el VSD original que operaba con un cortocircuito de izquierda a derecha, ahora se convierte en un cortocircuito de derecha a izquierda debido al aumento de las presiones en el lecho vascular pulmonar.
Causa
Los VSD congénitos se asocian frecuentemente con otras afecciones congénitas, como el síndrome de Down . [5] La enfermedad cardíaca congénita, en particular los VSD, es la principal causa de muerte en niños con síndrome de Down desde su nacimiento hasta los dos años de edad. [6]
Un VSD también puede formarse unos días después de un infarto de miocardio [7] (ataque cardíaco) debido al desgarro mecánico de la pared septal , antes de que se forme tejido cicatricial , cuando los macrófagos comienzan a remodelar el tejido cardíaco muerto.
Un VSD congénito puede ser resultado de una alteración en la morfogénesis del corazón en sus etapas embrionarias. En la quinta semana de gestación, el corazón sufre múltiples procesos de septación y formación de un asa dextral. Interferir con esto último conduce a un movimiento insuficiente hacia la izquierda del tracto de salida ventricular sobre el canal auriculoventricular , lo que a su vez puede dar lugar a un VSD o, en los casos más extremos, a un ventrículo derecho de doble salida con uno. [8] [9]
Un defecto del tabique ventricular se produce cuando la parte superior del tabique interventricular, que separa los ventrículos derecho e izquierdo del corazón, no se desarrolla por completo. El ventrículo derecho bombea sangre a los pulmones para obtener oxígeno, mientras que el ventrículo izquierdo bombea sangre al resto del cuerpo para proporcionar oxígeno a los tejidos. Un defecto del tabique ventricular produce la mezcla de sangre rica en oxígeno con sangre pobre en oxígeno, lo que aumenta la tensión en el corazón y los pulmones. [10]
Fisiopatología
Durante la contracción ventricular, o sístole, parte de la sangre del ventrículo izquierdo se filtra al ventrículo derecho, pasa a través de los pulmones y vuelve a entrar en el ventrículo izquierdo a través de las venas pulmonares y la aurícula izquierda. Esto tiene dos efectos netos. En primer lugar, el reflujo tortuoso de sangre provoca una sobrecarga de volumen en el ventrículo izquierdo. En segundo lugar, debido a que el ventrículo izquierdo normalmente tiene una presión sistólica mucho más alta (~120 mmHg) que el ventrículo derecho (~20 mmHg), la fuga de sangre al ventrículo derecho eleva la presión y el volumen del ventrículo derecho, lo que causa hipertensión pulmonar con sus síntomas asociados.
En casos graves, la presión arterial pulmonar puede alcanzar niveles que igualan la presión sistémica. Esto invierte el shunt de izquierda a derecha, de modo que la sangre fluye del ventrículo derecho al ventrículo izquierdo, lo que produce cianosis , ya que la sangre no pasa por los pulmones para oxigenarse. [11]
Este efecto es más notorio en pacientes con defectos más grandes, que pueden presentar disnea, mala alimentación y retraso en el crecimiento en la infancia. Los pacientes con defectos más pequeños pueden ser asintomáticos. Existen cuatro defectos septales diferentes, siendo el perimembranoso el más común, el de salida, el auriculoventricular y el muscular, con menor frecuencia. [12]
Diagnóstico

Una CIV puede detectarse mediante auscultación cardíaca . Clásicamente, una CIV causa un soplo holo- o pansistólico patognomónico . La auscultación generalmente se considera suficiente para detectar una CIV significativa. El soplo depende del flujo anormal de sangre desde el ventrículo izquierdo, a través de la CIV, hasta el ventrículo derecho. Si no hay mucha diferencia de presión entre los ventrículos izquierdo y derecho, entonces el flujo de sangre a través de la CIV no será muy grande y la CIV puede estar asintomática. Esta situación ocurre a) en el feto (cuando las presiones ventriculares derecha e izquierda son esencialmente iguales), b) durante un corto tiempo después del nacimiento (antes de que la presión ventricular derecha haya disminuido) y c) como una complicación tardía de la CIV no reparada. La confirmación de la auscultación cardíaca se puede obtener mediante ecografía cardíaca no invasiva ( ecocardiografía ). Para medir con mayor precisión las presiones ventriculares, se puede realizar un cateterismo cardíaco .
Clasificación
Aunque existen varias clasificaciones para la CIV, la clasificación más aceptada y unificada es la del Proyecto de Nomenclatura y Base de Datos de Cirugía Cardíaca Congénita. [13] La clasificación se basa en la ubicación de la CIV en la superficie ventricular derecha del tabique interventricular y es la siguiente:
Múltiple
Tipo 1
El tipo 1 es subaórtico
Tipo 2
- Tipo 2 también conocido como perimembranoso, paramembranoso, conoventricular, defecto del tabique membranoso y subaórtico.
- La variedad más común se encuentra en el 70%.
Tipo 3
Tipo 3 también conocido como entrada (o tipo canal AV).
- Comúnmente asociado con defecto del tabique auriculoventricular , se encuentra en aproximadamente el 5%
Tipo 4
Tipo 4 también conocido como muscular (trabecular)
- Ubicado en el tabique muscular, se encuentra en el 20%. Se puede subclasificar nuevamente según la ubicación en anterior, apical, posterior y media.
Tipo: Gerbode
Tipo: Gerbode también conocido como comunicación del ventrículo izquierdo a la aurícula derecha
- Por ausencia de tabique auriculoventricular.
- Vista anatómica del corazón del ventrículo derecho y la aurícula derecha con ejemplos de defectos del tabique ventricular
- Defecto del tabique ventricular
- La figura A muestra la estructura y el flujo sanguíneo en el interior de un corazón normal. La figura B muestra dos lugares comunes de un defecto del tabique ventricular. El defecto permite que la sangre rica en oxígeno del ventrículo izquierdo se mezcle con la sangre pobre en oxígeno del ventrículo derecho.
Tratamiento

La mayoría de los casos no necesitan tratamiento y se curan durante los primeros años de vida. El tratamiento puede ser conservador o quirúrgico. Los VSD congénitos más pequeños suelen cerrarse por sí solos, a medida que el corazón crece, y en esos casos pueden tratarse de forma conservadora. Algunos casos pueden requerir intervención quirúrgica, es decir, con las siguientes indicaciones:
- Insuficiencia cardíaca congestiva que no responde a los medicamentos
- VSD con estenosis pulmonar
- CIV grande con hipertensión pulmonar
- CIV con insuficiencia aórtica
Para el procedimiento quirúrgico se requiere una máquina de circulación extracorpórea y se realiza una esternotomía media . Los procedimientos endovasculares percutáneos son menos invasivos y se pueden realizar con el corazón latiendo, pero solo son adecuados para ciertos pacientes. La reparación de la mayoría de los VSD es complicada por el hecho de que el sistema de conducción del corazón se encuentra en las inmediaciones.
El defecto del tabique ventricular en los bebés se trata inicialmente médicamente con glucósidos cardíacos (p. ej., digoxina 10-20 μg/kg por día), diuréticos de asa (p. ej., furosemida 1-3 mg/kg por día) e inhibidores de la ECA (p. ej., captopril 0,5-2 mg/kg por día).
Cierre transcatéter
Se puede utilizar un dispositivo, conocido como oclusor muscular de VSD Amplatzer, para cerrar ciertas comunicaciones interventriculares. [14] Se aprobó inicialmente en 2009. [14] Parece funcionar bien y ser seguro. [14] El costo también es menor que la cirugía a corazón abierto. [14] El dispositivo se coloca a través de una pequeña incisión en la ingle. [15]
Se ha demostrado que el oclusor septal Amplatzer cierra por completo el defecto ventricular en las 24 horas siguientes a su colocación. [16] Tiene un riesgo bajo de embolia después de la implantación. [17] Se ha demostrado que hay regurgitación de la válvula tricúspide después del procedimiento que podría deberse al disco ventricular derecho. [16] Ha habido algunos informes de que el oclusor septal Amplatzer puede causar una erosión potencialmente mortal del tejido dentro del corazón. [18] Esto ocurre en el uno por ciento de las personas a las que se les implanta el dispositivo y requiere una cirugía a corazón abierto inmediata. [18] Esta erosión se produce debido a un tamaño inadecuado del dispositivo, lo que hace que sea demasiado grande para el defecto, lo que provoca el roce del tejido septal y erosión. [18]
Cirugía
El cierre quirúrgico de un VSD perimembranoso se realiza en caso de derivación cardiopulmonar con paro isquémico. Los pacientes suelen ser enfriados a 28 grados. El cierre percutáneo de estos defectos con dispositivos rara vez se realiza en los Estados Unidos debido a la incidencia reportada de bloqueo cardíaco completo de aparición temprana y tardía después del cierre con dispositivo, presumiblemente secundario a un traumatismo del dispositivo en el nodo AV.
La exposición quirúrgica se logra a través de la aurícula derecha. Se retrae o se realiza una incisión en el tabique de la válvula tricúspide para exponer los márgenes del defecto.
Hay varios materiales de parche disponibles, incluido pericardio nativo, pericardio bovino, PTFE ( Gore-Tex o Impra) o Dacron.
Las técnicas de sutura incluyen suturas de colchonero horizontales con almohadillas y sutura continua de polipropileno.
Es necesario prestar especial atención para evitar lesionar el sistema de conducción ubicado en el lado ventricular izquierdo del tabique interventricular cerca del músculo papilar del cono. Se debe tener cuidado para evitar lesionar la válvula aórtica con suturas.
Una vez finalizada la reparación, se desairea ampliamente el corazón ventilando sangre a través del sitio de cardioplejía aórtica e infundiendo dióxido de carbono en el campo operatorio para desplazar el aire.
La ecocardiografía transesofágica intraoperatoria se utiliza para confirmar el cierre seguro de la CIV, el funcionamiento normal de las válvulas aórtica y tricúspide, la buena función ventricular y la eliminación de todo el aire del lado izquierdo del corazón.
Se cierran el esternón, la fascia y la piel, con la posible colocación de un catéter de infusión de anestesia local debajo de la fascia, para mejorar el control del dolor posoperatorio.
El cierre de múltiples CIV musculares es un desafío; lograr un cierre completo se puede lograr con el uso del tinte de fluoresceína . [19]
Epidemiología
Las CIV son las anomalías cardíacas congénitas más frecuentes. Se encuentran en el 30-60% de todos los recién nacidos con un defecto cardíaco congénito, o aproximadamente en 2-6 por cada 1000 nacimientos. Durante la formación del corazón, cuando el corazón comienza su vida como un tubo hueco, comienza a dividirse, formando tabiques. Si esto no ocurre correctamente, puede provocar que quede una abertura dentro del tabique ventricular. Es discutible si todos estos defectos son verdaderos defectos cardíacos, o si algunos de ellos son fenómenos normales, ya que la mayoría de las CIV trabeculares se cierran espontáneamente. [20] Estudios prospectivos dan una prevalencia de 2-5 por cada 100 nacimientos de CIV trabeculares que se cierran poco después del nacimiento en el 80-90% de los casos. [21] [22]
Personajes famosos que tuvieron comunicación interventricular
- Madhubala (1933–69), actriz india. Murió a los 36 años. [23]
- XXXTentacion (1998–2018), rapera y cantautora estadounidense. Asesinada a los 20 años [24]
- Asa Hartford (nacido en 1950), todavía vivo
Véase también
- Defecto del tabique auricular
- Defecto del tabique auriculoventricular
- Gasto cardíaco
- Enfermedad cardíaca congénita
- Sonidos del corazón
- Hipertensión pulmonar
Referencias
- ^ Taylor, Michael D (2 de febrero de 2019). "Defecto del tabique ventricular muscular". EMedicine . Medscape.
- ^ Waight, David J.; Bacha, Emile A.; Kahana, Madelyn; Cao, Qi-Ling; Heitschmidt, Mary; Hijazi, Ziyad M. (marzo de 2002). "Terapia con catéter de defectos del tabique ventricular en forma de queso suizo utilizando el oclusor muscular VSD de Amplatzer". Cateterismo e intervenciones cardiovasculares . 55 (3): 355–361. doi :10.1002/ccd.10124. PMID 11870941. S2CID 23602868.
- ^ Hoffman, JI; Kaplan, S (2002). "La incidencia de la cardiopatía congénita". Revista del Colegio Americano de Cardiología . 39 (12): 1890–900. doi : 10.1016/S0735-1097(02)01886-7 . PMID 12084585.
- ^ Cameron P. et al: Libro de texto de medicina de emergencia pediátrica. p116-117 [Elsevier, 2006]
- ^ Wells, GL; Barker, SE; Finley, SC; Colvin, EV; Finley, WH (1994). "Cardiopatía congénita en lactantes con síndrome de Down". Southern Medical Journal . 87 (7): 724–7. doi :10.1097/00007611-199407000-00010. PMID 8023205. S2CID 31622875.
- ^ Benhaourech, S; Dirgil, A; Hammiri, AE (2016). "Cardiopatía congénita y síndrome de Down: diversos aspectos de una asociación confirmada". Cardiovasc J Afr . 27 (5): 287–290. doi :10.5830/CVJA-2016-019. PMC 5370349 . PMID 27805241.
- ^ Schumacher, Kurt R. "Defecto del tabique ventricular". NIH y Biblioteca Nacional de Medicina de EE. UU . . MedlinePlus.
- ^ Lamers, Wouter H.; Moorman, Antoon FM (26 de julio de 2002). "Septación cardíaca: una contribución tardía del miocardio primario embrionario a la morfogénesis cardíaca". Investigación de la circulación . 91 (2): 93–103. doi : 10.1161/01.RES.0000027135.63141.89 . PMID 12142341.
- ^ Gittenberger-de Groot, Adriana C.; Bartelings, Margot M.; Deruiter, Marco C.; Poelmann, Robert E. (1 de febrero de 2005). "Fundamentos del desarrollo cardíaco para la comprensión de las malformaciones cardíacas congénitas". Investigación pediátrica . 57 (2): 170. doi : 10.1203/01.PDR.0000148710.69159.61 . PMID: 15611355.
- ^ "Defectos cardíacos congénitos: ¿qué son los defectos cardíacos congénitos? | NHLBI, NIH". 24 de marzo de 2022.
- ^ Kumar y Clark 2009
- ^ Mancini, Mary C (20 de junio de 2018). "Cirugía del defecto del tabique ventricular en el paciente pediátrico". EMedicine . Medscape.
- ^ Jacobs, Jeffrey; Mavroudis, Constantine (marzo de 2000). "Proyecto de nomenclatura y base de datos de cirugía cardíaca congénita: defecto del tabique ventricular". Ann Thorac Surg . 69 (3): 25–35. doi :10.1016/S0003-4975(99)01270-9. PMID 10798413.
- ^ abcd Fu, YC (febrero de 2011). "Cierre del defecto septal ventricular muscular mediante dispositivo transcatéter". Pediatría y neonatología . 52 (1): 3–4. doi : 10.1016/j.pedneo.2010.12.012 . PMID 21385649.
- ^ Oclusor septal Amplatzer. (2013) Administración de Alimentos y Medicamentos de los Estados Unidos . Recuperado el 26 de febrero de 2014, de https://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/DeviceApprovalsandClearances/Recently-ApprovedDevices/ucm083978.htm
- ^ ab Szkutnik; et al. (2007). "Uso del oclusor de defecto septal ventricular muscular Amplatzer para el cierre de defectos septales ventriculares perimembranosos". Heart . 93 (3): 355–358. doi :10.1136/hrt.2006.096321. PMC 1861424 . PMID 16980519.
- ^ Fernando Rajeev; et al. (2013). "Cierre del conducto arterioso persistente mediante un dispositivo de cierre de comunicación interventricular Amplatzer". Cardiología experimental y clínica . 18 (1): e50–e54.
- ^ abc Eventos de erosión graves poco frecuentes asociados con el oclusor del tabique auricular (ASO) Amplatzer de St. Jude. (17 de octubre de 2013). Administración de Alimentos y Medicamentos de los Estados Unidos . Consultado el 26 de febrero de 2014 en https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm371145.htm
- ^ Mathew, Thomas (2014). "Uso de colorante de fluoresceína para identificar defectos residuales". Ann Thorac Surg . 97 (1): e27-8. doi :10.1016/j.athoracsur.2013.10.059. ISSN 0003-4975. PMID 24384220.
- ^ Meberg, A; Otterstad, JE; Frøland, G; Søarland, S; Nitter-Hauge, S (1994). "Aumento de la incidencia de defectos del tabique ventricular causados por una tasa de detección mejorada". Acta Paediatrica . 83 (6): 653–657. doi :10.1111/j.1651-2227.1994.tb13102.x. PMID 7919765. S2CID 30244380.
- ^ Hiraishi, S; Agata, Y; Nowatari, M; Oguchi, K; Misawa, H; Hirota, H; Fujino, N; Horiguchi, Y; Yashiro, K; Nakae, S (marzo de 1992). "Incidencia y curso natural del defecto septal ventricular trabecular: estudio de ecocardiografía bidimensional y de imágenes de flujo Doppler color". The Journal of Pediatrics . 120 (3): 409–15. doi :10.1016/s0022-3476(05)80906-0. PMID 1538287.
- ^ Roguin, Nathan; Du, Zhong-Dong; Barak, Mila; Nasser, Nadim; Hershkowitz, Sylvia; Milgram, Elliot (15 de noviembre de 1995). "Alta prevalencia de defecto septal ventricular muscular en neonatos". Journal of the American College of Cardiology . 26 (6): 1545–1548. doi : 10.1016/0735-1097(95)00358-4 . PMID 7594083.
- ^ "El síndrome del bebé azul". Deccan Herald . 25 de septiembre de 2015 . Consultado el 15 de julio de 2022 .
- ^ Reiss, Jonathan (9 de junio de 2020). ¡Mírame!. Hachette Books. pág. 1. ISBN 978-0-306-84541-3. Recuperado el 28 de octubre de 2022 .