Carcinoma seroso de alto grado
| Carcinoma seroso de alto grado | |
|---|---|
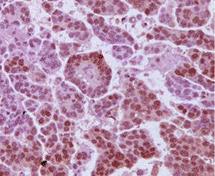 | |
| Micrografía inmunohistoquímica de receptores de andrógenos en una muestra de tumor de células madre de gran tamaño |
El carcinoma seroso de alto grado ( HGSC ) es un tipo de tumor que surge de la capa epitelial serosa en la cavidad abdominopélvica y se encuentra principalmente en el ovario . Los HGSC constituyen la mayoría de los casos de cáncer de ovario [1] y tienen las tasas de supervivencia más bajas. [2] El HGSC es distinto del carcinoma seroso de bajo grado (LGSC) que surge del tejido ovárico, es menos agresivo y está presente en el cáncer de ovario en estadio I, donde los tumores se localizan en el ovario.
Aunque originalmente se pensaba que surgía de la capa de células epiteliales escamosas que recubre el ovario, ahora se cree que las HGSC se originan en el epitelio de las trompas de Falopio. Las HGSC son mucho más invasivas que las LGSC y tienen una tasa de mortalidad más alta, aunque son más sensibles a la quimioterapia basada en platino [3] [4], posiblemente debido a su rápida tasa de crecimiento. En casos raros, las HGSC pueden desarrollarse a partir de LGSC [5] , pero generalmente los dos tipos surgen independientemente uno del otro.
Factores de riesgo
Factores de riesgo ambientales
La teoría de la " ovulación incesante " está sugerida por la fuerte correlación entre el número de ciclos ovulatorios de un individuo y su riesgo de cáncer de ovario. [6]
Esta tendencia se refleja en los efectos protectores del embarazo, la paridad y la lactancia materna contra el cáncer de ovario, [7] [8] y hallazgos similares en estudios epidemiológicos que han indicado una reducción del riesgo asociado con el uso de píldoras anticonceptivas orales. [9] [6]
Se acepta que la ovulación es la causa de los quistes de inclusión corticales ováricos, las lesiones precursoras de los carcinomas serosos, y se cree que una menor cantidad de estos quistes de inclusión corticales es el mecanismo por el cual la reducción de las ovulaciones a lo largo de la vida puede reducir el riesgo de desarrollar HGSC. [10]
Por el contrario, se encontró una asociación temporal entre la terapia hormonal menopáusica y la incidencia de HGSC [11] , y se demostró que el síndrome de ovario poliquístico (SOP) contribuye a duplicar el riesgo de cáncer de ovario. [12]
La endometriosis puede aumentar el riesgo de otros subtipos de cáncer de ovario, pero no está asociada con el HGSC. [13]
Factores de riesgo genéticos
Más del 20% de los tumores de cáncer de ovario tienen un origen hereditario . La mayoría de ellos presentan mutaciones en los genes supresores de tumores BRCA , que tienden a dar lugar al HGSC. [14] Una mutación en BRCA1 o BRCA2 puede conferir un riesgo de cáncer de ovario a lo largo de la vida del 40-50% y del 10-20% respectivamente, [15] y las mutaciones en BRCA2 están fuertemente asociadas con mejores resultados clínicos.
Se cree que un patrón específico de expresión de la proteína tumoral 53 ( TP53 ) en el epitelio de las trompas de Falopio –la "firma p53"- es un marcador precursor de HGSC. Los ratones TP53-/- (en los que se ha eliminado el gen TP53) no desarrollan carcinomas ováricos. [16] Sin embargo, se encontraron mutaciones de TP53 en el 96% de los casos de HGSC. [17] Por lo tanto, una expresión anormal local de TP53 puede ser indicativa de HGSC. [18] En las mujeres, los HGSC pélvicos muestran una ausencia completa de expresión de P53 o una sobreexpresión, lo que sugiere que cualquier aberración de P53 conduce al desarrollo de un tumor. [19] Además, la sobreexpresión de TP53 se asocia con un mejor resultado clínico, mientras que la ausencia de la proteína p53 se relaciona con un mayor riesgo de recurrencia del tumor HGSC. [19]
Un modelo de ratón reciente sugiere que una mutación de p53 puede inducir el HGSC que surge del ovario en lugar de la trompa de Falopio. [20]
Fisiopatología
Origen celular
Los HGSC se distinguen además de los LGSC por la nomenclatura de tumor ovárico de "tipo I/II"; [21] el tipo I se refiere a los tipos de tumores (por ejemplo, LGSC) en los que se han caracterizado lesiones precursoras dentro del ovario, y el tipo II se refiere a los tipos de tumores (por ejemplo, HGSC) sin asociación de dichas lesiones, tumores que se entiende que se desarrollan de novo a partir del epitelio de la superficie de las trompas y/o del ovario. Esta clasificación tiene más relevancia para la investigación que para la práctica clínica. [22]
La membrana serosa es un tipo particular de epitelio secretor que cubre los órganos en las cavidades corporales y secreta líquido seroso para reducir la fricción del movimiento muscular. La membrana serosa que recubre la cavidad abdominopélvica se llama peritoneo ; la que recubre el corazón y el mediastino es el pericardio , y la que recubre la cavidad torácica y los pulmones es la pleura . Técnicamente, un "carcinoma seroso" puede aparecer en cualquier parte de estas membranas, pero el carcinoma seroso de alto grado generalmente se limita al área peritoneal.
Si bien hasta hace poco se pensaba que los HGSC surgían de la simple diferenciación de los quistes de inclusión corticales (CIC) del epitelio superficial del ovario (OSE), ahora se entiende que el origen celular de los HGSC es mucho más complejo y ha salido a la luz evidencia de otros sitios de origen, tanto intra como extraováricos.
| Tejido | Evidencia de su papel como célula de origen de las HGSC |
|---|---|
| Ovario | Secundario:
Oposición:
|
| Epitelio celómico | Secundario: 'Hipótesis celómica' [24]
Oposición:
|
| trompas de Falopio | Secundario:
Oposición:
|
| Epitelio mülleriano extrauterino (EUME) | Todos los epitelios del tracto genital femenino (trompas de Falopio, endometrio , endocérvix , ectocérvix y parte superior de la vagina) derivan de los conductos de Müller embrionarios. El epitelio de Müller extrauterino incluye el extremo distal de las trompas de Falopio (las fimbrias) y casos de endosalpingiosis , endometriosis y endocervicosis. Secundario:
Oposición:
|
| Límite entre el ovario y la trompa de Falopio (zona de transición) | Secundario:
Oposición:
|
El origen mülleriano común de las trompas de Falopio, el útero, el cuello uterino y la parte superior de la vagina ha dado lugar a la propuesta de que el carcinoma seroso peritoneal de alto grado es un espectro de una única enfermedad. [22]
Solo se pueden desarrollar modelos animales relevantes de células madre dendríticas cuando se comprende adecuadamente el origen celular. Sin embargo, como las células madre dendríticas tienden a tener el mismo comportamiento clínico, independientemente de su origen celular primario, determinar el origen celular es menos importante para el tratamiento clínico, pero puede ser relevante cuando se buscan biomarcadores.
El proceso específico por el cual surge un HGSC puede estar relacionado con el estado de mutación de BRCA del individuo, [32] [36] así como con el estado de mutación de p53. [20]
Un artículo de 2007 describe el proceso de determinación de la célula de origen como “El origen del tumor se asigna típicamente al órgano que presenta la masa tumoral dominante. La única excepción es el peritoneo, que se clasifica como sitio primario solo si no se encuentra un origen candidato en el endometrio, la trompa o el ovario”. [37]
Se reconoce que el HGSC puede tener orígenes primarios variables y complejos, pero comprender y determinar esto brindará información sobre su patogénesis.

Patogenesia
Suponiendo un origen fimbrial, como se observa en la mayoría de los casos de HGSC, [28] la comprensión actual de la génesis de HGSC sugiere un proceso por el cual las células fimbriales STIC se implantan en el ovario como quistes de inclusión cortical a través del sitio de ruptura de la ovulación.
Para explicar los casos en los que no hay afectación de STIC, también es posible la endosalpingiosis o la metaplasia de novo de inclusiones del epitelio de la superficie ovárica. Una ocurrencia mucho más rara es la diferenciación de HGSC de LGSC. [5]
Diagnóstico
Los síntomas incluyen hinchazón persistente , sangrado posmenopáusico y/o pérdida de apetito. [38]
La ecografía transvaginal, así como el análisis del nivel del marcador de cáncer CA125, se utilizan a menudo para determinar la posible malignidad de masas pélvicas sospechosas. [39]
La estadificación quirúrgica es el procedimiento mediante el cual se examinan la cavidad abdominal y los ganglios linfáticos en busca de tejido maligno, generalmente mediante laparoscopia . Se pueden tomar biopsias de tejido para su posterior análisis. No es hasta esta etapa de análisis histológico que se puede realizar el diagnóstico real de HGSC. [39]
Si se observa que las glándulas se fusionan con papilas extensas e intrincadas que presentan penachos epiteliales con nidos sólidos rodeados por un espacio junto a espacios irregulares en forma de hendidura, entonces se sospecha un carcinoma seroso.
Distinción entre LGSC y HGSC: [40]
- La necrosis es común en los HGSC y está ausente en los LGSC, al igual que las células tumorales gigantes (multinucleadas o mononucleares).
- Los cuerpos de psamoma son más frecuentes en el carcinoma seroso de bajo grado.
- Se evalúa la expresión de Tp53 para detectar mutaciones, sobreexpresión o ausencia, características comunes de los carcinomas serosos de alto grado.
- Las LGSC generalmente se limitan a patrones de crecimiento micropapilar, mientras que las HGSC pueden exhibir patrones mixtos.
No siempre es posible distinguir el carcinoma endometrioide de alto grado del HGSC. [40]
La progresión del HGSC también se puede determinar examinando el perfil de expresión de cadherina . [41]
Cribado
Como el cáncer de ovario rara vez presenta síntomas hasta que se encuentra en una etapa avanzada, [42] la detección preventiva regular es una herramienta particularmente importante para evitar la etapa tardía en la que se presentan la mayoría de las pacientes. Sin embargo, un estudio estadounidense de 2011 descubrió que la ecografía transvaginal y la detección del marcador de cáncer CA125 no reducían la mortalidad por cáncer de ovario. [43] Por el contrario, un estudio más reciente del Reino Unido descubrió que hasta el 20% de las muertes por cáncer de ovario podrían prevenirse mediante la realización anual de estos procedimientos. [44]
Prevención
Hasta hace poco, la prevención para una persona considerada en riesgo de padecer HGSC consistía en la extirpación (bilateral o unilateral) tanto del ovario como de la trompa de Falopio (salpingooforectomía ) .
Debido a los problemas hormonales e incluso de morbilidad que genera la extirpación de los ovarios y a la creciente evidencia del papel de la patogénesis de las HGSC de las trompas de Falopio, la optimización de este procedimiento ha sido extirpar solo la(s) trompa(s) de Falopio (salpingectomía) y dejar los ovarios hasta la edad de la menopausia [45] [46] , aunque los críticos de esta medida sostienen que un suministro reducido de sangre a los ovarios puede inducir una menopausia prematura de todos modos. [47]
La salpingooforectomía profiláctica se realiza con frecuencia en portadores de mutaciones BRCA1 o BRCA2, [48] aunque los beneficios conferidos por este procedimiento pueden variar dependiendo de la mutación específica. [49]
La ligadura de trompas es un tratamiento profiláctico menos invasivo que ha demostrado reducir significativamente el riesgo de HGSC. [50]
Tratamiento
La cirugía citorreductora " debulking " se puede realizar antes del tratamiento de quimioterapia para disminuir la masa física del tumor y así reducir el número de ciclos de quimioterapia necesarios. [39] La presentación avanzada típica, así como la propagación extraovárica observada en HGSC, pueden requerir procedimientos de bulking agresivos. [51] En algunos casos se realizará una histerectomía abdominal total , en otros casos en los que la paciente tiene la intención de tener hijos se realiza en su lugar una salpingooforectomía.
La quimioterapia típica consiste en seis ciclos de quimioterapia adyuvante a base de platino administrada por vía intraperitoneal con agentes como el carboplatino . [39] Las mediciones de los niveles de CA125 en sangre se utilizan para determinar la respuesta del paciente al tratamiento.
Entre el 20% y el 30% de los pacientes recaen dentro de los seis meses posteriores al tratamiento. [52]
Los inhibidores de la poli ADP ribosa polimerasa (PARP) son otro posible tratamiento, siendo los portadores de mutaciones BRCA1/2 los más sensibles [53] [54]
Epidemiología
Un estudio de las tasas de incidencia en los EE. UU. entre 1992 y 1999 encontró que la tasa de incidencia específica por edad para HGSC se duplica cada 10 años hasta los 55 años, donde se estabiliza en aproximadamente 20 casos por cada 100.000 mujeres, antes de caer drásticamente después de los 75 años. [55]
Las tasas de incidencia de cáncer de ovario son bajas en el este de Asia [56] y más altas en Europa, Estados Unidos y Australia/Nueva Zelanda. [57]
Desde 1975, las tasas de supervivencia del cáncer de ovario han mejorado de forma constante, con una disminución media del 51% en 2006 del riesgo de muerte por cáncer de ovario en un tumor en etapa avanzada. [58] El aumento se ha debido principalmente a la prolongación exitosa de la expectativa de vida de las pacientes afectadas más que a una mejora en las tasas de curación.
Existe una disparidad racial entre las mujeres negras y blancas en los EE. UU., donde las mujeres negras experimentan un mayor riesgo de mortalidad por cáncer de ovario. [58] [59]
Referencias
- ^ Shih, Ie-Ming; Kurman, Robert J. (1 de mayo de 2004). "Tumorigénesis ovárica: un modelo propuesto basado en análisis genético morfológico y molecular". The American Journal of Pathology . 164 (5): 1511–1518. doi :10.1016/S0002-9440(10)63708-X. PMC 1615664 . PMID 15111296.
- ^ Olivier, Rhode Island; van Beurden, M.; Lubsen, M. a. DO.; Rookus, MA; Mooij, TM; van de Vijver, MJ; van't Veer, LJ (16 de marzo de 2004). "Resultado clínico de la ooforectomía profiláctica en portadores de mutaciones BRCA1 / BRCA2 y eventos durante el seguimiento". Revista británica de cáncer . 90 (8): 1492-1497. doi : 10.1038/sj.bjc.6601692. ISSN 0007-0920. PMC 2409718 . PMID 15083174.
- ^ Santillan, A.; Kim, Yw; Zahurak, Ml; Gardner, Gj; Giuntoli, Rl; Shih, Im; Bristow, Re (1 de mayo de 2007). "Diferencias del ensayo de quimiorresistencia entre el carcinoma ovárico seroso de bajo grado/micropapilar invasivo y el carcinoma ovárico seroso de alto grado". Revista Internacional de Cáncer Ginecológico . 17 (3): 601–606. doi :10.1111/j.1525-1438.2007.00820.x. ISSN 1525-1438. PMID 17504374. S2CID 21579941.
- ^ Schmeler, Kathleen M.; Sun, Charlotte C.; Bodurka, Diane C.; Deavers, Michael T.; Malpica, Anais; Coleman, Robert L.; Ramirez, Pedro T.; Gershenson, David M. (1 de marzo de 2008). "Quimioterapia neoadyuvante para carcinoma seroso de bajo grado de ovario o peritoneo". Oncología ginecológica . 108 (3): 510–514. doi :10.1016/j.ygyno.2007.11.013. ISSN 1095-6859. PMID 18155273.
- ^ ab Dehari, Reiko; Kurman, Robert J.; Logani, Sanjay; Shih, Ie-Ming (1 de julio de 2007). "El desarrollo de carcinoma seroso de alto grado a partir de tumores serosos proliferativos atípicos (borderline) y carcinoma seroso micropapilar de bajo grado: un análisis genético morfológico y molecular". The American Journal of Surgical Pathology . 31 (7): 1007–1012. doi :10.1097/PAS.0b013e31802cbbe9. ISSN 0147-5185. PMID 17592266. S2CID 37905442.
- ^ ab Fathalla, MF (1 de enero de 2013). "Ovulación incesante y cáncer de ovario: una hipótesis revisada". Facts, Views & Vision in ObGyn . 5 (4): 292–297. ISSN 2032-0418. PMC 3987381 . PMID 24753957.
- ^ Risch, HA; Marrett, LD; Howe, GR (1994-10-01). "Paridad, anticoncepción, infertilidad y riesgo de cáncer epitelial de ovario". American Journal of Epidemiology . 140 (7): 585–597. doi :10.1093/oxfordjournals.aje.a117296. ISSN 0002-9262. PMID 7942759.
- ^ Gwinn, ML; Lee, NC; Rhodes, PH; Layde, PM; Rubin, GL (1990-01-01). "Embarazo, lactancia materna y anticonceptivos orales y el riesgo de cáncer epitelial de ovario". Journal of Clinical Epidemiology . 43 (6): 559–568. doi :10.1016/0895-4356(90)90160-q. ISSN 0895-4356. PMID 2348208.
- ^ ab Kurman, RJ (1 de diciembre de 2013). "Origen y patogenia molecular del carcinoma seroso de alto grado de ovario". Anales de Oncología . 24 (Supl. 10): x16–21. doi : 10.1093/annonc/mdt463 . ISSN 1569-8041. PMID 24265397.
- ^ DastranjTabrizi, Ali; MostafaGharabaghi, Parvin; SheikhzadehHesari, Farzam; Sadeghi, Liela; Zamanvandi, Sharareh; Sarbakhsh, Parvin; Ghojazadeh, Morteza (1 de enero de 2016). "Impacto y papel mecanicista de las píldoras anticonceptivas orales en el número y tipo epitelial de quistes de inclusión corticales ováricos; un estudio clinicopatológico e inmunohistoquímico". Patología diagnóstica . 11 : 30. doi : 10.1186/s13000-016-0482-6 . ISSN 1746-1596. PMC 4802821 . PMID 27000861.
- ^ Yang, Hannah P.; Anderson, William F.; Rosenberg, Philip S.; Trabert, Britton; Gierach, Gretchen L.; Wentzensen, Nicolas; Cronin, Kathleen A.; Sherman, Mark E. (10 de junio de 2013). "Tendencias de la incidencia del cáncer de ovario en relación con los patrones cambiantes del uso de la terapia hormonal menopáusica en los Estados Unidos". Journal of Clinical Oncology . 31 (17): 2146–2151. doi :10.1200/JCO.2012.45.5758. ISSN 1527-7755. PMC 3731982 . PMID 23650423.
- ^ Schildkraut, JM; Schwingl, PJ; Bastos, E.; Evanoff, A.; Hughes, C. (1996-10-01). "Riesgo de cáncer de ovario epitelial entre mujeres con síndrome de ovario poliquístico". Obstetricia y ginecología . 88 (4 Pt 1): 554–559. doi :10.1016/0029-7844(96)00226-8. ISSN 0029-7844. PMID 8841217. S2CID 22995413.
- ^ Pearce, Celeste Leigh; Templeman, Claire; Rossing, Mary Anne; Lee, Alice; Near, Aimee M.; Webb, Penelope M.; Nagle, Christina M.; Doherty, Jennifer A.; Cushing-Haugen, Kara L. (1 de abril de 2012). "Asociación entre la endometriosis y el riesgo de subtipos histológicos de cáncer de ovario: un análisis agrupado de estudios de casos y controles". The Lancet. Oncología . 13 (4): 385–394. doi :10.1016/S1470-2045(11)70404-1. ISSN 1474-5488. PMC 3664011 . PMID 22361336.
- ^ Lanza, Ángela; Tomasello, Chiara; Razzaboni, Elisabetta; Contu, Giannina; Grandi, Giovanni; Cagnacci, Angelo; Schilder, Russell J.; Cortesi, Laura (1 de enero de 2015). "Cáncer de ovario hereditario: no sólo genes BRCA 1 y 2". Investigación BioMed Internacional . 2015 : 341723. doi : 10.1155/2015/341723 . ISSN 2314-6141. PMC 4449870 . PMID 26075229.
- ^ Liu, Guoyan; Yang, Da; Sun, Yan; Shmulevich, Ilya; Xue, Fengxia; Sood, Anil K.; Zhang, Wei (1 de octubre de 2012). "Diferente impacto clínico de las mutaciones BRCA1 y BRCA2 en el cáncer de ovario seroso". Farmacogenómica . 13 (13): 1523–1535. doi :10.2217/pgs.12.137. ISSN 1744-8042. PMC 3603383 . PMID 23057551.
- ^ Liu, Ying; Yen, Hai-Yun; Austria, Theresa; Pettersson, Jonas; Peti-Peterdi, Janos; Maxson, Robert; Widschwendter, Martin; Dubeau, Louis (1 de octubre de 2015). "Un modelo de ratón que reproduce las vías de desarrollo y la especificidad del sitio de los cánceres asociados con el estado de portador de la mutación BRCA1 humana". eBioMedicine . 2 (10): 1318–1330. doi :10.1016/j.ebiom.2015.08.034. ISSN 2352-3964. PMC 4634618 . PMID 26629527.
- ^ Cancer Genome Atlas Research Network (30 de junio de 2011). "Análisis genómico integrado del carcinoma ovárico". Nature . 474 (7353): 609–615. doi :10.1038/nature10166. ISSN 1476-4687. PMC 3163504 . PMID 21720365.
- ^ Ahmed, Ahmed Ashour; Etemadmoghadam, Dariush; Temple, Jillian; Lynch, Andy G.; Riad, Mohamed; Sharma, Raghwa; Stewart, Colin; Fereday, Sian; Caldas, Carlos (1 de mayo de 2010). "Las mutaciones impulsoras en TP53 son ubicuas en el carcinoma seroso de alto grado del ovario". Revista de patología . 221 (1): 49–56. doi :10.1002/path.2696. ISSN 1096-9896. PMC 3262968 . PMID 20229506.
- ^ ab Köbel, Martin; Reuss, Alexander; du Bois, Andreas; Kommoss, Stefan; Kommoss, Friedrich; Gao, Dongxia; Kalloger, Steve E.; Huntsman, David G.; Gilks, C. Blake (1 de octubre de 2010). "El valor biológico y clínico de la expresión de p53 en carcinomas serosos pélvicos de alto grado". The Journal of Pathology . 222 (2): 191–198. doi :10.1002/path.2744. ISSN 1096-9896. PMID 20629008. S2CID 35591123.
- ^ abcd Kim, Jaeyeon; Coffey, Donna M.; Ma, Lang; Matzuk, Martin M. (1 de junio de 2015). "El ovario es un sitio alternativo de origen para el cáncer de ovario seroso de alto grado en ratones". Endocrinología . 156 (6): 1975–1981. doi :10.1210/en.2014-1977. ISSN 1945-7170. PMC 5393339 . PMID 25815421.
- ^ Koshiyama, Masafumi; Matsumura, Noriomi; Konishi, Ikuo (1 de enero de 2014). "Conceptos recientes de carcinogénesis ovárica: tipo I y tipo II". BioMed Research International . 2014 : 934261. doi : 10.1155/2014/934261 . ISSN 2314-6141. PMC 4017729 . PMID 24868556.
- ^ ab Cobb, Lauren Patterson; Gaillard, Stephanie; Wang, Yihong; Shih, Ie-Ming; Secord, Angeles Alvarez (1 de enero de 2015). "Adenocarcinoma de origen mülleriano: revisión de la patogénesis, la biología molecular y los paradigmas de tratamiento emergentes". Investigación y práctica en oncología ginecológica . 2 : 1. doi : 10.1186/s40661-015-0008-z . ISSN 2053-6844. PMC 4880836. PMID 27231561 .
- ^ Flesken-Nikitin, Andrea; Hwang, Chang-Il; Cheng, Chieh-Yang; Michurina, Tatiana V.; Enikolopov, Grigori; Nikitin, Alexander Yu (14 de marzo de 2013). "El epitelio de la superficie del ovario en el área de unión contiene un nicho de células madre propenso al cáncer". Naturaleza . 495 (7440): 241–245. Código Bib :2013Natur.495..241F. doi : 10.1038/naturaleza11979. ISSN 1476-4687. PMC 3982379 . PMID 23467088.
- ^ abc Dubeau, L.; Drapkin, R. (1 de noviembre de 2013). "Enfoque: los orígenes no ováricos del cáncer de ovario". Anales de Oncología . 24 (Supl. 8): viii28–viii35. doi :10.1093/annonc/mdt308. ISSN 1569-8041. PMC 3805308 . PMID 24131966.
- ^ Folkins, Ann K.; Jarboe, Elke A.; Saleemuddin, Aasia; Lee, Yonghee; Callahan, Michael J.; Drapkin, Ronny; Garber, Judy E.; Muto, Michael G.; Tworoger, Shelley (1 de mayo de 2008). "Un candidato precursor del cáncer seroso pélvico (firma p53) y su prevalencia en ovarios y trompas de Falopio de mujeres con mutaciones BRCA". Oncología ginecológica . 109 (2): 168–173. doi :10.1016/j.ygyno.2008.01.012. ISSN 1095-6859. PMC 2746001 . PMID 18342932.
- ^ ab Ng, Annie; Barker, Nick (1 de octubre de 2015). "Células madre ováricas y fimbriales: biología, nicho y orígenes del cáncer". Nature Reviews Molecular Cell Biology . 16 (10): 625–638. doi :10.1038/nrm4056. ISSN 1471-0080. PMID 26350076. S2CID 205495908.
- ^ Kuhn, Elisabetta; Kurman, Robert J.; Vang, Russell; Sehdev, Ann Smith; Han, Guangming; Soslow, Robert; Wang, Tian-Li; Shih, Ie-Ming (1 de febrero de 2012). "Mutaciones de TP53 en carcinoma intraepitelial tubárico seroso y carcinoma seroso pélvico de alto grado concurrente: evidencia que respalda la relación clonal de las dos lesiones". The Journal of Pathology . 226 (3): 421–426. doi :10.1002/path.3023. ISSN 1096-9896. PMC 4782784 . PMID 21990067.
- ^ ab Gilbert, Lucy; Basso, Olga; Sampalis, John; Karp, Igor; Martins, Claudia; Feng, Jing; Piedimonte, Sabrina; Quintal, Louise; Ramanakumar, Agnihotram V. (1 de marzo de 2012). "Evaluación de mujeres sintomáticas para el diagnóstico temprano de cáncer de ovario: resultados del proyecto piloto prospectivo DOvE". The Lancet. Oncología . 13 (3): 285–291. doi :10.1016/S1470-2045(11)70333-3. ISSN 1474-5488. PMID 22257524.
- ^ Jazaeri, Amir A.; Bryant, Jennifer L.; Park, Hong; Li, Hui; Dahiya, Neetu; Stoler, Mark H.; Ferriss, James Stuart; Dutta, Anindya (1 de octubre de 2011). "Requerimientos moleculares para la transformación de células epiteliales de las trompas de Falopio en carcinoma seroso". Neoplasia . 13 (10): 899–911. doi :10.1593/neo.11138. ISSN 1476-5586. PMC 3201567 . PMID 22028616.
- ^ Saleemuddin, Aasia; Folkins, Ann K.; Garrett, Leslie; Garber, Judy; Muto, Michael G.; Crum, Christopher P.; Tworoger, Shelley (1 de noviembre de 2008). "Factores de riesgo de un precursor seroso del cáncer ("firma p53") en mujeres con mutaciones heredadas del gen BRCA". Oncología ginecológica . 111 (2): 226–232. doi :10.1016/j.ygyno.2008.07.018. ISSN 1095-6859. PMC 2613977 . PMID 18718648.
- ^ Levanon, K.; Ng, V.; Piao, HY; Zhang, Yi; Chang, MC; Roh, MH; Kindelberger, DW; Hirsch, MS; Crum, CP (25 de febrero de 2010). "Cultivos primarios ex vivo de epitelio de trompa de Falopio humano como modelo para la carcinogénesis ovárica serosa". Oncogene . 29 (8): 1103–1113. doi :10.1038/onc.2009.402. ISSN 1476-5594. PMC 2829112 . PMID 19935705.
- ^ ab Perets, Ruth; Wyant, Gregory A.; Muto, Katherine W.; Bijron, Jonathan G.; Poole, Barish B.; Chin, Kenneth T.; Chen, Jin Yun H.; Ohman, Anders W.; Stepule, Corey D. (9 de diciembre de 2013). "La transformación del epitelio secretor de las trompas de Falopio conduce a cáncer de ovario seroso de alto grado en modelos Brca;Tp53;Pten". Cancer Cell . 24 (6): 751–765. doi :10.1016/j.ccr.2013.10.013. ISSN 1878-3686. PMC 3917315 . PMID 24332043.
- ^ Dubeau, Louis (1 de febrero de 2015). "Patogénesis del cáncer epitelial mülleriano extrauterino seroso e implicaciones terapéuticas". Investigación oncológica traslacional . 4 (1): 3–13. doi :10.3978/j.issn.2218-676X.2015.01.06. ISSN 2218-676X. PMC 4643277 . PMID 26568913.
- ^ Esselen, Katharine; Terry, Kathryn (2016). "Endosalpingiosis: ¿Más que un hallazgo incidental en el momento de una cirugía ginecológica?". Oncología ginecológica . 142 (2): 255–260. doi :10.1016/j.ygyno.2016.05.036. PMID 27261327. Consultado el 24 de junio de 2020 .
- ^ Mcnairn, AJ; Guasch, G (2011). "Zonas de transición epitelial: fusión de microambientes, nichos y transformación celular". Revista Europea de Dermatología . 21 (S1): 21–8. doi :10.1684/ejd.2011.1267. PMID 21628126.
- ^ Howitt, Brooke E.; Hanamornroongruang, Suchanan; Lin, Douglas I.; Conner, James E.; Schulte, Stephanie; Horowitz, Neil; Crum, Christopher P.; Meserve, Emily E. (1 de marzo de 2015). "Evidencia de un modelo dualista de carcinoma seroso de alto grado: estado de mutación de BRCA, histología y carcinoma intraepitelial tubárico". The American Journal of Surgical Pathology . 39 (3): 287–293. doi :10.1097/PAS.0000000000000369. ISSN 1532-0979. PMID 25581732. S2CID 24304683.
- ^ Crum, Christopher P.; Drapkin, Ronny; Miron, Alexander; Ince, Tan A.; Muto, Michael; Kindelberger, David W.; Lee, Yonghee (1 de febrero de 2007). "La trompa de Falopio distal: un nuevo modelo para la carcinogénesis serosa pélvica". Current Opinion in Obstetrics and Gynecology . 19 (1): 3–9. doi :10.1097/GCO.0b013e328011a21f. ISSN 1040-872X. PMID 17218844. S2CID 2142091.
- ^ Bankhead, CR; Collins, C.; Stokes-Lampard, H.; Rose, P.; Wilson, S.; Clements, A.; Mant, D.; Kehoe, ST; Austoker, J. (1 de julio de 2008). "Identificación de los síntomas del cáncer de ovario: un estudio cualitativo y cuantitativo". BJOG: Revista internacional de obstetricia y ginecología . 115 (8): 1008–1014. doi :10.1111/j.1471-0528.2008.01772.x. ISSN 1471-0528. PMC 2607526. PMID 18651882 .
- ^ abcd Colombo, N.; Peiretti, M.; Parma, G.; Lapresa, M.; Mancari, R.; Carinelli, S.; Sessa, C.; Castiglione, M.; Grupo de trabajo de directrices de la ESMO (1 de mayo de 2010). "Carcinoma epitelial de ovario de diagnóstico reciente y recidivante: directrices de práctica clínica de la ESMO para el diagnóstico, el tratamiento y el seguimiento". Anales de oncología . 21 (Supl. 5): v23–30. doi : 10.1093/annonc/mdq244 . ISSN 1569-8041. PMID 20555088.
- ^ ab Vang, Russell; Shih, Ie-Ming; Kurman, Robert J. (1 de septiembre de 2009). "Carcinoma seroso de ovario de bajo y alto grado: patogénesis, características clinicopatológicas y biológicas moleculares y problemas de diagnóstico". Avances en patología anatómica . 16 (5): 267–282. doi :10.1097/PAP.0b013e3181b4fffa. ISSN 1533-4031. PMC 2745605. PMID 19700937 .
- ^ Quattrocchi, Livia; Green, Andrew R.; Martin, Stewart; Durrant, Lindy; Deen, Suha (1 de julio de 2011). "El cambio de cadherina en el carcinoma seroso de alto grado de ovario se asocia con la progresión de la enfermedad". Virchows Archiv . 459 (1): 21–29. doi :10.1007/s00428-011-1082-1. ISSN 1432-2307. PMID 21509572. S2CID 1779853.
- ^ Nagle, Christina M.; Francis, Jane E.; Nelson, Anne E.; Zorbas, Helen; Luxford, Karen; de Fazio, Anna; Fereday, Sian; Bowtell, David D.; Green, Adèle C. (1 de junio de 2011). "Reducir el tiempo hasta el diagnóstico no mejora los resultados para las mujeres con cáncer de ovario sintomático: un informe del Grupo de estudio de cáncer de ovario australiano". Revista de oncología clínica . 29 (16): 2253–2258. doi : 10.1200/JCO.2010.32.2164 . ISSN 1527-7755. PMID 21537035.
- ^ Buys, Saundra S.; Partridge, Edward; Black, Amanda; Johnson, Christine C.; Lamerato, Lois; Isaacs, Claudine; Reding, Douglas J.; Greenlee, Robert T.; Yokochi, Lance A. (8 de junio de 2011). "Efecto del cribado en la mortalidad por cáncer de ovario: ensayo controlado aleatorizado de cribado de cáncer de próstata, pulmón, colorrectal y ovario (PLCO)". JAMA . 305 (22): 2295–2303. doi : 10.1001/jama.2011.766 . ISSN 1538-3598. PMID 21642681.
- ^ Jacobs, Ian J.; Menon, Usha; Ryan, Andy; Gentry-Maharaj, Aleksandra; Burnell, Matthew; Kalsi, Jatinderpal K.; Amso, Nazar N.; Apostolidou, Sophia; Benjamin, Elizabeth (5 de marzo de 2016). "Detección del cáncer de ovario y mortalidad en el ensayo colaborativo del Reino Unido sobre detección del cáncer de ovario (UKCTOCS): un ensayo controlado aleatorizado". Lancet . 387 (10022): 945–956. doi :10.1016/S0140-6736(15)01224-6. ISSN 1474-547X. PMC 4779792 . PMID 26707054.
- ^ Oliver Perez, M. Reyes; Magriñá, Javier; García, Alvaro Tejerizo; Jiménez Lopez, Jesus Salvador (2015-12-01). "Salpingectomía profiláctica y salpingooforectomía profiláctica para carcinoma epitelial seroso de alto grado anexial: una reevaluación". Oncología quirúrgica . 24 (4): 335–344. doi :10.1016/j.suronc.2015.09.008. ISSN 1879-3320. PMID 26690823.
- ^ Daly, Mary B.; Dresher, Charles W.; Yates, Melinda S.; Jeter, Joanne M.; Karlan, Beth Y.; Alberts, David S.; Lu, Karen H. (1 de mayo de 2015). "Salpingectomía como medio para reducir el riesgo de cáncer de ovario". Investigación sobre la prevención del cáncer . 8 (5): 342–348. doi : 10.1158 /1940-6207.CAPR-14-0293. ISSN 1940-6215. PMC 4417454. PMID 25586903.
- ^ Pölcher, Martin; Hauptmann, Steffen; Fotopoulou, Christina; Schmalfeldt, Barbara; Meinhold-Heerlein, Ivo ; Mustea, Alexander; Runnebaum, Ingo; Sehouli, Jalid (1 de julio de 2015). "Salpingectomías oportunistas para la prevención de un carcinoma seroso de alto grado: una declaración de la Kommission Ovar de la AGO". Archivos de Ginecología y Obstetricia . 292 (1): 231–234. doi :10.1007/s00404-015-3697-y. ISSN 1432-0711. PMID 25914073. S2CID 24396058.
- ^ Kauff, Noé D.; Satagopan, Jaya M.; Robson, Mark E.; Scheuer, Lauren; Hensley, Martee; Hudis, Clifford A.; Ellis, Nathan A.; Boyd, Jeff; Borgen, Patrick I. (23 de mayo de 2002). "Salpingooforectomía reductora de riesgos en mujeres con una mutación BRCA1 o BRCA2". La Revista de Medicina de Nueva Inglaterra . 346 (21): 1609-1615. doi : 10.1056/NEJMoa020119 . ISSN 1533-4406. PMID 12023992.
- ^ Kauff, Noah D.; Domchek, Susan M .; Friebel, Tara M.; Robson, Mark E.; Lee, Johanna; Garber, Judy E.; Isaacs, Claudine; Evans, D. Gareth; Lynch, Henry (10 de marzo de 2008). "Salpingooforectomía reductora de riesgo para la prevención del cáncer de mama y ginecológico asociado a BRCA1 y BRCA2: un estudio multicéntrico y prospectivo". Revista de Oncología Clínica . 26 (8): 1331–1337. doi :10.1200/JCO.2007.13.9626. ISSN 1527-7755. PMC 3306809 . PMID 18268356.
- ^ Sieh, Weiva; Salvador, Shannon; McGuire, Valerie; Weber, Rachel Palmieri; Terry, Kathryn L.; Rossing, Mary Anne; Risch, Harvey; Wu, Anna H.; Webb, Penelope M. (1 de abril de 2013). "Ligadura de trompas y riesgo de subtipos de cáncer de ovario: un análisis agrupado de estudios de casos y controles". Revista Internacional de Epidemiología . 42 (2): 579–589. doi :10.1093/ije/dyt042. ISSN 1464-3685. PMC 3619957 . PMID 23569193.
- ^ Ferguson, Donna; Han, Lucy (2015). "El papel de la trompa de Falopio en la carcinogénesis serosa ovárica: mecanismos biológicos e impactos clínicos" (PDF) . American Journal of Clinical and Experimental Obstetrics and Gynecology . 2 (1).
- ^ Berns, Els MJJ; Bowtell, David D. (1 de junio de 2012). "La visión cambiante del cáncer de ovario seroso de alto grado". Cancer Research . 72 (11): 2701–2704. doi : 10.1158/0008-5472.CAN-11-3911 . ISSN 1538-7445. PMID 22593197.
- ^ Ivy, S. Percy; Liu, Joyce F.; Lee, Jung-Min; Matulonis, Ursula A.; Kohn, Elise C. (1 de mayo de 2016). "Cediranib, un inhibidor de pan-VEGFR, y olaparib, un inhibidor de PARP, en terapia combinada para el cáncer de ovario seroso de alto grado". Opinión de expertos sobre fármacos en investigación . 25 (5): 597–611. doi :10.1517/13543784.2016.1156857. ISSN 1744-7658. PMID 26899229. S2CID 25959899.
- ^ Parkes, Eileen E.; Kennedy, Richard D. (1 de mayo de 2016). "Aplicación clínica de inhibidores de la poli(ADP-ribosa) polimerasa en el cáncer de ovario seroso de alto grado". The Oncologist . 21 (5): 586–593. doi :10.1634/theoncologist.2015-0438. ISSN 1549-490X. PMC 4861365 . PMID 27022037.
- ^ Quirk, Jeffrey T.; Natarajan, Nachimuthu; Mettlin, Curtis J. (1 de octubre de 2005). "Patrones de la tasa de incidencia del cáncer de ovario específicos de la edad en los Estados Unidos". Oncología ginecológica . 99 (1): 248–250. doi :10.1016/j.ygyno.2005.06.052. ISSN 0090-8258. PMID 16095676.
- ^ Liede, Alexander; Narod, Steven A. (1 de diciembre de 2002). "Cáncer de mama y ovario hereditario en Asia: epidemiología genética de BRCA1 y BRCA2". Human Mutation . 20 (6): 413–424. doi : 10.1002/humu.10154 . ISSN 1098-1004. PMID 12442265.
- ^ Ferlay, Jacques; Shin, Hai-Rim; Bray, Freddie; Forman, David; Mathers, Colin; Parkin, Donald Maxwell (15 de diciembre de 2010). "Estimaciones de la carga mundial de cáncer en 2008: GLOBOCAN 2008". Revista Internacional del Cáncer . 127 (12): 2893–2917. doi : 10.1002/ijc.25516 . ISSN 1097-0215. PMID 21351269. S2CID 23583962.
- ^ ab Temkin, Sarah M.; Terplan, Mishka (1 de octubre de 2015). "Tendencias en la supervivencia relativa del cáncer de ovario entre 1975 y 2011". Obstetricia y ginecología . 126 (4): 898. doi :10.1097/AOG.0000000000001073. ISSN 1873-233X. PMID 26393445. S2CID 32185049.
- ^ Terplan, Mishka; Schluterman, Nicholas; McNamara, Erica J.; Tracy, J. Kathleen; Temkin, Sarah M. (1 de abril de 2012). "¿Han aumentado las disparidades raciales en el cáncer de ovario con el tiempo? Un análisis de los datos de SEER". Oncología ginecológica . 125 (1): 19–24. doi :10.1016/j.ygyno.2011.11.025. ISSN 1095-6859. PMID 22108636.