Modificación postranscripcional
Falta información sobre las secciones de ARN que no sean ARNm. ( Octubre de 2020 ) |
| Parte de una serie sobre |
| Genética |
|---|
 |
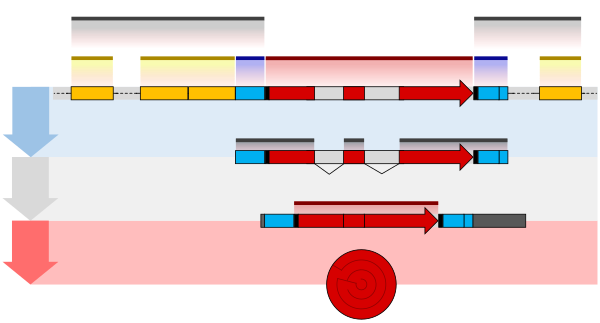
La modificación transcripcional o modificación cotranscripcional es un conjunto de procesos biológicos comunes a la mayoría de las células eucariotas por los cuales una transcripción primaria de ARN se altera químicamente después de la transcripción de un gen para producir una molécula de ARN madura y funcional que luego puede salir del núcleo y realizar cualquiera de una variedad de funciones diferentes en la célula. [1] Hay muchos tipos de modificaciones postranscripcionales que se logran a través de una clase diversa de mecanismos moleculares.
Un ejemplo es la conversión de las transcripciones de ARN mensajero precursor en ARN mensajero maduro que posteriormente es capaz de traducirse en proteína . Este proceso incluye tres pasos principales que modifican significativamente la estructura química de la molécula de ARN: la adición de una tapa 5' , la adición de una cola poliadenilada 3' y el empalme del ARN . Este procesamiento es vital para la traducción correcta de los genomas eucariotas porque el ARNm precursor inicial producido por transcripción a menudo contiene tanto exones (secuencias codificantes) como intrones (secuencias no codificantes); el empalme elimina los intrones y une los exones directamente, mientras que la tapa y la cola facilitan el transporte del ARNm a un ribosoma y lo protegen de la degradación molecular. [2]
Las modificaciones postranscripcionales también pueden ocurrir durante el procesamiento de otras transcripciones que finalmente se convierten en ARN de transferencia , ARN ribosómico o cualquiera de los otros tipos de ARN utilizados por la célula.
Procesamiento de ARNm
|
Procesamiento de 5'
Tapado
La colocación de un tapón en el pre-ARNm implica la adición de 7-metilguanosina (m 7 G) al extremo 5'. Para lograr esto, es necesario eliminar el fosfato 5' terminal, lo que se hace con la ayuda de la enzima ARN trifosfatasa . La enzima guanosil transferasa cataliza la reacción, que produce el extremo 5' difosfato . El extremo 5' difosfato ataca entonces al átomo de fósforo alfa de una molécula de GTP para añadir el residuo de guanina en un enlace trifosfato 5'5'. La enzima (guanina- N 7 -)-metiltransferasa ("cap MTasa") transfiere un grupo metilo de la S-adenosil metionina al anillo de guanina. [4] Este tipo de tapón, con solo el (m 7 G) en posición, se denomina estructura cap 0. La ribosa del nucleótido adyacente también puede metilarse para formar una caperuza 1. La metilación de los nucleótidos aguas abajo de la molécula de ARN produce estructuras de caperuza 2, caperuza 3, etc. En estos casos, los grupos metilo se añaden a los grupos OH 2' del azúcar ribosa. La caperuza protege el extremo 5' del transcrito de ARN primario del ataque de las ribonucleasas que tienen especificidad por los enlaces fosfodiéster 3'5' . [5]
Procesamiento de 3'
Escisión y poliadenilación
El procesamiento del pre-ARNm en el extremo 3' de la molécula de ARN implica la escisión de su extremo 3' y luego la adición de aproximadamente 250 residuos de adenina para formar una cola de poli(A) . Las reacciones de escisión y adenilación ocurren principalmente si una secuencia de señal de poliadenilación (5'-AAUAAA-3') se encuentra cerca del extremo 3' de la molécula de pre-ARNm, que es seguida por otra secuencia, que generalmente es (5'-CA-3') y es el sitio de escisión. Una secuencia rica en GU también suele estar presente más abajo en la molécula de pre-ARNm. Más recientemente, se ha demostrado que las secuencias de señal alternativas como UGUA aguas arriba del sitio de escisión también pueden dirigir la escisión y la poliadenilación en ausencia de la señal AAUAAA. Estas dos señales no son mutuamente independientes y a menudo coexisten. Después de la síntesis de los elementos de la secuencia, varias proteínas de múltiples subunidades se transfieren a la molécula de ARN. La transferencia de estas proteínas de unión específicas de secuencia, factor de especificidad de escisión y poliadenilación (CPSF), factor de escisión I (CF I) y factor de estimulación de escisión (CStF), ocurre desde la ARN polimerasa II . Los tres factores se unen a los elementos de la secuencia. La señal AAUAAA se une directamente al CPSF. Para los sitios de procesamiento dependientes de UGUA, la unión del complejo multiproteico se realiza mediante el factor de escisión I (CF I). El complejo proteico resultante formado contiene factores de escisión adicionales y la enzima poliadenilato polimerasa (PAP). Este complejo escinde el ARN entre la secuencia de poliadenilación y la secuencia rica en GU en el sitio de escisión marcado por las secuencias (5'-CA-3'). Luego, la poli(A) polimerasa agrega alrededor de 200 unidades de adenina al nuevo extremo 3' de la molécula de ARN utilizando ATP como precursor. A medida que se sintetiza la cola de poli(A), se une a múltiples copias de la proteína de unión a poli(A) , que protege el extremo 3' de la digestión por ribonucleasa por enzimas, incluido el complejo CCR4-Not . [5]
Empalme de intrones
El empalme de ARN es el proceso por el cual los intrones , regiones de ARN que no codifican proteínas, se eliminan del pre-ARNm y los exones restantes se conectan para volver a formar una única molécula continua. Los exones son secciones de ARNm que se "expresan" o traducen en una proteína. Son las porciones codificantes de una molécula de ARNm. [6] Aunque la mayor parte del empalme de ARN ocurre después de la síntesis completa y la protección final del pre-ARNm, las transcripciones con muchos exones pueden empalmarse cotranscripcionalmente. [7] La reacción de empalme es catalizada por un gran complejo proteico llamado espliceosoma ensamblado a partir de proteínas y pequeñas moléculas de ARN nuclear que reconocen sitios de empalme en la secuencia de pre-ARNm. Muchos pre-ARNm, incluidos los que codifican anticuerpos , pueden empalmarse de múltiples maneras para producir diferentes ARNm maduros que codifican diferentes secuencias de proteínas . Este proceso se conoce como empalme alternativo y permite la producción de una gran variedad de proteínas a partir de una cantidad limitada de ADN.
Procesamiento del ARNm de histonas
Las histonas H2A, H2B, H3 y H4 forman el núcleo de un nucleosoma y, por lo tanto, se denominan histonas centrales . El procesamiento de las histonas centrales se realiza de manera diferente porque el ARNm de histona típico carece de varias características de otros ARNm eucariotas, como la cola de poli(A) y los intrones. Por lo tanto, estos ARNm no sufren empalme y su procesamiento 3' se realiza independientemente de la mayoría de los factores de escisión y poliadenilación. Los ARNm de histonas centrales tienen una estructura especial de tallo-bucle en el extremo 3-prime que es reconocida por una proteína de unión de tallo-bucle y una secuencia descendente, llamada elemento descendente de histona (HDE) que recluta el ARNm U7 . El factor de especificidad de escisión y poliadenilación 73 corta el ARNm entre tallo-bucle y HDE [8]
Sin embargo , las variantes de histonas, como H2A.Z o H3.3, tienen intrones y se procesan como ARNm normales, incluido el empalme y la poliadenilación. [8]
Véase también
Referencias
- ^ Kiss T (julio de 2001). "Modificación postranscripcional de ARN celulares guiada por ARN nucleolar pequeño". The EMBO Journal . 20 (14): 3617–22. doi :10.1093/emboj/20.14.3617. PMC 125535 . PMID 11447102.
- ^ Berg, Tymoczko y Stryer 2007, pág. 836Error de harvnb: no hay destino: CITEREFBergTymoczkoStryer2008 ( ayuda )
- ^ ab Shafee, Thomas; Lowe, Rohan (2017). "Estructura de genes eucariotas y procariotas". WikiJournal of Medicine . 4 (1). doi : 10.15347/wjm/2017.002 . ISSN 2002-4436.
- ^ Yamada-Okabe T, Mio T, Kashima Y, Matsui M, Arisawa M, Yamada-Okabe H (noviembre de 1999). "El gen de Candida albicans para la metiltransferasa de ARNm 5-cap: identificación de residuos adicionales esenciales para la catálisis". Microbiología . 145 ( Pt 11) (11): 3023–33. doi : 10.1099/00221287-145-11-3023 . PMID 10589710.
- ^ Véase Hames y Hooper 2006, pág. 221Error de harvnb: no hay destino: CITEREFHamesHopper2008 ( ayuda )
- ^ Biología . Mgraw hill education. 2014. págs. 241–242. ISBN 978-981-4581-85-1.
- ^ Lodish HF, Berk A, Kaiser C, Krieger M, Scott MP, Bretscher A, Ploegh H, Matsudaira PT (2007). "Capítulo 8: Control génico postranscripcional". Molecular Cell Biology . San Francisco: WH Freeman. ISBN 978-0-7167-7601-7.
- ^ ab Marzluff WF, Wagner EJ, Duronio RJ (noviembre de 2008). "Metabolismo y regulación de los ARNm de las histonas canónicas: vida sin una cola de poli(A)". Nature Reviews. Genetics . 9 (11): 843–54. doi :10.1038/nrg2438. PMC 2715827 . PMID 18927579.
Lectura adicional
- Berg JM, Tymoczko JL, Stryer L (2007). Bioquímica (6 ed.). Nueva York : WH Freeman & Co. ISBN 978-0-7167-6766-4.
- Hames D, Hooper N (2006). Instant Notes Biochemistry . Vol. 58 (3.ª ed.). Leeds : Taylor and Francis. pág. 767. ISBN. 978-0-415-36778-3. Número de identificación personal 11098183.
{{cite book}}:|journal=ignorado ( ayuda ) - Sun WJ, Li JH, Liu S, Wu J, Zhou H, Qu LH, Yang JH (enero de 2016). "RMBase: un recurso para decodificar el panorama de modificaciones de ARN a partir de datos de secuenciación de alto rendimiento". Nucleic Acids Research . 44 (D1): D259-65. doi :10.1093/nar/gkv1036. PMC 4702777 . PMID 26464443.
- Machnicka MA, Milanowska K, Osman Oglou O, Purta E, Kurkowska M, Olchowik A, Januszewski W, Kalinowski S, Dunin-Horkawicz S, Rother KM, Helm M, Bujnicki JM, Grosjean H (enero de 2013). "MODOMICS: una base de datos de vías de modificación del ARN - actualización de 2013". Nucleic Acids Research . 41 (número de la base de datos): D262-7. doi :10.1093/nar/gks1007. PMC 3531130 . PMID 23118484.
- Cantara WA, Crain PF, Rozenski J, McCloskey JA, Harris KA, Zhang X, Vendeix FA, Fabris D, Agris PF (enero de 2011). "Base de datos de modificación de ARN, RNAMDB: actualización de 2011". Nucleic Acids Research . 39 (número de la base de datos): D195-201. doi :10.1093/nar/gkq1028. PMC 3013656 . PMID 21071406.
- Modificación postranscripcional del ARN en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.