Conjugación bacteriana
La conjugación bacteriana es la transferencia de material genético entre células bacterianas por contacto directo de célula a célula o por una conexión tipo puente entre dos células. [1] Esto tiene lugar a través de un pilus . [2] [ cita completa necesaria ] Es un modo de reproducción parasexual en bacterias.
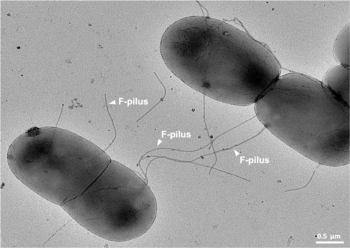
Es un mecanismo de transferencia horizontal de genes como lo son la transformación y la transducción, aunque estos otros dos mecanismos no implican contacto de célula a célula. [4]
La conjugación bacteriana clásica de E. coli se considera a menudo el equivalente bacteriano de la reproducción sexual o el apareamiento , ya que implica el intercambio de material genético. Sin embargo, no es reproducción sexual, ya que no se produce intercambio de gametos ni, de hecho, no se genera un nuevo organismo : en cambio, se transforma un organismo existente. Durante la conjugación clásica de E. coli , la célula donante proporciona un elemento genético conjugativo o movilizable que, en la mayoría de los casos, es un plásmido o un transposón . [5] La mayoría de los plásmidos conjugativos tienen sistemas que garantizan que la célula receptora no contenga ya un elemento similar.
La información genética transferida suele ser beneficiosa para el receptor. Los beneficios pueden incluir resistencia a los antibióticos , tolerancia a los xenobióticos o la capacidad de utilizar nuevos metabolitos . [1] Otros elementos pueden ser perjudiciales y pueden considerarse parásitos bacterianos .
La conjugación en Escherichia coli por zigogénesis espontánea [6] y en Mycobacterium smegmatis por transferencia conjugal distributiva [7] [8] difieren de la conjugación clásica de E. coli mejor estudiada en que estos casos implican una mezcla sustancial de los genomas parentales .
Historia
El proceso fue descubierto por Joshua Lederberg y Edward Tatum [9] en 1946.
Mecanismo
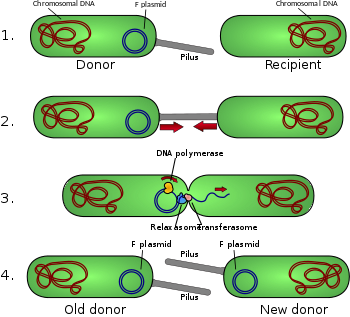
Diagrama de conjugación
- La célula donante produce pilus .
- El pilus se adhiere a la célula receptora y une las dos células.
- Se corta el plásmido móvil y luego se transfiere una sola cadena de ADN a la célula receptora.
- Ambas células sintetizan una cadena complementaria para producir un plásmido circular bicatenario y también reproducen pili; ambas células son ahora donantes viables para el factor F. [1]
El factor F es un episoma (un plásmido que puede integrarse en el cromosoma bacteriano por recombinación homóloga ) con una longitud de aproximadamente 100 kb . Lleva su propio origen de replicación , el oriV , y un origen de transferencia, u oriT . [5] Solo puede haber una copia del plásmido F en una bacteria dada, ya sea libre o integrada, y las bacterias que poseen una copia se denominan F-positivas o F-plus (denominadas F + ). Las células que carecen de plásmidos F se denominan F-negativas o F-minus (F − ) y, como tales, pueden funcionar como células receptoras. [ cita requerida ]
Entre otra información genética, el plásmido F lleva un locus tra y trb , que juntos tienen una longitud de aproximadamente 33 kb y constan de unos 40 genes . El locus tra incluye el gen de la pilina y los genes reguladores, que juntos forman pili en la superficie celular. El locus también incluye los genes de las proteínas que se adhieren a la superficie de las bacterias F − e inician la conjugación. Aunque existe cierto debate sobre el mecanismo exacto de la conjugación, parece que los pili son las estructuras a través de las cuales se produce el intercambio de ADN. Los pili F son extremadamente resistentes al estrés mecánico y termoquímico, lo que garantiza una conjugación exitosa en una variedad de entornos. [10] Varias proteínas codificadas en el locus tra o trb parecen abrir un canal entre las bacterias y se cree que la enzima traD, ubicada en la base del pilus, inicia la fusión de la membrana.
Cuando la conjugación se inicia mediante una señal, la enzima relaxasa crea una muesca en una de las hebras del plásmido conjugativo en el oriT . La relaxasa puede funcionar sola o en un complejo de más de una docena de proteínas conocidas colectivamente como relaxosoma . En el sistema del plásmido F, la enzima relaxasa se llama TraI y el relaxosoma consta de TraI, TraY, TraM y el factor huésped integrado IHF. La hebra mellada, o hebra T , se desenrolla luego de la hebra intacta y se transfiere a la célula receptora en una dirección del extremo 5' al extremo 3'. La hebra restante se replica independientemente de la acción conjugativa (replicación vegetativa que comienza en el oriV ) o en conjunto con la conjugación (replicación conjugativa similar a la replicación de círculo rodante del fago lambda ). La replicación conjugativa puede requerir una segunda muesca antes de que pueda ocurrir una transferencia exitosa. Un informe reciente afirma haber inhibido la conjugación con sustancias químicas que imitan un paso intermedio de este segundo evento de mellado. [11]
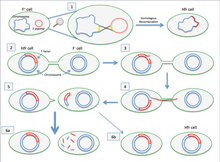
Si el plásmido F que se transfiere se ha integrado previamente en el genoma del donante (produciendo una cepa Hfr ["High Frequency of Recombination"]), parte del ADN cromosómico del donante también puede transferirse con el ADN plasmídico. [4] La cantidad de ADN cromosómico que se transfiere depende de cuánto tiempo permanezcan en contacto las dos bacterias conjugadas. En cepas comunes de laboratorio de E. coli, la transferencia de todo el cromosoma bacteriano tarda unos 100 minutos. El ADN transferido puede luego integrarse en el genoma del receptor mediante recombinación homóloga .
Un cultivo celular que contiene en su población células con plásmidos F no integrados normalmente también contiene algunas células que han integrado accidentalmente sus plásmidos. Son estas células las responsables de las transferencias de genes cromosómicos de baja frecuencia que ocurren en tales cultivos. Algunas cepas de bacterias con un plásmido F integrado pueden aislarse y cultivarse en cultivo puro. Debido a que estas cepas transfieren genes cromosómicos de manera muy eficiente, se las llama Hfr ( alta frecuencia de recombinación ) . El genoma de E. coli se cartografió originalmente mediante experimentos de apareamiento interrumpido en los que varias células Hfr en proceso de conjugación se separaron de los receptores después de menos de 100 minutos (inicialmente utilizando una licuadora Waring). Luego se investigaron los genes que se habían transferido.
Dado que la integración del plásmido F en el cromosoma de E. coli es un fenómeno espontáneo poco frecuente y que los numerosos genes que promueven la transferencia de ADN se encuentran en el genoma del plásmido y no en el genoma bacteriano, se ha argumentado que la transferencia conjugativa de genes bacterianos, tal como ocurre en el sistema Hfr de E. coli , no es una adaptación evolutiva del huésped bacteriano, ni es probable que sea ancestral al sexo eucariota. [13]
Cigogénesis espontánea en E. coli
Además de la conjugación bacteriana clásica descrita anteriormente para E. coli , en ciertas cepas de E. coli se observa una forma de conjugación denominada cigogénesis espontánea (apareamiento Z para abreviar) . [6] En el apareamiento Z hay una mezcla genética completa y se forman diploides inestables que eliminan células fenotípicamente haploides, de las cuales algunas muestran un fenotipo parental y algunas son recombinantes verdaderos .
Transferencia conyugal en micobacterias
La conjugación en Mycobacteria smegmatis , al igual que la conjugación en E. coli , requiere un contacto estable y prolongado entre una cepa donante y una receptora, es resistente a la DNasa y el ADN transferido se incorpora al cromosoma receptor mediante recombinación homóloga. Sin embargo, a diferencia de la conjugación Hfr de E. coli , la conjugación micobacteriana se basa en cromosomas en lugar de en plásmidos. [7] [8] Además, a diferencia de la conjugación Hfr de E. coli , en M. smegmatis todas las regiones del cromosoma se transfieren con eficiencias comparables. Las longitudes de los segmentos donantes varían ampliamente, pero tienen una longitud promedio de 44,2 kb. Dado que se transfiere una media de 13 tractos, el total promedio de ADN transferido por genoma es de 575 kb. [8] Este proceso se conoce como "transferencia conyugal distributiva". [7] [8] Gray et al. [7] encontraron una mezcla sustancial de los genomas parentales como resultado de la conjugación y consideraron que esta mezcla recordaba a la observada en los productos meióticos de la reproducción sexual.
Transferencia de ADN por conjugación en arqueas hipertermófilas
Las arqueas hipertermófilas codifican pili estructuralmente similares a los pili conjugativos bacterianos. [14] Sin embargo, a diferencia de las bacterias, donde el aparato de conjugación típicamente media la transferencia de elementos genéticos móviles, como plásmidos o transposones, la maquinaria conjugativa de las arqueas hipertermófilas, llamada Ced (sistema crenarqueal para el intercambio de ADN) [15] y Ted (sistema termoproteal para el intercambio de ADN), [14] parece ser responsable de la transferencia de ADN celular entre miembros de la misma especie. Se ha sugerido que en estas arqueas la maquinaria de conjugación ha sido completamente domesticada para promover la reparación del ADN a través de la recombinación homóloga en lugar de la propagación de elementos genéticos móviles. [14] Además del pilus conjugativo similar a VirB2, los sistemas Ced y Ted incluyen componentes para el poro de apareamiento transmembrana similar a VirB6 y la ATPasa similar a VirB4. [14]
Transferencia entre reinos

Las bacterias relacionadas con la fijación de nitrógeno Rhizobia son un caso interesante de conjugación entre reinos . [16] Por ejemplo, el plásmido inductor de tumores (Ti) de Agrobacterium y el plásmido inductor de tumores de raíz (Ri) de A. rhizogenes contienen genes que son capaces de transferirse a las células vegetales. La expresión de estos genes transforma eficazmente las células vegetales en fábricas productoras de opinas . Las bacterias utilizan las opinas como fuentes de nitrógeno y energía. Las células infectadas forman agallas de corona o tumores de raíz . Los plásmidos Ti y Ri son, por tanto, endosimbiontes de las bacterias, que a su vez son endosimbiontes (o parásitos) de la planta infectada. [ cita requerida ]
Los plásmidos Ti y Ri también pueden transferirse entre bacterias mediante un sistema (el operón tra o de transferencia ) que es diferente e independiente del sistema utilizado para la transferencia entre reinos (el operón vir o de virulencia ). Estas transferencias crean cepas virulentas a partir de cepas que antes no lo eran. [ cita requerida ]
Aplicaciones de la ingeniería genética
La conjugación es un medio conveniente para transferir material genético a una variedad de objetivos. En los laboratorios, se han reportado transferencias exitosas de bacterias a levaduras, [17] plantas, células de mamíferos, [18] [19] diatomeas [20] y mitocondrias de mamíferos aisladas . [21] La conjugación tiene ventajas sobre otras formas de transferencia genética, incluyendo una mínima alteración de la envoltura celular del objetivo y la capacidad de transferir cantidades relativamente grandes de material genético (ver la discusión anterior sobre la transferencia de cromosomas de E. coli ). En ingeniería vegetal, la conjugación similar a Agrobacterium complementa otros vehículos estándar como el virus del mosaico del tabaco (TMV). Si bien el TMV es capaz de infectar a muchas familias de plantas, estas son principalmente dicotiledóneas herbáceas . La conjugación similar a Agrobacterium también se usa principalmente para dicotiledóneas, pero los receptores monocotiledóneos no son poco comunes. [ cita requerida ]
Véase también
- Conjugación sexual en algas y ciliados
- Transfección
- Apareamiento triparental
- Inducción cigótica
Referencias
- ^ abc Holmes, Randall K.; Jobling, Michael G. (1996). "Genética". En Baron S (ed.). Genética: conjugación. en: Baron's Medical Microbiology (4.ª ed.). Rama Médica de la Universidad de Texas. ISBN 0-9631172-1-1. Número de identificación personal 21413277.
- ^ Dr.TS Ramarao M.sc, Ph.D. (1991). Licenciatura en Botánica, volumen 1 .
- ^ Patkowski, Jonasz (21 de abril de 2023). "F-pilus, la máquina sexual bacteriana definitiva". Comunidad de Microbiología de Nature Portfolio .
- ^ abc Griffiths, AJF (1999). Introducción al análisis genético (7.ª ed.). San Francisco: WH Freeman. ISBN 978-0-7167-3520-5Archivado desde el original el 8 de febrero de 2020. Consultado el 11 de agosto de 2023 .
- ^ ab Ryan, KJ; Ray, CG, eds. (2004). Sherris Medical Microbiology (4.ª ed.). Nueva York: McGraw Hill. págs. 60–64. ISBN 978-0-8385-8529-0.
- ^ ab Gratia, Jean-Pierre; Thiry, Marc (1 de septiembre de 2003). "Zigogénesis espontánea en Escherichia coli, una forma de verdadera sexualidad en procariotas". Microbiología . 149 (9): 2571–2584. doi : 10.1099/mic.0.26348-0 . PMID 12949181.
- ^ abcd Gray, Todd A.; Krywy, Janet A.; Harold, Jessica; Palumbo, Michael J.; Derbyshire, Keith M. (9 de julio de 2013). "La transferencia conyugal distributiva en micobacterias genera progenie con mosaicismo genómico similar al meiótico, lo que permite el mapeo de un locus de identidad de apareamiento". PLOS Biology . 11 (7): e1001602. doi : 10.1371/journal.pbio.1001602 . PMC 3706393 . PMID 23874149.
- ^ abcd Derbyshire, Keith M.; Gray, Todd A. (17 de enero de 2014). "Transferencia conyugal distributiva: nuevos conocimientos sobre la transferencia horizontal de genes y el intercambio genético en micobacterias". Microbiology Spectrum . 2 (1). doi :10.1128/microbiolspec.MGM2-0022-2013. PMC 4259119 . PMID 25505644.
- ^ Lederberg, Joshua; Tatum, EL (octubre de 1946). "Recombinación génica en Escherichia coli". Nature . 158 (4016): 558. Bibcode :1946Natur.158..558L. doi : 10.1038/158558a0 . PMID 21001945. S2CID 1826960.
- ^ Patkowski, Jonasz B.; Dahlberg, Tobías; Amin, Himani; Gahlot, Dharmender K.; Vijayrajratnam, Sukhithasri; Vogel, José P.; Francisco, Mateo S.; Panadero, José L.; Andersson, Magnus; Costa, Tiago RD (5 de abril de 2023). "La adaptabilidad biomecánica de F-pilus acelera la diseminación conjugativa de la resistencia a los antimicrobianos y la formación de biopelículas". Comunicaciones de la naturaleza . 14 (1): 1879. doi :10.1038/s41467-023-37600-y. PMC 10076315 . PMID 37019921.
- ^ Lujan, Scott A.; Guogas, Laura M.; Ragonese, Heather; Matson, Steven W.; Redinbo, Matthew R. (24 de julio de 2007). "Interrupción de la propagación de la resistencia a los antibióticos mediante la inhibición de la relaxasa de ADN conjugativa". Actas de la Academia Nacional de Ciencias . 104 (30): 12282–12287. Bibcode :2007PNAS..10412282L. doi : 10.1073/pnas.0702760104 . JSTOR 25436291. PMC 1916486 . PMID 17630285.
- ^ Mayer, Gene. "Genetic Exchange". www.microbiologybook.org . Consultado el 4 de diciembre de 2017 .
- ^ Michod, Richard E.; Bernstein, Harris; Nedelcu, Aurora M. (mayo de 2008). "Valor adaptativo del sexo en patógenos microbianos" (PDF) . Infección, genética y evolución . 8 (3): 267–285. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ abcd Beltran, Leticia C.; Cvirkaite-Krupovic, Virginija; Miller, Jessalyn; Wang, Fengbin; Kreutzberger, Mark AB; Patkowski, Jonasz B.; Costa, Tiago RD; Schouten, Stefan; Levental, Ilya; Conticello, Vincent P.; Egelman, Edward H.; Krupovic, Mart (7 de febrero de 2023). "El aparato de importación de ADN arqueológico es homólogo a la maquinaria de conjugación bacteriana". Nature Communications . 14 (1): 666. Bibcode :2023NatCo..14..666B. doi :10.1038/s41467-023-36349-8. ISSN 2041-1723. PMC 9905601 . PMID 36750723.
- ^ van Wolferen, Marleen; Wagner, Alexander; van der Does, Chris; Albers, Sonja-Verena (1 de marzo de 2016). "El sistema Ced arqueológico importa ADN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 113 (9): 2496–2501. Bibcode :2016PNAS..113.2496V. doi : 10.1073/pnas.1513740113 . ISSN 1091-6490. PMC 4780597 . PMID 26884154.
- ^ Pan, Shen Q.; Jin, Shouguang; Boulton, Margaret I.; Hawes, Martha; Gordon, Milton P.; Nester, Eugene W. (julio de 1995). "Se requiere un factor de virulencia de Agrobacterium codificado por un gen del plásmido Ti o un gen cromosómico para la transferencia de T-ADN a las plantas". Microbiología molecular . 17 (2): 259–269. doi :10.1111/j.1365-2958.1995.mmi_17020259.x. PMID 7494475. S2CID 38483513.
- ^ Heinemann, Jack A.; Sprague, George F. (julio de 1989). "Los plásmidos conjugativos bacterianos movilizan la transferencia de ADN entre bacterias y levaduras". Nature . 340 (6230): 205–209. Bibcode :1989Natur.340..205H. doi :10.1038/340205a0. PMID 2666856. S2CID 4351266.
- ^ Kunik, Tayla; Tzfira, Tzvi; Kapulnik, Yoram; Gafni, Yedidya; Dingwall, Colin; Citovsky, Vitaly (13 de febrero de 2001). "Transformación genética de células HeLa por Agrobacterium". Actas de la Academia Nacional de Ciencias . 98 (4): 1871–1876. Bibcode :2001PNAS...98.1871K. doi : 10.1073/pnas.041327598 . PMC 29349 . PMID 11172043.
- ^ Waters, Virginia L. (diciembre de 2001). "Conjugación entre células bacterianas y mamíferas". Nature Genetics . 29 (4): 375–6. doi :10.1038/ng779. PMID 11726922. S2CID 27160.
- ^ Karas, Bogumil J.; Diner, Rachel E.; Lefebvre, Stephane C.; McQuaid, Jeff; Phillips, Alex PR; Noddings, Chari M.; Brunson, John K.; Valas, Ruben E.; Deerinck, Thomas J. (21 de abril de 2015). "Episomas de diatomeas de diseño liberados por conjugación bacteriana". Nature Communications . 6 : 6925. Bibcode :2015NatCo...6.6925K. doi :10.1038/ncomms7925. ISSN 2041-1723. PMC 4411287 . PMID 25897682.
- ^ Yoon, Young Geol; Koob, Michael D. (2005). "Transformación de mitocondrias de mamíferos aislados por conjugación bacteriana". Investigación de ácidos nucleicos . 33 (16): e139. doi : 10.1093/nar/gni140. PMC 1201378. PMID 16157861.
Enlaces externos
- Conjugación bacteriana (animación Flash)