Crotalus catalinensis
| Crotalus catalinensis | |
|---|---|
 | |
| Clasificación científica | |
| Dominio: | Eucariota |
| Reino: | Animalia |
| Filo: | Cordados |
| Clase: | Reptilia |
| Orden: | Escamas |
| Suborden: | Serpientes |
| Familia: | Viperidae |
| Género: | Crótalo |
| Especies: | C. catalinensis |
| Nombre binomial | |
| Crotalus catalinensis Acantilado, 1954 [2] | |
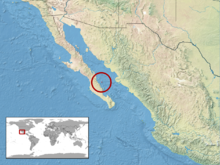 | |
La serpiente de cascabel de Santa Catalina ( Crotalus catalinensis ) es una especie de víbora de foseta endémica de la Isla Santa Catalina en el Golfo de California, justo al lado de la costa este del estado de Baja California Sur , México. Como todas las demás víboras de foseta, es venenosa . Actualmente no se reconocen subespecies . [3] Es una especie relativamente pequeña y delgada, su característica más distintiva es que carece de cascabel. [4] También es una especie generalmente nocturna . [5] Aunque la especie está clasificada como En Peligro Crítico en la Lista Roja de la UICN , hay pocos esfuerzos para la conservación de la serpiente. [1]
Descripción
Esta especie es relativamente delgada y atrofiada, creciendo hasta un máximo de 73,1 cm (2 pies 4,8 pulgadas) de longitud. [4]
La característica más distintiva de esta serpiente es la falta de cascabel. La base de la cola, el "botón", se ha degenerado hasta tal punto que el cascabel se cae inmediatamente con cada muda en lugar de formar un nuevo segmento, como ocurre en otras especies de serpientes de cascabel. Se cree ampliamente que se trata de una adaptación localizada , ya que el cascabel se convierte en una desventaja en lugar de una ventaja durante la caza. [6] [7] La falta de grandes depredadores o mamíferos ungulados en su entorno natural también ha influido en que el cascabel sea redundante. Parece que Crotalus catalinensis puede no ser el único que siente estas presiones selectivas, ya que las serpientes de cascabel de diamante rojo en la isla de San Lorenzo Sur y las serpientes de cascabel de cola negra de la isla de San Esteban también parecen estar perdiendo sus cascabeles. Cabe destacar que parece que este fenómeno se limita a poblaciones limitadas a islas en el Golfo de California . [8]
La selección natural también le ha dado a esta serpiente un cuerpo más alargado que el de las formas continentales relacionadas, y dientes considerablemente más largos; ambas son características asociadas con las serpientes que cazan en árboles y arbustos como esta especie. Esta especie también carece de la táctica estándar de morder y soltar empleada por las serpientes de cascabel habituales, prefiriendo en cambio mantener a la presa en sus mandíbulas hasta que el veneno pueda hacer efecto. De esta manera, evita la posibilidad de que la presa se caiga o salga volando antes de sucumbir.
De las dos variaciones de color distintas, la variante predominante tiene una base de color crema claro, con manchas de color marrón rojizo en la espalda y bandas blancas y negras alrededor de la cola. La otra variante tiene un color gris ceniza mucho más claro, con manchas grises más oscuras. Las bandas alrededor de la cola todavía están presentes. Las bandas se estrechan y se vuelven más oscuras. Originalmente se pensó que los dos colores diferentes se debían a la selección natural y, por lo tanto, coincidían con diferentes antecedentes de hábitat, pero eso no ha sido confirmado. No hay diferencia entre el marrón y el gris dentro del hábitat, así como tampoco hay diferencia en la frecuencia de color entre machos y hembras. [5] Sin embargo, la evidencia sugiere que la coloración más oscura de las serpientes las hace más adaptables debido a su capacidad para tomar el sol y absorber más calor. Esto hace que su metabolismo se acelere, lo que les proporciona una digestión más rápida que ayuda a aumentar la fuerza y las condiciones físicas. Debido a estos factores, las serpientes de color más oscuro tienen un mayor éxito reproductivo que las serpientes de color más claro. Aunque las serpientes oscuras tienen estas ventajas, su coloración tiene un costo porque los depredadores las detectan más fácilmente que las serpientes de color arena. [9]
Distribución geográfica
Esta serpiente se encuentra únicamente en la Isla Santa Catalina en el Golfo de California frente a la costa sur de Baja California. Esta isla también es la localidad tipo de la especie . [2] La isla es bastante pequeña, ya que tiene solo 43 kilómetros cuadrados (17 millas cuadradas). [10]
Estado de conservación
Esta especie está clasificada como En Peligro Crítico en la Lista Roja de la UICN con los siguientes criterios: B1ab(v) (v3.1, 2001). [1] Esto significa que la mejor evidencia disponible indica que se considera que enfrenta un riesgo extremadamente alto de extinción en estado silvestre porque se estima que su área de distribución geográfica es inferior a 100 km2 ( 39 millas cuadradas), existe en una sola ubicación y se ha observado, inferido o proyectado una disminución continua en el número de individuos maduros. Fue evaluada en 2007. [11]
Está amenazada debido a la recolección y la introducción de especies depredadoras exóticas, como los gatos domésticos . [6] Esta población de gatos invadió anteriormente la isla y desde entonces ha sido erradicada en 2002. [1] No hay garantía de que los gatos no sean reintroducidos en el área, lo que podría causar problemas para la serpiente, ya sea por ser presa de ellos mismos o por la disminución de la población de sus principales fuentes de alimento. [12] La presencia de estos gatos ha afectado negativamente a muchas poblaciones de varias otras especies de reptiles de la isla. [13]
Debido a que la serpiente de cascabel tiene opciones tan limitadas de presas en la isla, es vital mantener las poblaciones de presas para la conservación de C. catalinensis , especialmente porque la principal especie de presa de la serpiente, Peromyscus slevini , es endémica de la isla. [14]
Otras amenazas incluyen la influencia humana, como la matanza por miedo y la captura para la recolección ilegal de especies raras. Debido a que la serpiente de cascabel de Santa Catalina es una especie endémica y no tiene cascabel, la serpiente es más valorada y, por lo tanto, está más amenazada. [13] El clima también afecta a Santa Catalina al influir en la productividad de las plantas, que se relaciona principalmente con las grandes diferencias en la cantidad de lluvia. [5] Las fluctuaciones de temperatura ambiental debido al cambio climático afectan a las serpientes porque son ectotérmicas : la temperatura exterior influye directamente en la temperatura corporal de la serpiente. [9]
Actualmente no existen movimientos hacia la conservación de esta especie. El Parque Nacional Bahía de Loreto consideró a la serpiente de cascabel como "muy difícil de observar", lo que se suma a la falta de esfuerzos de conservación. Debido a que esta especie es endémica de la isla y el territorio es bastante pequeño, siendo el área de 40,99 km 2 , las serpientes se enfrentan a una posible endogamia , estocasticidad demográfica y ambiental , y más. Sin embargo, no existen estudios, hasta 2005, que respalden estas especulaciones. [13]
Cada una de estas amenazas, junto con las características biológicas de la especie: maduración tardía, crecimiento lento, pocas crías y largos períodos de tiempo entre cada período reproductivo, contribuyen a la vulnerabilidad de la especie. [13] Los esfuerzos de conservación de los hábitats de la isla Santa Catalina, así como de las presas de C. catalinensis, mejorarían el riesgo de extinción de la serpiente de cascabel. [14]
Hábitat
El hábitat de la isla Santa Catalina consiste en plantas desérticas de la Costa del Golfo. Esta serpiente se encuentra a menudo en el lado occidental de la isla dentro de los numerosos arroyos . [6] La serpiente de cascabel de Santa Catalina también se encuentra en llanuras, fondos de barrancos y lechos de arroyos. Se encuentran en las cimas de las colinas rocosas donde a menudo encuentran refugio en las grietas de las rocas. Una de las principales opciones de refugio es la vegetación densa que también puede usarse como una forma eficiente de encontrar presas. [5] Se cree que las serpientes encuentran refugio en la vegetación para ayudar a mantener una temperatura corporal constante y también usan la densidad para esconderse de los depredadores. [9]
Comportamiento
Aunque la mayoría de los miembros de este género , Crotalus , son casi completamente terrestres debido a su pesada estructura corporal, el pequeño tamaño de esta especie la convierte en una trepadora rápida y hábil. Investigadores anteriores plantearon la hipótesis de que la capacidad de la serpiente de cascabel de Santa Catalina para trepar, combinada con su falta de cascabel, le permitía cazar pájaros que se posaban en ella, [6] pero una investigación detallada de la dieta de la especie ha revelado que la serpiente de cascabel de Santa Catalina mantiene una dieta basada en mamíferos como la mayoría de las serpientes de cascabel. [7] Una investigación más profunda del comportamiento arbóreo de esta especie isleña ha demostrado que los individuos en realidad pasan la mayor parte de su tiempo en el suelo. [15] Lo más probable es que los individuos se encuentren en las ramas bajas de los arbustos durante julio, el mes más caluroso de la isla. Se cree que la serpiente de cascabel de Santa Catalina trepa desde el suelo caliente hasta los arbustos para termorregularse. [15] La serpiente expresa un comportamiento termoconformista, lo que significa que su temperatura corporal se correlaciona con la temperatura del suelo. Este es un rasgo común entre otras serpientes de cascabel. [9]
A diferencia de la mayoría de las especies de serpientes de cascabel, la serpiente de cascabel de Santa Catalina suele observarse expuesta; no tiende a esconderse. Actualmente, la mayor evidencia apoya la teoría de que la serpiente de cascabel de Santa Catalina ha evolucionado y ha dejado de tener cascabel porque no necesita un mecanismo de advertencia contra los depredadores. [15]
Aunque anteriormente se pensaba que las serpientes presentaban hábitos diurnos y nocturnos , más evidencias sugieren que son completamente nocturnas, incluso durante los meses de invierno. La serpiente de cascabel de Santa Catalina no hiberna.
Alimentación
Las teorías anteriores [6] sugirieron que la tendencia de esta serpiente de cascabel a trepar a arbustos bajos estaba relacionada con un cambio en su dieta hacia el consumo de aves. Sin embargo, los estudios realizados entre 2002 y 2004 revelaron que el contenido estomacal y fecal estaba compuesto en un 70% por mamíferos (ratón ciervo de Santa Catalina, Peromyscus slevini ) y en un 30% por especies de lagartos (iguana del desierto de Santa Catalina, Dipsosaurus catalinensis ; lagartija manchada lateral de Santa Catalina, Uta squamata ; y Sceloporus lineatulus ). “No encontramos restos de aves en los excrementos ni en el contenido estomacal de C. catalinensis en ningún año ni temporada”. [7]

La dieta de esta serpiente de cascabel es una fracción de la dieta de su pariente más cercano, la serpiente de cascabel de diamante rojo, Crotalus ruber . C. ruber , como la mayoría de las serpientes de cascabel, con frecuencia se alimenta de lagartijas y pequeños mamíferos como ratones, ratas y ardillas. También se sabe que C. ruber come ranas, sapos, pájaros y otras serpientes. La dieta restringida de la serpiente de cascabel de Santa Catalina en comparación con su especie hermana probablemente se deba a la limitada diversidad de presas en la isla. [14] El pequeño tamaño corporal de la serpiente de cascabel de Santa Catalina puede ser una respuesta evolutiva a su dependencia de presas de tamaño pequeño. [16] Por ejemplo, la presa principal es el ratón de venado endémico de Santa Catalina, Peromyscus slevini , que mide hasta 21 cm (8,3 pulgadas) de longitud total incluida la cola, que mide 10 centímetros (3,9 pulgadas). [17]
Al igual que otras especies de serpientes de cascabel del centro y norte de México, la serpiente de cascabel de Santa Catalina tiene una mayor actividad de alimentación durante el verano y la temporada de lluvias (julio-octubre). [18]
Taxonomía
Laurence Klauber (1972) sugirió que esta especie está estrechamente relacionada con C. scutulatus . Sin embargo, un estudio posterior de Murphy y Crabtree (1985) utilizó datos de alozimas para concluir que la serpiente de cascabel de Santa Catalina comparte su ancestro más reciente con C. ruber . La mayoría de los datos morfológicos, biogeográficos y bioquímicos sugieren lo mismo. [4]
Referencias
- ^ abcd Avila Villegas, H.; Frost, DR; Arnaud, G. (2007). "Crotalus catalinensis". Lista Roja de Especies Amenazadas de la UICN . 2007 : e.T64314A12764544. doi : 10.2305/IUCN.UK.2007.RLTS.T64314A12764544.en . Consultado el 11 de junio de 2024 .
- ^ ab McDiarmid RW, Campbell JA, Touré T. 1999. Especies de serpientes del mundo: una referencia taxonómica y geográfica, vol. 1. Herpetologists' League. 511 pp. ISBN 1-893777-00-6 (serie). ISBN 1-893777-01-4 (volumen).
- ^ "Crotalus catalinensis". Sistema Integrado de Información Taxonómica . Consultado el 11 de febrero de 2007 .
- ^ abc Campbell JA, Lamar WW. 2004. Los reptiles venenosos del hemisferio occidental. Comstock Publishing Associates, Ithaca y Londres. 870 pp. 1500 láminas. ISBN 0-8014-4141-2 .
- ^ abcd Islas y serpientes: aislamiento y evolución adaptativa . Oxford University Press, Incorporated, Oxford: Oxford University Press, Incorporated, Oxford. 2019. págs. 241–257. ISBN 9780190676414.
- ^ abcde Crotalus catalinensis en el Museo de Historia Natural de San Diego. Consultado el 11 de febrero de 2007.
- ^ abc Avila-Villegas H, Martins M, Arnaud G. 2007. Ecología alimentaria de la serpiente de cascabel endémica, Crotalus catalinenis, de la isla Santa Catalina, Golfo de California, México. Sociedad Estadounidense de Ictiólogos y Herpetólogos (1):80-84 2007. https://www.researchgate.net/publication/236897092_Ecología_alimentaria_de_la_serpiente_de_cascabel_sin_cascabel_endémica_Crotalus_catalinensis_de_la_isla_Santa_Catalina_del_golfo_de_California_México?ev=prf_pub http://www.bioone.org/doi/full/10.1643/0045 -8511%282007%297%5B80%3AFEOTER%5D2.0.CO%B2
- ^ Mattison, Chris (1995). La enciclopedia de las serpientes . Hong Kong: Checkmark Books Un sello editorial de Facts On File, Inc. p. 128. ISBN 0816039313.
- ^ abcd Arnaud, Gustavo; Sandoval, Sarahi; Escobar, Jonathan; Gómez-Muñoz, Victor (18 de octubre de 2022). "Ecología térmica de la serpiente de cascabel Crotalus catalinensis de la isla Santa Catalina, Golfo de California". Puerta de investigación . Consultado el 18 de octubre de 2022 .
- ^ Case, Ted J.; Cody, Martin L. (1 de enero de 1983). Biogeografía insular en el mar de Cortés. University of California Press. ISBN 978-0-520-04799-0.
- ^ Categorías y criterios de 2001 (versión 3.1) en la Lista Roja de la UICN . Consultado el 13 de septiembre de 2007.
- ^ Martín, Marcio; Arnaud, Gustavo; Ávila-Villegas, Héctor (31 de diciembre de 2012). "Reclutamiento juvenil, crecimiento temprano y variación morfológica de la serpiente de cascabel de Santa Catalina, Crotalus Catalinensis, en peligro de extinción". Puerta de investigación .
- ↑ abcd Ávila Villegas, Héctor (2005). "Aspectos ecológicos de la serpiente de cascabel de la Isla Santa Catalina Crotalus catalinensis, Golfo de California, México". Centro de Investigaciones Biológicas del Noroeste, sc . Consultado el 20 de octubre de 2022 .
- ^ abc Ávila-Villegas, Héctor; Martíns, Marcio; Arnaud, Gustavo (febrero de 2007). "Ecología alimentaria de la serpiente de cascabel endémica, Crotalus catalinensis, de la isla Santa Catalina, Golfo de California, México". Copeía . 2007 (1): 80–84. doi :10.1643/0045-8511(2007)7[80:FEOTER]2.0.CO;2. ISSN 0045-8511. S2CID 56217314.
- ^ abc Martins M, Arnaud G, Murillo-Quero R. 2008. Exploración de hipótesis sobre la pérdida del cascabel en las serpientes de cascabel: ¿Cuán arbórea es la serpiente de cascabel sin cascabel de Isla Santa Catalina, Crotalus catalinensis? Revista Sudamericana de Herpetología, 3(2),2008,162-167
- ^ Boback, Scott M. (febrero de 2003). "Evolución del tamaño corporal en serpientes: evidencia de poblaciones insulares". Copeia . 2003 (1): 81–94. doi :10.1643/0045-8511(2003)003[0081:BSEISE]2.0.CO;2. ISSN 0045-8511. S2CID 34472225.
- ^ Álvarez-Castañeda, Sergio Ticul; Arnaud, Gustavo; Cortés-Calva, Patricia; Méndez, Lia (1 de marzo de 2010). "Migración invasora de un roedor continental a la isla santa catalina y su efecto sobre la especie endémica Peromyscus slevini". Invasiones biológicas . 12 (3): 437–439. doi :10.1007/s10530-009-9466-8. ISSN 1573-1464. S2CID 19525266.
- ^ Ávila-Villegas, Héctor; Arnaud, Gustavo; Martins, Marcio (junio de 2014). "Patrón de dieta y actividad de la serpiente cascabel de la isla Santa Catalina Crotalus catalinensis". Puerta de investigación . Consultado el 19 de octubre de 2022 .
Lectura adicional
- Murphy RW, Crabtree B. 1985. Relaciones genéticas de la serpiente de cascabel sin cascabel de la isla Santa Catalina. Acta Zool. Mex. (ns) 9. 16 págs.
- Ávila-Villegas, H. 2005. Aspectos ecológicos de la serpiente de cascabel de la Isla Santa Catalina, Crotalus catalinensis / Ecologic Aspects of the Santa Catalina Island Rattlesnake, Crotalus catalinensis
Enlaces externos
- Crotalus catalinensis en la base de datos de reptiles Reptarium.cz. Consultado el 12 de diciembre de 2007.
