Escleractinia
| Corales pétreos Rango temporal: | |
|---|---|
 | |
| Corales escleractinios, ilustración de Ernst Haeckel , 1904 | |
| Clasificación científica | |
| Dominio: | Eucariota |
| Reino: | Animalia |
| Filo: | Cnidarios |
| Clase: | Hexacoralia |
| Orden: | Escleractinia Bourne , 1900 [2] |
| Familias | |
Aproximadamente 35, ver texto. | |
| Sinónimos | |
| |
Los escleractinios , también llamados corales pétreos o corales duros , son animales marinos del filo Cnidaria que construyen un esqueleto duro . Los animales individuales se conocen como pólipos y tienen un cuerpo cilíndrico coronado por un disco oral en el que una boca está bordeada de tentáculos. Aunque algunas especies son solitarias, la mayoría son coloniales . El pólipo fundador se asienta y comienza a secretar carbonato de calcio para proteger su cuerpo blando. Los corales solitarios pueden medir hasta 25 cm (10 pulgadas) de ancho, pero en las especies coloniales los pólipos suelen tener solo unos pocos milímetros de diámetro. Estos pólipos se reproducen asexualmente por gemación , pero permanecen unidos entre sí, formando una colonia de clones de múltiples pólipos con un esqueleto común, que puede tener hasta varios metros de diámetro o altura según la especie.
La forma y apariencia de cada colonia de coral depende no solo de la especie, sino también de su ubicación, profundidad, la cantidad de movimiento del agua y otros factores. Muchos corales de aguas poco profundas contienen organismos unicelulares simbiontes conocidos como zooxantelas dentro de sus tejidos. Estos dan su color al coral, que por lo tanto puede variar en tono dependiendo de qué especie de simbionte contenga. Los corales pétreos están estrechamente relacionados con las anémonas de mar y, como ellas, están armados con células urticantes conocidas como cnidocitos . Los corales se reproducen tanto sexual como asexualmente. La mayoría de las especies liberan gametos en el mar donde tiene lugar la fertilización, y las larvas de plánula se desplazan como parte del plancton , pero unas pocas especies incuban sus huevos. La reproducción asexual es principalmente por fragmentación , cuando parte de una colonia se desprende y se vuelve a unir en otro lugar.
Los corales pétreos se encuentran en todos los océanos del mundo. Gran parte de la estructura de los arrecifes de coral modernos está formada por escleractinios. Los corales formadores de arrecifes o hermatípicos son en su mayoría coloniales; la mayoría de ellos son zooxantelados y se encuentran en aguas poco profundas en las que penetra la luz solar. Otros corales que no forman arrecifes pueden ser solitarios o coloniales; algunos de ellos se encuentran en profundidades abisales donde no llega la luz.
Los corales pétreos aparecieron por primera vez en el Triásico medio , pero su relación con los corales tabulados y rugosos del Paleozoico aún no está resuelta. En la actualidad, se espera que la cantidad de corales pétreos disminuya debido a los efectos del calentamiento global y la acidificación de los océanos . [4]
Anatomía
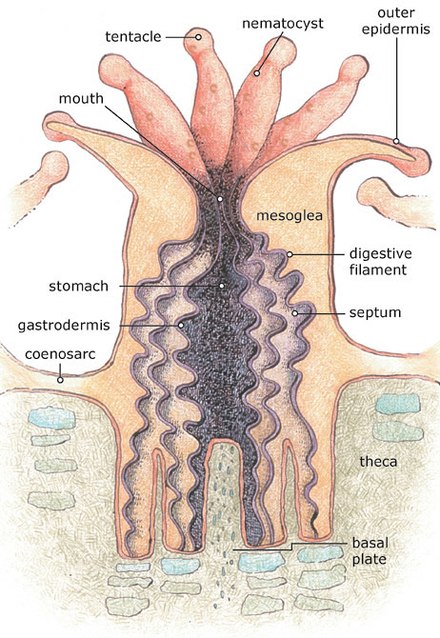
Los corales escleractinios pueden ser solitarios o coloniales . Las colonias pueden alcanzar un tamaño considerable y estar formadas por una gran cantidad de pólipos individuales.
Partes blandas
Los corales pétreos son miembros de la clase Anthozoa y, al igual que otros miembros del grupo, no tienen una etapa de medusa en su ciclo de vida. Los animales individuales se conocen como pólipos y tienen un cuerpo cilíndrico coronado por un disco oral rodeado por un anillo de tentáculos . La base del pólipo secreta el material pétreo del que se forma el esqueleto del coral. La pared corporal del pólipo consiste en mesoglea intercalada entre dos capas de epidermis. La boca está en el centro del disco oral y conduce a una faringe tubular que desciende cierta distancia dentro del cuerpo antes de abrirse a la cavidad gastrovascular que llena el interior del cuerpo y los tentáculos. Sin embargo, a diferencia de otros cnidarios, la cavidad está subdividida por una serie de particiones radiales, láminas delgadas de tejido vivo, conocidas como mesenterios . Las gónadas también se encuentran dentro de las paredes de la cavidad. El pólipo es retráctil dentro del coralito , la copa pétrea en la que se encuentra, y es tirado hacia atrás por músculos retractores en forma de lámina. [5]
Los pólipos están conectados por láminas horizontales de tejido conocidas como cenosarco que se extienden sobre la superficie externa del esqueleto y lo cubren por completo. Estas láminas son continuas con la pared corporal de los pólipos e incluyen extensiones de la cavidad gastrovascular, de modo que el alimento y el agua pueden circular entre todos los diferentes miembros de la colonia. [5] En las especies coloniales, la división asexual repetida de los pólipos hace que los coralitos se interconecten, formando así las colonias. También existen casos en los que las colonias adyacentes de la misma especie forman una sola colonia al fusionarse. La mayoría de las especies coloniales tienen pólipos muy pequeños, que van desde 1 a 3 mm (0,04 a 0,12 pulgadas) de diámetro, aunque algunas especies solitarias pueden llegar a medir 25 cm (10 pulgadas). [5]
Esqueleto

El esqueleto de un pólipo escleractinio individual se conoce como coralito. Es secretado por la epidermis de la parte inferior del cuerpo y forma inicialmente una copa que rodea esta parte del pólipo. El interior de la copa contiene placas alineadas radialmente , o septos , que se proyectan hacia arriba desde la base. Cada una de estas placas está flanqueada por un par de mesenterios. [5]
Los septos son secretados por los mesenterios y, por lo tanto, se agregan en el mismo orden en que se agregan los mesenterios. Como resultado, los septos de diferentes edades están adyacentes entre sí y la simetría del esqueleto escleractinio es radial o birradial . Este patrón de inserción septal es denominado "cíclico" por los paleontólogos. Por el contrario, en algunos corales fósiles, los septos adyacentes se encuentran en orden de edad creciente, un patrón denominado serial y produce una simetría bilateral . Los escleractinios secretan un exoesqueleto pétreo en el que los septos se insertan entre los mesenterios en múltiplos de seis. [5]
Todos los esqueletos de escleractinios modernos están compuestos de carbonato de calcio en forma de cristales de aragonito , sin embargo, un escleractinio prehistórico ( Coelosimilia ) tenía una estructura esquelética no aragonita que estaba compuesta de calcita . [6] La estructura de los escleractinios simples y compuestos es ligera y porosa, en lugar de sólida como es el caso en el orden prehistórico Rugosa . Los escleractinios también se distinguen de los rugosos por su patrón de inserción septal. [7]
Crecimiento


En los corales coloniales, el crecimiento resulta de la gemación de nuevos pólipos. Existen dos tipos de gemación, intratentacular y extratentacular. En la gemación intratentacular, se desarrolla un nuevo pólipo en el disco oral, dentro del anillo de tentáculos. Esto puede formar pólipos individuales y separados o una fila de pólipos parcialmente separados que comparten un disco oral alargado con una serie de bocas. Los tentáculos crecen alrededor del margen de este disco oral alargado y no alrededor de las bocas individuales. Este está rodeado por una única pared coralítica, como es el caso de los coralitos meandroides de los corales cerebro. [5]
La gemación extratentacular siempre da como resultado pólipos separados, cada uno con su propia pared de coralitos. En el caso de los corales tupidos como Acropora , la gemación lateral de los pólipos axiales forma la base del tronco y las ramas. [5] La velocidad a la que una colonia de coral pétreo deposita carbonato de calcio depende de la especie, pero algunas de las especies ramificadas pueden aumentar en altura o longitud alrededor de 10 cm (4 pulgadas) al año (aproximadamente la misma velocidad a la que crece el cabello humano). Otros corales, como las especies de domo y placa, son más voluminosos y pueden crecer solo de 0,3 a 2 cm (0,1 a 0,8 pulgadas) por año. [8] La tasa de deposición de aragonito varía diurna y estacionalmente. El examen de secciones transversales de coral puede mostrar bandas de deposición que indican crecimiento anual. Al igual que los anillos de los árboles, estos se pueden utilizar para estimar la edad del coral. [5]
Los corales solitarios no producen gemación, sino que aumentan gradualmente de tamaño a medida que depositan más carbonato de calcio y producen nuevos verticilos de septos. Un Ctenactis echinata grande , por ejemplo, normalmente tiene una sola boca, puede medir unos 25 cm (10 pulgadas) de largo y tener más de mil septos. [9]
Distribución
Los corales pétreos se encuentran en todos los océanos del mundo. Hay dos grupos ecológicos principales. Los corales hermatípicos son en su mayoría corales coloniales que tienden a vivir en aguas tropicales claras, oligotróficas y poco profundas ; son los principales constructores de arrecifes del mundo . Los corales ahermatípicos son coloniales o solitarios y se encuentran en todas las regiones del océano y no forman arrecifes. Algunos viven en aguas tropicales, pero otros habitan mares templados , aguas polares o viven a grandes profundidades, desde la zona fótica hasta unos 6.000 m (20.000 pies). [10]
Ecología

Los escleractinios se dividen en dos categorías principales:
- Corales formadores de arrecifes o hermatípicos , que contienen principalmente zooxantelas;
- Corales no formadores de arrecifes o ahermatípicos, que en su mayoría no contienen zooxantelas.
En los corales que forman arrecifes, las células endodérmicas suelen estar repletas de dinoflagelados unicelulares simbióticos conocidos como zooxantelas . A veces hay hasta cinco millones de células de estos dinoflagelados por centímetro cuadrado (0,16 pulgadas cuadradas) de tejido coralino. Hasta el 50% de los compuestos orgánicos producidos por los simbiontes son utilizados como alimento por los pólipos. El oxígeno subproducto de la fotosíntesis y la energía adicional derivada de los azúcares producidos por las zooxantelas permiten a estos corales crecer a un ritmo hasta tres veces más rápido que las especies similares sin simbiontes. Estos corales suelen crecer en aguas poco profundas, bien iluminadas y cálidas con turbulencias moderadas a rápidas y oxígeno abundante, y prefieren superficies firmes y no fangosas en las que asentarse. [5]
La mayoría de los corales pétreos extienden sus tentáculos para alimentarse de zooplancton , pero aquellos con pólipos más grandes capturan presas correspondientemente más grandes, incluidos varios invertebrados e incluso peces pequeños. Además de capturar presas de esta manera, muchos corales pétreos también producen películas de moco que pueden mover sobre sus cuerpos usando cilios ; estos atrapan pequeñas partículas orgánicas que luego son atraídas hacia y dentro de la boca. En algunos corales pétreos, este es el método principal de alimentación, y los tentáculos son reducidos o ausentes, un ejemplo es Acropora acuminata . [5] Los corales pétreos del Caribe son generalmente nocturnos, con los pólipos retrayéndose en sus esqueletos durante el día, maximizando así la exposición de las zooxantelas a la luz, pero en la región del Indo-Pacífico, muchas especies se alimentan de día y de noche. [5]
Los corales no zooxantelados no suelen formar arrecifes; se encuentran en mayor abundancia por debajo de los 500 m (1600 pies) de profundidad. Prosperan a temperaturas mucho más frías y pueden vivir en total oscuridad, obteniendo su energía de la captura de plancton y partículas orgánicas en suspensión. Las tasas de crecimiento de la mayoría de las especies de corales no zooxantelados son significativamente más lentas que las de sus contrapartes, y la estructura típica de estos corales está menos calcificada y es más susceptible a daños mecánicos que la de los corales zooxantelados. [8]
Anteriormente se creía que los escleratinianos eran huéspedes obligatorios de otro grupo de percebes, los pirgomátidos, pero un estudio reciente registró evidencia de pirgomátidos vivos en estilasteridos, lo que pone en duda esta idea. [11]
Ciclo vital

Los corales pétreos tienen una gran variedad de estrategias reproductivas y pueden reproducirse tanto sexual como asexualmente. Muchas especies tienen sexos separados, y toda la colonia es masculina o femenina, pero otras son hermafroditas , y cada pólipo tiene gónadas masculinas y femeninas. [13] Algunas especies incuban sus huevos, pero en la mayoría de las especies, la reproducción sexual da como resultado la producción de una larva plánula que nada libremente y que finalmente se asienta en el fondo marino para sufrir una metamorfosis en un pólipo. En las especies coloniales, este pólipo inicial luego se divide repetidamente de manera asexual, para dar lugar a toda la colonia. [5]
Reproducción asexual

El método más común de reproducción asexual en los corales pétreos coloniales es la fragmentación. Los fragmentos de corales ramificados pueden desprenderse durante tormentas, por fuertes movimientos del agua o por medios mecánicos, y los fragmentos caen al fondo marino. En condiciones adecuadas, estos son capaces de adherirse al sustrato y dar origen a nuevas colonias. Incluso corales tan grandes como Montastraea annularis han demostrado ser capaces de formar nuevas colonias después de la fragmentación. [13] Este proceso se utiliza en la afición de los acuarios de arrecife para aumentar la población sin necesidad de cosechar corales de la naturaleza. [14]
En condiciones adversas, ciertas especies de coral recurren a otro tipo de reproducción asexual en forma de "rescate de pólipos", que puede permitir que los pólipos sobrevivan incluso si la colonia original muere. Implica el crecimiento del cenosarco para sellar los pólipos, el desprendimiento de los pólipos y su asentamiento en el fondo marino para iniciar nuevas colonias. [15] En otras especies, pequeñas bolas de tejido se desprenden del cenosarco, se diferencian en pólipos y comienzan a secretar carbonato de calcio para formar nuevas colonias, y en Pocillopora damicornis , los huevos no fertilizados pueden convertirse en larvas viables. [13]
Reproducción sexual
La gran mayoría de los taxones de escleractinios son hermafroditas en sus colonias adultas. [16] En las regiones templadas, el patrón habitual es la liberación sincronizada de huevos y espermatozoides en el agua durante breves eventos de desove , a menudo relacionados con las fases de la luna. [17] En las regiones tropicales, la reproducción puede ocurrir durante todo el año. En muchos casos, como en el género Acropora , los huevos y los espermatozoides se liberan en haces flotantes que suben a la superficie. Esto aumenta la concentración de espermatozoides y huevos y, por lo tanto, la probabilidad de fertilización , y reduce el riesgo de autofecundación. [13] Inmediatamente después del desove, los huevos se retrasan en su capacidad de fertilización hasta después de la liberación de los cuerpos polares. Este retraso, y posiblemente cierto grado de autoincompatibilidad, probablemente aumenta la posibilidad de fertilización cruzada. Un estudio de cuatro especies de Scleractinia encontró que la fertilización cruzada era en realidad el patrón de apareamiento dominante, aunque tres de las especies también eran capaces de autofecundación en diversos grados. [16]
Historia evolutiva

Hay poca evidencia en la que basar una hipótesis sobre el origen de los escleractinios; se sabe mucho sobre las especies modernas pero muy poco sobre los especímenes fósiles , que aparecieron por primera vez en el registro en el Triásico Medio ( hace 240 millones de años ). [1] No fue hasta 25 millones de años después que se convirtieron en importantes constructores de arrecifes, su éxito probablemente fue el resultado de asociarse con algas simbióticas . [18] Nueve de los subórdenes existían al final del Triásico y tres más habían aparecido en el Jurásico (hace 200 millones de años), con un suborden adicional que apareció en el Cretácico Medio (hace 100 millones de años). [10] Algunos pueden haberse desarrollado a partir de un ancestro común, ya sea un coral similar a una anémona sin esqueleto o un coral rugoso . Un coral rugoso parece un ancestro común improbable porque estos corales tenían esqueletos de calcita en lugar de aragonito, y los septos estaban dispuestos en serie en lugar de cíclicamente. Sin embargo, es posible que las similitudes entre los escleractinios y los rugosos se deban a un ancestro común no esqueletizado en el Paleozoico temprano. Alternativamente, los escleractinios pueden haberse desarrollado a partir de un ancestro similar a Corallimorpharia . Parece que la esqueletogénesis puede haber estado asociada con el desarrollo de la simbiosis y la formación de arrecifes, y puede haber ocurrido en más de una ocasión. La secuenciación del ADN parece indicar que los corales escleractinios son un grupo monofilético . [19]

Los primeros escleractinios no eran constructores de arrecifes, sino individuos pequeños, facelidos o solitarios. Los corales escleractinios probablemente alcanzaron su mayor diversidad en el Jurásico y prácticamente desaparecieron en el evento de extinción masiva al final del Cretácico, sobreviviendo alrededor de 18 de los 67 géneros. [19] Los corales paleozoicos descubiertos recientemente con esqueletos aragoníticos e inserción septal cíclica (dos características que caracterizan a Scleractinia) han fortalecido la hipótesis de un origen independiente de Scleractinia. [20] Si los primeros corales escleractinios eran zooxantelados es una pregunta abierta. El fenómeno parece haber evolucionado independientemente en numerosas ocasiones durante el Terciario, y los géneros Astrangia , Madracis , Cladocora y Oculina , todos en familias diferentes, tienen miembros zooxantelados y no zooxantelados. [19]
El hecho de que los corales zooxantelados representen solo la mitad de este orden es inusual, ya que la simbiosis es casi siempre un fenómeno de todo o nada. Este equilibrio simbiótico sugiere que debe haber procesos evolutivos que mantengan y limiten simultáneamente las relaciones simbióticas. Esto probablemente se deba a que, a pesar de los beneficios energéticos que proporciona, la fotosimbiosis parece ser una desventaja evolutiva durante las extinciones masivas. [21] Los rasgos que generalmente permiten que los corales sobrevivan a las extinciones masivas incluyen la amplitud de hábitat en aguas profundas o amplias, la no simbiosis, las colonias solitarias o pequeñas y la resistencia al blanqueamiento, todos los cuales tienden a caracterizar a los corales azooxantelados (no simbióticos). [22] Los endosimbiontes, por otro lado, que dependen de condiciones especializadas y del acceso a la luz para sobrevivir, son especialmente vulnerables a la oscuridad prolongada, los cambios de temperatura y la eutrofización, todos los cuales han sido características de las extinciones masivas pasadas. [23] Esto hace que los corales zooxantelados sean especialmente vulnerables a las condiciones inestables. Por lo tanto, es posible que el coral y el zooxantelado hayan coevolucionado de manera flexible, disolviéndose la relación cuando las ventajas disminuyeron y volviéndose a formar cuando las condiciones se estabilizaron. [24]
Clasificación
_(16744305176).jpg/440px-An_account_of_the_deep-sea_Madreporaria_collected_by_the_Royal_Indian_Marine_Survey_ship_Investigator_(1898)_(16744305176).jpg)
La taxonomía de Scleractinia es particularmente desafiante. Muchas especies fueron descritas antes de la llegada del buceo , sin que los autores se dieran cuenta de que las especies de coral podían tener morfologías variables en diferentes hábitats. Los recolectores se limitaban principalmente a observar corales en los bancos de arrecifes y no podían observar los cambios en la morfología que ocurrían en condiciones de aguas más turbias y profundas. Más de 2000 especies nominales fueron descritas en esta era, y según las reglas de nomenclatura, el nombre dado a la primera especie descrita tiene precedencia sobre el resto, incluso cuando esa descripción es pobre y se desconoce el entorno e incluso a veces el país del espécimen tipo . [25]
Incluso el concepto de "especie" es sospechoso en el caso de los corales, que tienen amplias áreas geográficas con varias subpoblaciones; sus límites geográficos se fusionan con los de otras especies; sus límites morfológicos se fusionan con los de otras especies; y no hay distinciones definidas entre especies y subespecies. [26]
Las relaciones evolutivas entre los corales pétreos fueron examinadas por primera vez en el siglo XIX y principios del XX. Las dos clasificaciones más avanzadas del siglo XIX utilizaron caracteres esqueléticos complejos; la clasificación de 1857 de los zoólogos franceses Henri Milne-Edwards y Jules Haime se basó en caracteres esqueléticos macroscópicos, mientras que el esquema de 1897 de Francis Grant Ogilvie se desarrolló utilizando observaciones de microestructuras esqueléticas, con especial atención a la estructura y el patrón de las trabéculas septales . [27] En 1943, los zoólogos estadounidenses Thomas Wayland Vaughan y John West Wells , y Wells nuevamente en 1956, utilizaron los patrones de las trabéculas septales para dividir el grupo en cinco subórdenes . Además, consideraron características polipoides como el crecimiento de los tentáculos. También distinguieron familias por tipo de pared y tipo de gemación . [27]
La clasificación de 1952 del zoólogo francés J. Alloiteau se basó en estos sistemas anteriores, pero incluyó más observaciones microestructurales y no involucró los caracteres anatómicos del pólipo. Alloiteau reconoció ocho subórdenes. [27] En 1942, WH Bryan y D. Hill destacaron la importancia de las observaciones microestructurales al proponer que los corales pétreos comienzan el crecimiento esquelético configurando centros de calcificación, que se derivan genéticamente. Por lo tanto, diversos patrones de centros de calcificación son vitales para la clasificación. [27] Alloiteau demostró más tarde que las clasificaciones morfológicas establecidas no estaban equilibradas y que había muchos ejemplos de evolución convergente entre fósiles y taxones recientes . [26]
El auge de las técnicas moleculares a finales del siglo XX impulsó nuevas hipótesis evolutivas que eran diferentes de las basadas en datos esqueléticos. Los resultados de los estudios moleculares explicaron una variedad de aspectos de la biología evolutiva de Scleractinia, incluidas las conexiones entre y dentro de los taxones existentes, y proporcionaron apoyo a las hipótesis sobre los corales existentes que se basan en el registro fósil. [27] El análisis de ARN mitocondrial de 1996 realizado por los zoólogos estadounidenses Sandra Romano y Stephen Palumbi encontró que los datos moleculares respaldaban el ensamblaje de especies en las familias existentes , pero no en los subórdenes tradicionales. Por ejemplo, algunos géneros afiliados a diferentes subórdenes ahora se ubicaban en la misma rama de un árbol filogenético . Además, no hay un carácter morfológico distintivo que separe a los clados , solo diferencias moleculares. [26]
El zoólogo australiano John Veron y sus colaboradores analizaron el ARN ribosómico en 1996 para obtener resultados similares a los de Romano y Palumbi, concluyendo nuevamente que las familias tradicionales eran plausibles pero que los subórdenes eran incorrectos. También establecieron que los corales pétreos son monofiléticos, incluyendo a todos los descendientes de un ancestro común , pero que se dividen en dos grupos, los clados robustos y complejos. [27] Veron sugirió que se utilizaran tanto sistemas morfológicos como moleculares en futuros esquemas de clasificación. [26]
Conservación
Todos los corales escleractinios (excluidos los fósiles) están incluidos en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES), lo que significa que su comercio internacional (incluso en partes y derivados) está regulado. [3]
Familias
El Registro Mundial de Especies Marinas incluye las siguientes familias en el orden Scleractinia. Algunas especies no han sido clasificadas ( Incertae sedis ): [28]
- Acropóridos
- Agaricidae
- †Agathiphylliidae
- Antemifilidos
- Astroceniidae
- Cariofilidos
- Coscinaraeidae
- Deltociatidos
- Dendrophylliidae
- Diploastreidae
- Euphylliidae
- Flabélidos
- Fungiaciathidae
- Fungiidae
- Gardineriidae
- Guyniidae
- Lobophylliidae
- Meandrínidos
- Merulínidos
- Microbacidos
- Montastridae
- Músidos
- Oculínidos
- †Oulastreidae
- Plesiastreidae
- Pocillopóridos
- Porítidos
- Psammocóridos
- Rhizangiidae
- Esquizociatidos
- Siderastreidae
- Estenociatidos
- †Estilínidos
- Turbinólidos
Véase también
Referencias
- ^ ab Stanley, GD La evolución de los corales modernos y su historia temprana. Earth-Science Rev. 60, 195–225 (2003).
- ^ Hoeksema, Bert (2015). "Scleractinia Bourne, 1900". WoRMS . Registro Mundial de Especies Marinas . Consultado el 3 de mayo de 2015 .
- ^ ab "Apéndices | CITES". cites.org . Consultado el 14 de enero de 2022 .
- ^ Los corales formadores de arrecifes pierden terreno frente a sus primos más blandos debido al calentamiento global 24 de marzo de 2013 Scientific American
- ^ abcdefghijkl Ruppert, Edward E.; Fox, Richard, S.; Barnes, Robert D. (2004). Zoología de invertebrados, séptima edición . Cengage Learning. págs. 132–137. ISBN 978-81-315-0104-7.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Stolarski, Jaroslaw; Anders Meibom, Radoslaw Przenioslo y Maciej Mazur; Przeniosło, Radosław; Mazur, Maciej (2007). "Un coral escleractiniano del Cretácico con un esqueleto calcítico". Ciencia . 318 (5847). Asociación Estadounidense para el Avance de la Ciencia: 92–94. Código Bib : 2007 Ciencia... 318... 92S. doi : 10.1126/ciencia.1149237. PMID 17916731. S2CID 22233075.
- ^ Gornitz, Vivien (2009). Enciclopedia de paleoclimatología y ambientes antiguos. Springer Science & Business Media. pág. 199. ISBN 978-1-4020-4551-6.
- ^ ab Piper, Ross (2007), Animales extraordinarios: una enciclopedia de animales curiosos e inusuales , Greenwood Press .
- ^ Chang-feng Dai; Sharon Horng (2009). 台灣石珊瑚誌 [ Fauna de Scleractinia de Taiwán II. El grupo robusto ]. 國立臺灣大學出版中心. pag. 39.ISBN 978-986-01-8745-8.
- ^ ab Romano, Sandra L.; Cairns, Stephen D. (28 de octubre de 2002). "Scleractinia". Proyecto web del árbol de la vida . Consultado el 3 de mayo de 2015 .
- ^ Adi Zweifler; Noa Simon-Blecher; Daniela Pica; Benny KK Chan; Jonathan Roth; Yair Achituv (2020). "Un extraño entre nosotros: la aparición de Cantellius (Balnoidea: Pyrgomatidae), un epibionte de escleractinias en estilasteridos (Hydrozoa)". Revista Zoológica de la Sociedad Linneana . 190 (4): 1077–1094. doi :10.1093/zoolinnean/zlaa017.
- ^ Petersen LE., Kellermann MY, Schupp PJ (2019) "Metabolitos secundarios de microbios marinos: de la química de productos naturales a la ecología química". En: Jungblut S., Liebich V., Bode-Dalby M. (eds) YOUMARES 9 - Los océanos: nuestra investigación, nuestro futuro , páginas 159-180, Springer. doi :10.1007/978-3-030-20389-4_8. ISBN 978-3-030-20388-7 .
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ abcd Maier, Elke (2010). "Historia de vida del coral escleractiniano Seriatopora hystrix: un enfoque genético de poblaciones" (PDF) . Disertación sobre Erlangung des Doktorgrades der Naturwissenschaften der Fakultät für Biologie der Ludwig-Maximilians-Universität München .
- ^ Calfo, Anthony (2008). "Fragmentación de corales: no sólo para principiantes". Revista Reefkeeping . Reef Central . Consultado el 3 de mayo de 2015 .
- ^ Sammarco, Paul W. (1982). "Rescate de pólipos: una respuesta de escape al estrés ambiental y nuevos medios de reproducción en corales". Marine Ecology Progress Series . 10 : 57–65. Bibcode :1982MEPS...10...57S. doi : 10.3354/meps010057 .
- ^ ab Heyward, AJ; Babcock, RC (1986). "Autofecundación y fecundación cruzada en corales escleractinios". Biología marina . 90 (2): 191–195. Código Bibliográfico :1986MarBi..90..191H. doi :10.1007/BF00569127. S2CID 85911200.
- ^ Harrison PL, Babcock RC, Bull GD, Oliver JK, Wallace CC , Willis BL; Babcock; Bull; Oliver; Wallace; Willis (marzo de 1984). "Desove masivo en corales de arrecifes tropicales". Science . 223 (4641): 1186–9. Bibcode :1984Sci...223.1186H. doi :10.1126/science.223.4641.1186. PMID 17742935. S2CID 31244527.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Stanley, GD (1981). "Historia temprana de los corales escleractinios y sus consecuencias geológicas". Geología . 9 (11): 507. Bibcode :1981Geo.....9..507S. doi :10.1130/0091-7613(1981)9<507:EHOSCA>2.0.CO;2.
- ^ abc Veron, John Edward Norwood (1995). Corales en el espacio y el tiempo: la biogeografía y la evolución de los escleractinios. Cornell University Press. págs. 109-120. ISBN 978-0-8014-8263-2.
- ^ Ezaki, Yoichi (1998). "Scleractinia paleozoica: ¿progenitores o experimentos extintos?". Paleobiología . 24 (2). Sociedad Paleontológica: 227–234. doi :10.1666/0094-8373(1998)024[0227:PSPOEE]2.3.CO;2. JSTOR 2401240. S2CID 89177036.
- ^ Simpson, Carl (9 de abril de 2013). "Selección de especies y la macroevolución de la colonialidad y la fotosimbiosis de los corales". Evolution . 67 (6): 1607–1621. doi :10.1111/evo.12083. ISSN 0014-3820. PMID 23730756. S2CID 37450754.
- ^ Dishon, Gal; Grossowicz, Michal; Krom, Michael; Guy, Gilad; Gruber, David F.; Tchernov, Dan (3 de marzo de 2020). "Rasgos evolutivos que permiten a los corales escleractinios sobrevivir a eventos de extinción masiva". Scientific Reports . 10 (1): 3903. Bibcode :2020NatSR..10.3903D. doi :10.1038/s41598-020-60605-2. ISSN 2045-2322. PMC 7054358 . PMID 32127555.
- ^ Barbeitos, MS; Romano, SL; Lasker, HR (14 de junio de 2010). "Pérdida repetida de colonialidad y simbiosis en corales escleractinios". Actas de la Academia Nacional de Ciencias . 107 (26): 11877–11882. Bibcode :2010PNAS..10711877B. doi : 10.1073/pnas.0914380107 . ISSN 0027-8424. PMC 2900674 . PMID 20547851.
- ^ Stanley, George D. (12 de mayo de 2006). "Fotosimbiosis y la evolución de los arrecifes de coral modernos". Science . 312 (5775): 857–858. doi :10.1126/science.1123701. ISSN 0036-8075. PMID 16690848. S2CID 36133573.
- ^ Hopley, David (2011). Enciclopedia de los arrecifes de coral modernos: estructura, forma y proceso. Springer Science & Business Media. págs. 954–957. ISBN 978-90-481-2638-5.
- ^ abcd Veron, John Edward Norwood (1995). Corales en el espacio y el tiempo: la biogeografía y la evolución de los escleractinios. Cornell University Press. págs. 30-31. ISBN 978-0-8014-8263-2.
- ^ abcdef Stolarski, Jarosław; Roniewicz, Ewa (2001). "Hacia una nueva síntesis de relaciones evolutivas y clasificación de Scleractini". Revista de Paleontología . 75 (6): 1090–1108. doi :10.1666/0022-3360(2001)075<1090:TANSOE>2.0.CO;2. JSTOR 1307078.
- ^ ab "WoRMS - Registro mundial de especies marinas - Scleractinia". www.marinespecies.org . Consultado el 17 de octubre de 2020 .
Enlaces externos
- Árbol de la vida – zoantharia

