Catálisis heterogénea
La catálisis heterogénea es una catálisis en la que la fase de los catalizadores difiere de la de los reactivos o productos . [1] El proceso contrasta con la catálisis homogénea en la que los reactivos, productos y catalizadores existen en la misma fase. La fase distingue no solo entre componentes sólidos , líquidos y gaseosos , sino también mezclas inmiscibles (por ejemplo, aceite y agua ) o cualquier lugar donde haya una interfaz.
La catálisis heterogénea generalmente implica catalizadores en fase sólida y reactantes en fase gaseosa. [2] En este caso, hay un ciclo de adsorción, reacción y desorción molecular que ocurre en la superficie del catalizador. La termodinámica, la transferencia de masa y la transferencia de calor influyen en la velocidad (cinética) de la reacción .
La catálisis heterogénea es muy importante porque permite una producción más rápida y a gran escala y la formación selectiva de productos. [3] Aproximadamente el 35% del PIB mundial está influenciado por la catálisis. [4] La producción del 90% de los productos químicos (en volumen) se ve asistida por catalizadores sólidos. [2] Las industrias química y energética dependen en gran medida de la catálisis heterogénea. Por ejemplo, el proceso Haber-Bosch utiliza catalizadores a base de metales en la síntesis de amoníaco , un componente importante de los fertilizantes; en 2016 se produjeron 144 millones de toneladas de amoníaco. [5]
Adsorción
La adsorción es un paso esencial en la catálisis heterogénea. La adsorción es el proceso por el cual una molécula en fase gaseosa (o en solución) (el adsorbato) se une a átomos de la superficie sólida (o líquida) (el adsorbente). El proceso inverso de la adsorción es la desorción , en la que el adsorbato se separa del adsorbente. En una reacción facilitada por la catálisis heterogénea, el catalizador es el adsorbente y los reactivos son el adsorbato.
Tipos de adsorción
Se reconocen dos tipos de adsorción: la fisisorción , adsorción débilmente unida, y la quimisorción , adsorción fuertemente unida. Muchos procesos en catálisis heterogénea se encuentran entre los dos extremos. El modelo de Lennard-Jones proporciona un marco básico para predecir las interacciones moleculares en función de la separación atómica. [6]
Fisisorción
En la fisisorción, una molécula se siente atraída por los átomos de la superficie a través de fuerzas de van der Waals . Estas incluyen interacciones dipolo-dipolo, interacciones dipolo inducidas y fuerzas de dispersión de London. Nótese que no se forman enlaces químicos entre el adsorbato y el adsorbente, y sus estados electrónicos permanecen relativamente imperturbables. Las energías típicas para la fisisorción son de 3 a 10 kcal/mol. [2] En la catálisis heterogénea, cuando una molécula de reactivo se fisisorbe a un catalizador, comúnmente se dice que está en un estado precursor, un estado de energía intermedio antes de la quimisorción, una adsorción más fuertemente unida. [6] Desde el estado precursor, una molécula puede experimentar quimisorción, desorción o migración a través de la superficie. [7] La naturaleza del estado precursor puede influir en la cinética de la reacción. [7]
Quimisorción
Cuando una molécula se acerca lo suficiente a los átomos de la superficie de modo que sus nubes de electrones se superponen, puede ocurrir la quimisorción. En la quimisorción, el adsorbato y el adsorbente comparten electrones, lo que significa la formación de enlaces químicos . Las energías típicas para la quimisorción varían de 20 a 100 kcal/mol. [2] Dos casos de quimisorción son:
- Adsorción molecular: el adsorbato permanece intacto. Un ejemplo es la unión de alquenos por platino.
- Adsorción por disociación: uno o más enlaces se rompen simultáneamente con la adsorción. En este caso, la barrera a la disociación afecta la velocidad de adsorción. Un ejemplo de esto es la unión de H2 a un catalizador metálico, donde el enlace HH se rompe durante la adsorción.
Reacciones superficiales

La mayoría de las reacciones superficiales de los metales se producen por propagación en cadena en la que los intermediarios catalíticos se producen y consumen cíclicamente. [8] Se pueden describir dos mecanismos principales para las reacciones superficiales para A + B → C. [2]
- Mecanismo de Langmuir-Hinshelwood : las moléculas reactivas, A y B, se adsorben en la superficie catalítica. Mientras están adsorbidas en la superficie, se combinan para formar el producto C, que luego se desorbe.
- Mecanismo de Eley-Rideal : una molécula reactiva, A, se adsorbe a la superficie catalítica. Sin adsorberse, B reacciona con la A absorbida para formar C, que luego se desorbe de la superficie.
La mayoría de las reacciones catalizadas heterogéneamente se describen mediante el modelo Langmuir-Hinshelwood. [9]
En la catálisis heterogénea, los reactivos se difunden desde la fase fluida en masa para adsorberse en la superficie del catalizador. El sitio de adsorción no siempre es un sitio activo del catalizador, por lo que las moléculas de reactivos deben migrar a través de la superficie hasta un sitio activo. En el sitio activo, las moléculas de reactivos reaccionarán para formar moléculas de producto siguiendo un camino más fácil energéticamente a través de intermediarios catalíticos (ver figura a la derecha). Las moléculas de producto luego se desorben de la superficie y se difunden. El catalizador en sí permanece intacto y libre para mediar reacciones posteriores. Los fenómenos de transporte, como la transferencia de calor y masa, también juegan un papel en la velocidad de reacción observada.
Diseño de catalizador

Los catalizadores no son activos hacia los reactantes en toda su superficie; solo ubicaciones específicas poseen actividad catalítica, llamadas sitios activos . El área de superficie de un catalizador sólido tiene una fuerte influencia en la cantidad de sitios activos disponibles. En la práctica industrial, los catalizadores sólidos suelen ser porosos para maximizar el área de superficie, logrando comúnmente 50–400 m 2 /g. [2] Algunos silicatos mesoporosos , como el MCM-41, tienen áreas de superficie mayores de 1000 m 2 /g. [10] Los materiales porosos son rentables debido a su alta relación área de superficie a masa y actividad catalítica mejorada.
En muchos casos, un catalizador sólido se dispersa sobre un material de soporte para aumentar el área superficial (distribuir el número de sitios activos) y proporcionar estabilidad. [2] Por lo general, los soportes de los catalizadores son materiales inertes con un punto de fusión alto, pero también pueden ser catalíticos por sí mismos. La mayoría de los soportes de los catalizadores son porosos (con frecuencia, a base de carbono, sílice, zeolita o alúmina) [4] y se eligen por su alta relación área superficial-masa. Para una reacción dada, los soportes porosos deben seleccionarse de manera que los reactivos y productos puedan entrar y salir del material.
A menudo, se añaden sustancias intencionalmente a la alimentación de reacción o al catalizador para influir en la actividad catalítica, la selectividad y/o la estabilidad. Estos compuestos se denominan promotores. Por ejemplo, se añade alúmina (Al2O3 ) durante la síntesis de amoníaco para proporcionar una mayor estabilidad al ralentizar los procesos de sinterización en el catalizador de Fe. [2]
El principio de Sabatier puede considerarse una de las piedras angulares de la teoría moderna de la catálisis. [11] El principio de Sabatier establece que la interacción superficie-adsorbatos tiene que ser una cantidad óptima: no demasiado débil para ser inerte hacia los reactivos y no demasiado fuerte para envenenar la superficie y evitar la desorción de los productos. [12] La afirmación de que la interacción superficie-adsorbato tiene que ser óptima es cualitativa. Por lo general, el número de adsorbatos y estados de transición asociados con una reacción química es un número grande, por lo que el óptimo tiene que encontrarse en un espacio multidimensional. El diseño de catalizadores en un espacio multidimensional de este tipo no es una tarea viable desde el punto de vista computacional. Además, dicho proceso de optimización estaría lejos de ser intuitivo. Las relaciones de escala se utilizan para disminuir la dimensionalidad del espacio de diseño del catalizador. [13] Dichas relaciones son correlaciones entre las energías de enlace de los adsorbatos (o entre las energías de enlace de los adsorbatos y los estados de transición, también conocidas como relaciones BEP ) [14] que son "suficientemente similares", por ejemplo, la escala de OH frente a OOH. [15] La aplicación de relaciones de escala a los problemas de diseño de catalizadores reduce en gran medida la dimensionalidad espacial (a veces hasta tan solo 1 o 2). [16] También se puede utilizar el modelado microcinético basado en dichas relaciones de escala para tener en cuenta la cinética asociada con la adsorción, reacción y desorción de moléculas en condiciones específicas de presión o temperatura. [17] Dicho modelado conduce entonces a los conocidos gráficos de volcanes en los que el óptimo cualitativamente descrito por el principio de Sabatier se conoce como la "cima del volcán". Las relaciones de escala se pueden utilizar no solo para conectar la energía de los grupos radicales adsorbidos en la superficie (por ejemplo, O*,OH*), [13] sino también para conectar la energía de las moléculas de capa cerrada entre sí o con los adsorbidos radicales homólogos. [18] Un desafío reciente para los investigadores en ciencias catalíticas es "romper" las relaciones de escala. [19] Las correlaciones que se manifiestan en las relaciones de escala limitan el espacio de diseño del catalizador, impidiendo que se alcance la "cima del volcán". Romper las relaciones de escala puede referirse al diseño de superficies o motivos que no siguen una relación de escala, o que siguen una relación de escala diferente (que la relación habitual para los adsorbatos asociados) en la dirección correcta: una que nos puede acercar a la cima del volcán de reactividad. [16] Además de estudiar la reactividad catalítica, las relaciones de escala se pueden utilizar para estudiar y seleccionar materiales para su selectividad hacia un producto especial.[20] Existen combinaciones especiales de energías de enlace que favorecen a productos específicos sobre otros. A veces, un conjunto de energías de enlace que pueden cambiar la selectividad hacia un producto específico "escalan" entre sí, por lo que para mejorar la selectividad es necesario romper algunas relaciones de escala; un ejemplo de esto es la escala entre las energías de activación oxidativa del metano y el metanol que conduce a la falta de selectividad en la conversión directa del metano en metanol. [21]
Desactivación del catalizador
La desactivación del catalizador se define como una pérdida de actividad catalítica y/o selectividad a lo largo del tiempo.
Las sustancias que disminuyen la velocidad de reacción se denominan venenos . Los venenos se quimisorben en la superficie del catalizador y reducen la cantidad de sitios activos disponibles a los que se pueden unir las moléculas reactivas. [22] Los venenos comunes incluyen elementos del Grupo V, VI y VII (por ejemplo, S, O, P, Cl), algunos metales tóxicos (por ejemplo, As, Pb) y especies adsorbentes con enlaces múltiples (por ejemplo, CO, hidrocarburos insaturados). [6] [22] Por ejemplo, el azufre interrumpe la producción de metanol al envenenar el catalizador de Cu/ZnO. [23] Las sustancias que aumentan la velocidad de reacción se denominan promotores . Por ejemplo, la presencia de metales alcalinos en la síntesis de amoníaco aumenta la velocidad de disociación de N 2 . [23]
La presencia de venenos y promotores puede alterar la energía de activación de la etapa limitante de la velocidad y afectar la selectividad de un catalizador para la formación de ciertos productos. Dependiendo de la cantidad, una sustancia puede ser favorable o desfavorable para un proceso químico. Por ejemplo, en la producción de etileno, una pequeña cantidad de cloro quimisorbido actuará como promotor al mejorar la selectividad del catalizador de Ag hacia el etileno sobre el CO2 , mientras que demasiado cloro actuará como veneno. [6]
Otros mecanismos para la desactivación del catalizador incluyen:
- Sinterización : cuando se calientan, las partículas metálicas catalíticas dispersas pueden migrar a través de la superficie de soporte y formar cristales. Esto da como resultado una reducción del área superficial del catalizador.
- Ensuciamiento : deposición de materiales de la fase fluida sobre el catalizador en fase sólida y/o las superficies de soporte. Esto da como resultado el bloqueo del sitio activo y/o de los poros.
- Coquización : deposición de sólidos pesados y ricos en carbono sobre superficies debido a la descomposición de hidrocarburos [22]
- Reacciones vapor-sólido: formación de una capa superficial inactiva y/o formación de un compuesto volátil que sale del reactor. [22] Esto da como resultado una pérdida de área superficial y/o material catalizador.
- Transformación en estado sólido : difusión en estado sólido de los átomos de soporte del catalizador hacia la superficie, seguida de una reacción que forma una fase inactiva. Esto da como resultado una pérdida de área superficial del catalizador.
- Erosión: desgaste continuo del material catalizador común en los reactores de lecho fluidizado. [24] Esto da como resultado una pérdida de material catalizador.
En la industria, la desactivación del catalizador cuesta miles de millones cada año debido al cierre del proceso y el reemplazo del catalizador. [22]
Ejemplos industriales
En la industria, se deben considerar muchas variables de diseño, incluido el diseño del reactor y el catalizador en múltiples escalas que van desde el subnanómetro hasta las decenas de metros. Los reactores de catálisis heterogéneos convencionales incluyen reactores por lotes , continuos y de lecho fluidizado , mientras que las configuraciones más recientes incluyen reactores de lecho fijo, de microcanales y multifuncionales . [6] Otras variables a considerar son las dimensiones del reactor, el área de superficie, el tipo de catalizador, el soporte del catalizador, así como las condiciones de operación del reactor, como la temperatura, la presión y las concentraciones de reactivos.

A continuación se enumeran algunos procesos industriales a gran escala que incorporan catalizadores heterogéneos. [4]
| Proceso | Reactivos, Producto(s) (no balanceados) | Catalizador | Comentario |
|---|---|---|---|
| Síntesis de ácido sulfúrico ( proceso de contacto ) | SO2 + O2 , SO3 | óxidos de vanadio | La hidratación de SO 3 da H 2 SO 4 |
| Síntesis de amoniaco ( proceso Haber-Bosch ) | N2 + H2 , NH3 | óxidos de hierro sobre alúmina ( Al2O3 ) | Consume el 1% del presupuesto energético industrial mundial [2] |
| Síntesis de ácido nítrico ( proceso de Ostwald ) | NH3 + O2 , HNO3 | gasa Pt-Rh sin soporte | Las rutas directas desde la N 2 no son económicas |
| Producción de hidrógeno mediante reformado con vapor | CH4 + H2O , H2 + CO2 | Níquel o K 2 O | Se buscan activamente rutas más ecológicas para el H2 mediante la división del agua |
| Síntesis de óxido de etileno | C2H4 + O2 , C2H4O | Plata sobre alúmina , con muchos promotores. | Poco aplicable a otros alquenos. |
| Síntesis de cianuro de hidrógeno ( oxidación de Andrussov ) | NH3 + O2 + CH4 , HCN | Pt-Rh | El proceso de amoxidación relacionado convierte los hidrocarburos en nitrilos. |
| Polimerización de olefinas Polimerización Ziegler–Natta | propileno , polipropileno | TiCl3 sobre MgCl2 | Existen muchas variaciones, incluidos algunos ejemplos homogéneos. |
| Desulfurización del petróleo ( hidrodesulfuración ) | H 2 + R 2 S (impureza de organosulfurado idealizada), RH + H 2 S | Mo - Co sobre alúmina | Produce hidrocarburos con bajo contenido de azufre, azufre recuperado a través del proceso Claus |

Otros ejemplos
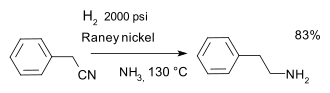
- Reducción de nitrilos en la síntesis de fenetilamina con catalizador de níquel Raney e hidrógeno en amoniaco : [25]

Hidrogenación de nitrilo - El craqueo, isomerización y reformación de hidrocarburos para formar mezclas apropiadas y útiles de gasolina.
- En los automóviles, los convertidores catalíticos se utilizan para catalizar tres reacciones principales:
- La oxidación del monóxido de carbono a dióxido de carbono :
- 2CO(g) + O 2 (g) → 2CO 2 (g)
- La reducción del monóxido de nitrógeno a nitrógeno :
- 2NO(g) + 2CO(g) → N2 ( g) + 2CO2 ( g)
- La oxidación de hidrocarburos a agua y dióxido de carbono :
- 2 C 6 H 6 + 15 O 2 → 12 CO 2 + 6 H 2 O
- La oxidación del monóxido de carbono a dióxido de carbono :
- Este proceso puede ocurrir con cualquier hidrocarburo , pero lo más común es que se realice con gasolina o diésel .
- La catálisis heterogénea asimétrica facilita la producción de compuestos enantioméricos puros utilizando catalizadores heterogéneos quirales. [26]
- La mayoría de los catalizadores heterogéneos se basan en metales [27] u óxidos metálicos ; [28] sin embargo, algunas reacciones químicas pueden ser catalizadas por materiales basados en carbono, por ejemplo, deshidrogenaciones oxidativas [29] u oxidaciones selectivas . [30]
- Etilbenceno + 1/2 O 2 → Estireno + H 2 O
- Acroleína + 1/2 O 2 → Ácido acrílico
Reacciones catalizadas sólido-líquido y líquido-líquido
Aunque la mayoría de los catalizadores heterogéneos son sólidos, existen algunas variaciones que tienen valor práctico. En el caso de dos soluciones inmiscibles (líquidos), una lleva el catalizador mientras que la otra lleva el reactivo. Esta configuración es la base de la catálisis bifásica, tal como se implementa en la producción industrial de butiraldehído mediante la hidroformilación de propileno. [31]
| Fases de reacción | Se dan ejemplos | Comentario |
|---|---|---|
| sólido + solución | hidrogenación de ácidos grasos con níquel | utilizado para la producción de margarina |
| fases líquidas inmiscibles | hidroformilación de propeno | Catalizador de fase acuosa; reactivos y productos principalmente en fase no acuosa. |
Véase también
- Catálisis heterogénea de oro
- Catalizadores basados en nanomateriales
- Nanopartículas de platino
- Reducción programada de temperatura
- Espectroscopia de desorción térmica
Referencias
- ^ Schlögl, Robert (9 de marzo de 2015). "Catálisis heterogénea". Edición internacional Angewandte Chemie . 54 (11): 3465–3520. doi :10.1002/anie.201410738. hdl : 11858/00-001M-0000-0025-0A33-6 . PMID 25693734.
- ^ abcdefghi Rothenberg, Gadi (17 de marzo de 2008). Catálisis: conceptos y aplicaciones ecológicas . Weinheim [Alemania]: Wiley-VCH. ISBN 9783527318247.OCLC 213106542 .
- ^ Información., Laboratorio Nacional Lawrence Berkeley. Estados Unidos. Departamento de Energía. Oficina de Asuntos Científicos y Técnicos (2003). "El impacto de la nanociencia en la catálisis heterogénea". Science . 299 (5613). Laboratorio Nacional Lawrence Berkeley: 1688–1691. Bibcode :2003Sci...299.1688B. doi :10.1126/science.1083671. OCLC 727328504. PMID 12637733. S2CID 35805920.
- ^ abc Ma, Zhen; Zaera, Francisco (15 de marzo de 2006), "Catálisis heterogénea por metales", en King, R. Bruce; Crabtree, Robert H.; Lukehart, Charles M.; Atwood, David A. (eds.), Enciclopedia de química inorgánica , John Wiley & Sons, Ltd, doi : 10.1002/0470862106.ia084, ISBN 9780470860786
- ^ "United States Geological Survey, Resúmenes de productos minerales" (PDF) . USGS . Enero de 2018.
- ^ abcde Thomas, JM; Thomas, WJ (19 de noviembre de 2014). Principios y práctica de la catálisis heterogénea (segunda edición revisada). Weinheim, Alemania. ISBN 9783527683789.OCLC 898421752 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ ab Bowker, Michael (28 de marzo de 2016). "El papel de los estados precursores en la adsorción, las reacciones superficiales y la catálisis". Temas de catálisis . 59 (8–9): 663–670. doi : 10.1007/s11244-016-0538-6 . ISSN 1022-5528. PMID 21386456.
- ^ Masel, Richard I. (22 de marzo de 1996). Principios de adsorción y reacción en superficies sólidas. Wiley. ISBN 978-0-471-30392-3.OCLC 32429536 .
- ^ Petukhov, AV (1997). "Efecto de la movilidad molecular en la cinética de una reacción electroquímica de Langmuir–Hinshelwood". Chemical Physics Letters . 277 (5–6): 539–544. Bibcode :1997CPL...277..539P. doi :10.1016/s0009-2614(97)00916-0. ISSN 0009-2614.
- ^ Kresge, CT; Leonowicz, ME; Roth, WJ; Vartuli, JC; Beck, JS (1992). "Tamices moleculares mesoporosos ordenados sintetizados mediante un mecanismo de plantilla de cristal líquido". Nature . 359 (6397): 710–712. Bibcode :1992Natur.359..710K. doi :10.1038/359710a0. ISSN 0028-0836. S2CID 4249872.
- ^ Medford, Andrew J.; Vojvodic, Aleksandra; Hummelshøj, Jens S.; Voss, Johannes; Abild-Pedersen, Frank; Studt, Félix; Bligaard, Thomas; Nilsson, Anders; Nørskov, Jens K. (2015). "Del principio de Sabatier a una teoría predictiva de catálisis heterogénea de metales de transición". Revista de Catálisis . 328 : 36–42. doi : 10.1016/j.jcat.2014.12.033 .
- ^ Laursen, Anders B.; Man, Isabela Costinela; Trinhammer, Ole L.; Rossmeisl, Jan; Dahl, Søren (4 de octubre de 2011). "El principio de Sabatier ilustrado por la descomposición catalítica de H2O2 en superficies metálicas". Revista de educación química . 88 (12): 1711–1715. Código Bibliográfico :2011JChEd..88.1711L. doi :10.1021/ed101010x.
- ^ ab Abild-Pedersen, F.; Greeley, J.; Studt, F.; Rossmeisl, J.; Munter, TR; Moses, PG; Skúlason, E.; Bligaard, T.; Nørskov, JK (6 de julio de 2007). "Propiedades de escala de las energías de adsorción para moléculas que contienen hidrógeno en superficies de metales de transición" (PDF) . Physical Review Letters . 99 (1): 016105. Bibcode :2007PhRvL..99a6105A. doi :10.1103/PhysRevLett.99.016105. PMID 17678168. S2CID 11603704.
- ^ Nørskov, Jens K.; Christensen, Claus H.; Bligaard, Thomas; Munter, Ture R. (18 de agosto de 2008). "Relaciones BEP para la disociación de N2 sobre superficies de metales de transición y aleaciones escalonadas". Química física Química Física . 10 (34): 5202–5206. Bibcode :2008PCCP...10.5202M. doi :10.1039/B720021H. ISSN 1463-9084. PMID 18728861.
- ^ Viswanathan, Venkatasubramanian; Hansen, Heine Anton; Rossmeisl, Jan; Nørskov, Jens K. (11 de julio de 2012). "Universalidad en la electrocatálisis de reducción de oxígeno en superficies metálicas". ACS Catalysis . 2 (8): 1654–1660. doi : 10.1021/cs300227s . ISSN 2155-5435.
- ^ ab Nørskov, Jens K.; Vojvodic, Aleksandra (1 de junio de 2015). "Nuevo paradigma de diseño para catalizadores heterogéneos". Revista Nacional de Ciencias . 2 (2): 140–143. doi : 10.1093/nsr/nwv023 . ISSN 2095-5138.
- ^ Medford, Andrew J.; Shi, Chuan; Hoffmann, Max J.; Lausche, Adam C.; Fitzgibbon, Sean R.; Bligaard, Thomas; Nørskov, Jens K. (1 de marzo de 2015). "CatMAP: un paquete de software para el mapeo microcinético basado en descriptores de tendencias catalíticas". Catalysis Letters . 145 (3): 794–807. doi :10.1007/s10562-015-1495-6. ISSN 1572-879X. S2CID 98391105.
- ^ Kakekhani, Arvin; Roling, Luke T.; Kulkarni, Ambarish; Latimer, Allegra A.; Abroshan, Hadi; Schumann, Julia; AlJama, Hassan; Siahrostami, Samira ; Ismail-Beigi, Sohrab (18 de junio de 2018). "Naturaleza de los enlaces de superficie de pares solitarios y sus relaciones de escala". Química inorgánica . 57 (12): 7222–7238. doi :10.1021/acs.inorgchem.8b00902. ISSN 0020-1669. OSTI 1459598. PMID 29863849. S2CID 46932095.
- ^ Chen, Ping; He, Teng; Wu, Guotao; Guo, Jianping; Gao, Wenbo; Chang, Fei; Wang, Peikun (enero de 2017). "Romper las relaciones de escala para lograr la síntesis de amoníaco a baja temperatura mediante la transferencia de nitrógeno y la hidrogenación mediadas por LiH". Nature Chemistry . 9 (1): 64–70. Bibcode :2017NatCh...9...64W. doi :10.1038/nchem.2595. ISSN 1755-4349. PMID 27995914.
- ^ Schumann, Julia; Medford, Andrew J.; Yoo, Jong Suk; Zhao, Zhi-Jian; Bothra, Pallavi; Cao, Ang; Studt, Félix; Abild-Pedersen, Frank; Nørskov, Jens K. (13 de marzo de 2018). "Selectividad de la conversión de gas de síntesis a oxigenados C2 + en superficies de metales de transición fcc (111)". Catálisis ACS . 8 (4): 3447–3453. doi :10.1021/acscatal.8b00201. OSTI 1457170.
- ^ Nørskov, Jens K.; Studt, Félix; Abild-Pedersen, Frank; Tsai, Charlie; Yoo, Jong Suk; Montoya, José H.; Aljama, Hassan; Kulkarni, Ambarish R.; Latimer, Allegra A. (febrero de 2017). "Comprensión de las tendencias en la activación del enlace C-H en catálisis heterogénea". Materiales de la naturaleza . 16 (2): 225–229. Código Bib : 2017NatMa..16..225L. doi :10.1038/nmat4760. ISSN 1476-4660. PMID 27723737. S2CID 11360569.
- ^ abcde Bartholomew, Calvin H (2001). "Mecanismos de desactivación del catalizador". Catálisis Aplicada A: General . 212 (1–2): 17–60. doi : 10.1016/S0926-860X(00)00843-7 .
- ^ ab Nørskov, Jens K. (25 de agosto de 2014). Conceptos fundamentales en catálisis heterogénea . Studt, Felix., Abild-Pedersen, Frank., Bligaard, Thomas. Hoboken, Nueva Jersey. ISBN 9781118892022.OCLC 884500509 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Forzatti, P (14 de septiembre de 1999). "Desactivación del catalizador". Catalysis Today . 52 (2–3): 165–181. doi :10.1016/s0920-5861(99)00074-7. ISSN 0920-5861. S2CID 19737702.
- ^ Síntesis orgánicas, vol. 3, pág. 720 (1955); vol. 23, pág. 71 (1943). https://web.archive.org/web/20120315000000*/http://orgsynth.org/orgsyn/pdfs/CV4P0603.pdf
- ^ Heitbaum; Glorius; Escher (2006). "Catálisis heterogénea asimétrica". Angew. Chem. Int. Ed . 45 (29): 4732–62. doi :10.1002/anie.200504212. PMID 16802397.
- ^ Wang, Aiqin; Li, Jun; Zhang, Tao (junio de 2018). "Catálisis heterogénea de un solo átomo". Nature Reviews Chemistry . 2 (6): 65–81. doi :10.1038/s41570-018-0010-1. ISSN 2397-3358. S2CID 139163163.
- ^ Zeng, Liang; Cheng, Zhuo; Fan, Jonathan A.; Fan, Liang-Shih; Gong, Jinlong (noviembre de 2018). "Química redox de óxidos metálicos para procesos de bucle químico". Nature Reviews Chemistry . 2 (11): 349–364. doi :10.1038/s41570-018-0046-2. ISSN 2397-3358. S2CID 85504970.
- ^ Zhang, J.; Liu, X.; Blume, R.; Zhang, A.; Schlögl, R.; Su, DS (2008). "Los nanotubos de carbono modificados superficialmente catalizan la deshidrogenación oxidativa del n-butano". Science . 322 (5898): 73–77. Bibcode :2008Sci...322...73Z. doi :10.1126/science.1161916. hdl : 11858/00-001M-0000-0010-FE91-E . PMID 18832641. S2CID 35141240.
- ^ Frank, B.; Blume, R.; Rinaldi, A.; Trunschke, A.; Schlögl, R. (2011). "Catálisis de inserción de oxígeno por carbono sp2". Angew. Chem. Int. Ed . 50 (43): 10226–10230. doi : 10.1002/anie.201103340 . hdl : 11858/00-001M-0000-0012-0B9A-8 . PMID 22021211.
- ^ Boy Cornils; Wolfgang A. Herrmann , eds. (2004). Catálisis organometálica en fase acuosa: conceptos y aplicaciones . Wiley-VCH.