Calorimetría diferencial de barrido
 Calorímetro diferencial de barrido | |
| Acrónimo | DSC |
|---|---|
| Clasificación | Análisis térmico |
| Fabricantes | TA Instruments, Mettler Toledo , Hitachi , Shimadzu , PerkinElmer , Malvern Instruments , NETZSCH-Gruppe |
| Otras técnicas | |
| Relacionado | Microcalorimetría isotérmica Calorimetría de titulación isotérmica Análisis mecánico dinámico Análisis termomecánico Análisis termogravimétrico Análisis térmico diferencial Análisis térmico dieléctrico |
La calorimetría diferencial de barrido ( DSC ) es una técnica termoanalítica en la que se mide la diferencia en la cantidad de calor necesaria para aumentar la temperatura de una muestra y una referencia en función de la temperatura. [1] Tanto la muestra como la referencia se mantienen a casi la misma temperatura durante todo el experimento.
En general, el programa de temperatura para un análisis DSC está diseñado de tal manera que la temperatura del portamuestras aumenta linealmente en función del tiempo. La muestra de referencia debe tener una capacidad térmica bien definida en el rango de temperaturas que se analizará.
Además, la muestra de referencia debe ser estable, de alta pureza y no debe experimentar muchos cambios a lo largo del barrido de temperatura. Por lo general, los estándares de referencia han sido metales como el indio , el estaño , el bismuto y el plomo [2] , pero se han propuesto otros estándares como el polietileno y los ácidos grasos para estudiar polímeros y compuestos orgánicos, respectivamente.
La técnica fue desarrollada por ES Watson y MJ O'Neill en 1962, [3] y presentada comercialmente en la Conferencia de Pittsburgh sobre Química Analítica y Espectroscopia Aplicada de 1963 .
El primer calorímetro diferencial de barrido adiabático que se pudo utilizar en bioquímica fue desarrollado por PL Privalov y DR Monaselidze en 1964 en el Instituto de Física de Tbilisi , Georgia . [4] El término DSC fue acuñado para describir este instrumento, que mide la energía directamente y permite mediciones precisas de la capacidad calorífica. [5]
Tipos
Hay dos tipos principales de DSC: DSC de flujo de calor , que mide la diferencia en el flujo de calor entre la muestra y una referencia (lo que le da el nombre alternativo DSC multicelda ) y DSC diferencial de potencia, que mide la diferencia en la potencia suministrada a la muestra y una referencia. [6] [7]
DSC de flujo de calor
En el DSC de flujo de calor, los cambios en el flujo de calor se calculan integrando la curva de referencia ΔT . Para este tipo de experimento, se colocan una muestra y un crisol de referencia en un portamuestras con sensores de temperatura integrados para medir la temperatura de los crisoles. Esta disposición se encuentra en un horno de temperatura controlada. A diferencia del diseño tradicional, la característica especial del DSC de flujo de calor es que utiliza sensores de temperatura planos colocados verticalmente alrededor de un calentador plano. Esta configuración permite tener una estructura pequeña, liviana y de baja capacidad térmica mientras sigue funcionando como un horno DSC normal. [8]
Diferencial de potencia DSC
Para este tipo de configuración, también conocida como DSC con compensación de potencia , la muestra y el crisol de referencia se colocan en hornos con aislamiento térmico y no uno al lado del otro en el mismo horno como en los experimentos de DSC con flujo de calor. [9] Luego, se controla la temperatura de ambas cámaras para que siempre haya la misma temperatura en ambos lados. Luego, se registra la potencia eléctrica que se requiere para obtener y mantener este estado en lugar de la diferencia de temperatura entre los dos crisoles. [10]
DSC de escaneo rápido
En la década de 2000 se ha producido un rápido desarrollo de la tecnología Fast-scan DSC (FSC), [11] una novedosa técnica calorimétrica que emplea sensores micromaquinados. Los avances clave de esta técnica son la velocidad de escaneo ultraalta, que puede llegar a 10 6 K/s, y la sensibilidad ultraalta, con una resolución de capacidad térmica normalmente mejor que 1 nJ/K. [12]
La nanocalorimetría [13] ha atraído mucha atención en la ciencia de los materiales, donde se aplica para realizar análisis cuantitativos de transiciones de fase rápidas, particularmente en enfriamiento rápido. Otra área emergente de aplicación de la FSC es la química física , con un enfoque en las propiedades termofísicas de compuestos térmicamente lábiles. Se hicieron disponibles cantidades como temperatura de fusión , entalpía de fusión , presiones de sublimación y vaporización , y entalpías de tales moléculas. [14]
DSC modulado por temperatura
Al realizar la DSC modulada por temperatura (TMDSC, MDSC), la tasa de calentamiento lineal subyacente se superpone con una variación de temperatura sinusoidal. La ventaja de este procedimiento es la capacidad de separar los efectos superpuestos de la DSC calculando las señales inversas y no inversas. El flujo de calor reversible está relacionado con los cambios en la capacidad calorífica específica (→ transición vítrea), mientras que el flujo de calor no reversible corresponde a fenómenos dependientes del tiempo, como el curado, la deshidratación y la relajación.
Detección de transiciones de fase
El principio básico que subyace a esta técnica es que cuando la muestra sufre una transformación física, como una transición de fase , será necesario que fluya hacia ella más o menos calor que hacia la referencia para mantener ambas a la misma temperatura. Que fluya hacia la muestra menos o más calor depende de si el proceso es exotérmico o endotérmico .
Por ejemplo, cuando una muestra sólida se funde y se convierte en líquido, se requiere que fluya más calor hacia la muestra para aumentar su temperatura al mismo ritmo que la referencia. Esto se debe a la absorción de calor por parte de la muestra a medida que experimenta la transición de fase endotérmica de sólido a líquido. Del mismo modo, a medida que la muestra experimenta procesos exotérmicos (como la cristalización ), se requiere menos calor para aumentar la temperatura de la muestra. Al observar la diferencia en el flujo de calor entre la muestra y la referencia, los calorímetros de barrido diferencial pueden medir la cantidad de calor absorbido o liberado durante dichas transiciones. La DSC también se puede utilizar para observar cambios físicos más sutiles, como las transiciones vítreas . Se utiliza ampliamente en entornos industriales como un instrumento de control de calidad debido a su aplicabilidad en la evaluación de la pureza de la muestra y para estudiar el curado de polímeros. [15] [16] [17]
DTA
Una técnica alternativa, que comparte mucho en común con la DSC, es el análisis térmico diferencial (DTA). En esta técnica, es el flujo de calor hacia la muestra y la referencia lo que permanece igual, en lugar de la temperatura. Cuando la muestra y la referencia se calientan de manera idéntica, los cambios de fase y otros procesos térmicos causan una diferencia de temperatura entre la muestra y la referencia. Tanto la DSC como la DTA brindan información similar. La DSC mide la energía necesaria para mantener la referencia y la muestra a la misma temperatura, mientras que la DTA mide la diferencia de temperatura entre la muestra y la referencia cuando se ha introducido la misma cantidad de energía en ambas. [18]
Curvas DSC
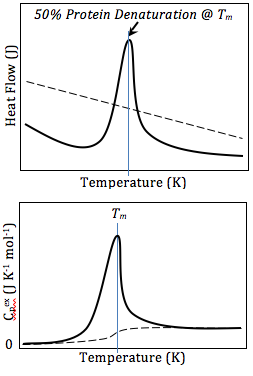
El resultado de un experimento DSC es una curva de flujo de calor en función de la temperatura o en función del tiempo. Existen dos convenciones diferentes: las reacciones exotérmicas en la muestra se muestran con un pico positivo o negativo, según el tipo de tecnología utilizada en el experimento. Esta curva se puede utilizar para calcular entalpías de transición . Esto se hace integrando el pico correspondiente a una transición dada. Se puede demostrar que la entalpía de transición se puede expresar utilizando la siguiente ecuación:
donde es la entalpía de transición, es la constante calorimétrica y es el área bajo la curva. La constante calorimétrica variará de un instrumento a otro y se puede determinar analizando una muestra bien caracterizada con entalpías de transición conocidas. [16]
Aplicaciones
La calorimetría diferencial de barrido se puede utilizar para medir una serie de propiedades características de una muestra. Mediante esta técnica es posible observar eventos de fusión y cristalización , así como las temperaturas de transición vítrea T g . La DSC también se puede utilizar para estudiar la oxidación , así como otras reacciones químicas. [15] [16] [19]
Las transiciones vítreas pueden ocurrir a medida que aumenta la temperatura de un sólido amorfo . Estas transiciones aparecen como un paso en la línea base de la señal DSC registrada. Esto se debe a que la muestra experimenta un cambio en la capacidad térmica ; no ocurre ningún cambio de fase formal. [15] [17]
A medida que aumenta la temperatura, un sólido amorfo se volverá menos viscoso . En algún momento, las moléculas pueden obtener suficiente libertad de movimiento para organizarse espontáneamente en una forma cristalina. Esto se conoce como temperatura de cristalización ( T c ). Esta transición de sólido amorfo a sólido cristalino es un proceso exotérmico y da como resultado un pico en la señal DSC. A medida que aumenta la temperatura, la muestra finalmente alcanza su temperatura de fusión ( T m ). El proceso de fusión da como resultado un pico endotérmico en la curva DSC. La capacidad de determinar las temperaturas de transición y las entalpías hace que la DSC sea una herramienta valiosa para producir diagramas de fase para varios sistemas químicos. [15]
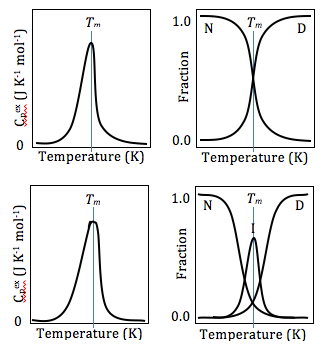
La calorimetría diferencial de barrido también se puede utilizar para obtener información termodinámica valiosa sobre las proteínas. El análisis termodinámico de las proteínas puede revelar información importante sobre la estructura global de las proteínas y la interacción proteína/ligando. Por ejemplo, muchas mutaciones reducen la estabilidad de las proteínas, mientras que la unión del ligando generalmente aumenta la estabilidad de las proteínas. [20] Mediante DSC, esta estabilidad se puede medir obteniendo valores de energía libre de Gibbs a cualquier temperatura dada. Esto permite a los investigadores comparar la energía libre de desdoblamiento entre la proteína sin ligando y el complejo proteína-ligando , o proteínas de tipo salvaje y mutantes. La DSC también se puede utilizar para estudiar las interacciones proteína/lípido, nucleótidos e interacciones fármaco-lípido. [21] Al estudiar la desnaturalización de proteínas mediante DSC, la fusión térmica debe ser al menos en cierto grado reversible, ya que los cálculos termodinámicos se basan en el equilibrio químico. [21]
Consideraciones experimentales
Existen varios parámetros experimentales y ambientales que se deben tener en cuenta durante las mediciones de DSC. En las siguientes secciones se analizan brevemente algunos ejemplos de problemas potenciales. Todas las afirmaciones de estos párrafos se basan en los libros de Gabbott [22] y Brown [23] .
Crisoles
Las mediciones DSC sin crisoles promueven la transferencia térmica hacia la muestra y son posibles si el DSC está diseñado para este propósito. Las mediciones sin crisol solo deben realizarse con materiales químicamente estables a bajas temperaturas, ya que de lo contrario puede haber contaminación o daño al calorímetro. La forma más segura es utilizar un crisol, que esté especificado para las temperaturas deseadas y que no reaccione con el material de la muestra (por ejemplo, crisoles de alúmina, oro o platino). Si es probable que la muestra desarrolle volátiles o está en estado líquido, el crisol debe sellarse para evitar la contaminación. Sin embargo, si el crisol está sellado, se debe considerar el aumento de la presión y los posibles artefactos de medición debido a la deformación del crisol. En este caso, se deben utilizar crisoles con orificios muy pequeños (∅~50 μm) o crisoles que puedan soportar presiones muy altas.
Condición de la muestra
La muestra debe estar en buen contacto con la superficie del crisol. Por lo tanto, la superficie de contacto de una muestra sólida a granel debe ser paralela al plano. Para las mediciones DSC con polvos, se puede observar una señal más fuerte para polvos más finos debido a la superficie de contacto agrandada. La masa mínima de la muestra depende de la transformación que se va a analizar. Una masa de muestra pequeña (~10 mg) es suficiente si el calor liberado o consumido durante la transformación es lo suficientemente alto. Se pueden utilizar muestras más pesadas para obtener una transformación asociada con una baja liberación o consumo de calor, ya que las muestras más grandes también agrandan los picos obtenidos. Sin embargo, el aumento del tamaño de la muestra puede empeorar la resolución debido a los gradientes térmicos que pueden evolucionar durante el calentamiento.
Temperatura y velocidad de escaneo
Si los picos son muy pequeños, es posible agrandarlos aumentando la velocidad de escaneo. Debido a la mayor velocidad de escaneo, se libera o consume más energía en un tiempo más corto, lo que genera picos más altos y, por lo tanto, más nítidos. Sin embargo, las velocidades de escaneo más rápidas generan una resolución de temperatura deficiente debido al desfase térmico. Debido a este desfase térmico, dos transformaciones de fase (o reacciones químicas) que ocurren en un rango de temperatura estrecho pueden superponerse. Generalmente, las velocidades de calentamiento o enfriamiento son demasiado altas para detectar transiciones de equilibrio, por lo que siempre hay un cambio a temperaturas más altas o más bajas en comparación con los diagramas de fase que representan las condiciones de equilibrio.
Gas de purga
El gas de purga se utiliza para controlar el entorno de la muestra, con el fin de reducir el ruido de la señal y evitar la contaminación. Se utiliza principalmente nitrógeno y, para temperaturas superiores a 600 °C, se puede utilizar argón para minimizar la pérdida de calor debido a la baja conductividad térmica del argón. Se puede utilizar aire u oxígeno puro para pruebas oxidativas como el tiempo de inducción oxidativa y se utiliza He para temperaturas muy bajas debido a la baja temperatura de ebullición (~4,2 K a 101,325 kPa [24] ).
Ejemplos
La técnica se utiliza ampliamente en una amplia gama de aplicaciones, tanto como prueba de calidad de rutina como herramienta de investigación. El equipo es fácil de calibrar, utilizando indio de bajo punto de fusión a 156,5985 °C, por ejemplo, y es un método rápido y confiable de análisis térmico. [ cita requerida ]
Polímeros

La DSC se utiliza ampliamente para examinar materiales poliméricos y determinar sus transiciones térmicas. Las transiciones térmicas importantes incluyen la temperatura de transición vítrea ( T g ), la temperatura de cristalización ( T c ) y la temperatura de fusión ( T m ). Las transiciones térmicas observadas se pueden utilizar para comparar materiales, aunque las transiciones por sí solas no identifican de forma única la composición. La composición de materiales desconocidos se puede completar utilizando técnicas complementarias como la espectroscopia IR. Los puntos de fusión y las temperaturas de transición vítrea para la mayoría de los polímeros están disponibles en compilaciones estándar, y el método puede mostrar la degradación del polímero mediante la reducción de la temperatura de fusión esperada. T m depende del peso molecular del polímero y del historial térmico. [ cita requerida ]
El contenido cristalino porcentual de un polímero se puede estimar a partir de los picos de cristalización/fusión del gráfico DSC utilizando calores de fusión de referencia que se encuentran en la literatura. [25] El DSC también se puede utilizar para estudiar la degradación térmica de polímeros utilizando un enfoque como la temperatura/tiempo de inicio de oxidación (OOT); sin embargo, el usuario corre el riesgo de contaminar la celda DSC, lo que puede ser problemático. El análisis termogravimétrico (TGA) puede ser más útil para la determinación del comportamiento de descomposición. Las impurezas en los polímeros se pueden determinar examinando los termogramas en busca de picos anómalos, y los plastificantes se pueden detectar en sus puntos de ebullición característicos. Además, el examen de eventos menores en los datos del análisis térmico del primer calor puede ser útil ya que estos aparentemente "picos anómalos" también pueden ser de hecho representativos del historial térmico del proceso o almacenamiento del material o del envejecimiento físico del polímero. La comparación de los datos del primer y segundo calor recopilados a velocidades de calentamiento constantes puede permitir al analista aprender tanto sobre el historial de procesamiento del polímero como sobre las propiedades del material. (ver JHFlynn.(1993) Análisis de resultados de DSC por integración. Thermochimica Acta, 217, 129-149.) [ cita requerida ]
Cristales líquidos
La DSC se utiliza en el estudio de los cristales líquidos . A medida que algunas formas de materia pasan de sólido a líquido, pasan por un tercer estado, que muestra propiedades de ambas fases. Este líquido anisotrópico se conoce como estado líquido cristalino o mesomorfo. Mediante la DSC, es posible observar los pequeños cambios de energía que ocurren a medida que la materia pasa de un estado sólido a un cristal líquido y de un cristal líquido a un líquido isotrópico . [16]
Estabilidad oxidativa
El uso de calorimetría diferencial de barrido para estudiar la estabilidad a la oxidación de las muestras generalmente requiere una cámara de muestra hermética. Puede usarse para determinar el tiempo de inducción oxidativa (OIT) de una muestra. Estas pruebas generalmente se realizan de forma isotérmica (a temperatura constante) cambiando la atmósfera de la muestra. Primero, la muestra se lleva a la temperatura de prueba deseada bajo una atmósfera inerte, generalmente nitrógeno . Luego se agrega oxígeno al sistema. Cualquier oxidación que ocurra se observa como una desviación en la línea base. Este análisis se puede utilizar para determinar la estabilidad y las condiciones óptimas de almacenamiento para un material o compuesto. [15] El equipo DSC también se puede utilizar para determinar la temperatura de inicio de oxidación (OOT) de un material. En esta prueba, una muestra (y una referencia) se exponen a una atmósfera de oxígeno y se someten a una tasa constante de calentamiento (generalmente de 50 a 300 °C). La curva de flujo de calor DSC se desviará cuando comience la reacción con el oxígeno (la reacción puede ser exotérmica o endotérmica ). Tanto las pruebas OIT como OOT se utilizan como herramientas para determinar la actividad de los antioxidantes .
Control de seguridad
La DSC constituye una herramienta de detección inicial de seguridad razonable. En este modo, la muestra se almacenará en un crisol no reactivo (a menudo de oro o acero chapado en oro) y podrá soportar presión (normalmente hasta 100 bar ). La presencia de un evento exotérmico se puede utilizar entonces para evaluar la estabilidad de una sustancia al calor. Sin embargo, debido a una combinación de sensibilidad relativamente baja, velocidades de barrido más lentas de lo normal (normalmente 2-3 °C/min, debido a que el crisol es mucho más pesado) y energía de activación desconocida , es necesario deducir unos 75-100 °C del inicio inicial de la exotermia observada para sugerir una temperatura máxima para el material. Se puede obtener un conjunto de datos mucho más precisos a partir de un calorímetro adiabático , pero dicha prueba puede tardar entre 2 y 3 días desde la temperatura ambiente a una velocidad de incremento de 3 °C por media hora. [ cita requerida ]
Análisis de drogas
La DSC se utiliza ampliamente en las industrias farmacéutica y de polímeros . Para el químico de polímeros, la DSC es una herramienta útil para estudiar los procesos de curado , lo que permite ajustar con precisión las propiedades de los polímeros. La reticulación de las moléculas de polímero que se produce en el proceso de curado es exotérmica, lo que da como resultado un pico negativo en la curva DSC que suele aparecer poco después de la transición vítrea. [15] [16] [17]
En la industria farmacéutica es necesario tener compuestos farmacológicos bien caracterizados para definir los parámetros de procesamiento. Por ejemplo, si es necesario administrar un fármaco en forma amorfa, es deseable procesar el fármaco a temperaturas inferiores a las que puede producirse la cristalización. [16]
Análisis químico general
La depresión del punto de congelación se puede utilizar como una herramienta de análisis de pureza cuando se analiza mediante calorimetría diferencial de barrido. Esto es posible porque el rango de temperatura en el que se funde una mezcla de compuestos depende de sus cantidades relativas. En consecuencia, los compuestos menos puros exhibirán un pico de fusión ensanchado que comienza a una temperatura más baja que un compuesto puro. [16] [17]
Véase también
Referencias
- ^ Freire, Ernesto (1995), Shirley, Bret A. (ed.), "Calorimetría diferencial de barrido", Estabilidad y plegamiento de proteínas: teoría y práctica , Métodos en biología molecular, vol. 40, Totowa, NJ: Humana Press, págs. 191–218, doi :10.1385/0-89603-301-5:191, ISBN 978-1-59259-527-3, PMID 7633523 , consultado el 9 de agosto de 2023
- ^ Yaragalla, Srinivasarao; Mishra, Raghvendra Kumar; Thomas, Sabú; Kalarikkal, Nandakumar; María, Hanna J. (11 de febrero de 2019). Nanorellenos a base de carbono y sus nanocompuestos de caucho. Ciencia Elsevier. ISBN 9780128173428. Recuperado el 10 de mayo de 2023 .
- ^ Patente estadounidense 3.263.484 .
- ^ Biología molecular (en ruso). Vol. 6. Moscú. 1975. págs. 7–33.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Wunderlich B (1990). Análisis térmico . Nueva York: Academic Press. pp. 137-140. ISBN. 0-12-765605-7.
- ^ Yurchenko, Olena; Pernau, Hans-Fridtjof; Engel, Laura; Wöllenstein, Jürgen (16 de junio de 2023). "Técnicas de análisis térmico diferencial como herramienta para el examen preliminar del catalizador para la combustión". Scientific Reports . 13 (1): 9792. Bibcode :2023NatSR..13.9792Y. doi :10.1038/s41598-023-36878-8. ISSN 2045-2322. PMC 10276022 . PMID 37328603.
- ^ Höhne G, Breuer KH, Eysel W (octubre de 1983). "Calorimetría diferencial de barrido: comparación de instrumentos de compensación de potencia y de flujo de calor". Thermochimica Acta . 69 (1–2): 145–151. Código Bibliográfico :1983TcAc...69..145H. doi :10.1016/0040-6031(83)85073-4.
- ^ Missal W, Kita J, Wappler E, Gora F, Kipka A, Bartnitzek T, Bechtold F, Schabbel D, Pawlowski B, Moos R (2010). "Calorímetro de barrido diferencial cerámico miniaturizado con horno y crisol integrados en tecnología LTCC". Procedia Engineering . 5 . Elsevier: 940–943. doi : 10.1016/j.proeng.2010.09.263 . ISSN 1877-7058.
- ^ IOM3. «Análisis térmico simultáneo». www.iom3.org . Consultado el 27 de julio de 2024 .
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ Höhne G, Hemminger WF, Flammersheim HJ (2003). Calorimetría diferencial de barrido . Springer-Verlag. págs.17 y sigs. ISBN 978-3-540-00467-7.
- ^ Schick C, Mathot V (2016). Calorimetría de barrido rápido . Springer. ISBN 978-3-319-31329-0.
- ^ Poel GV, Mathot V (marzo de 2006). "Calorimetría diferencial de barrido de alta velocidad y alto rendimiento (HPer DSC): calibración de temperatura en el modo de calentamiento y enfriamiento y minimización del retardo térmico". Thermochimica Acta . 446 (1–2): 41–54. Bibcode :2006TcAc..446...41V. doi :10.1016/j.tca.2006.02.022.
- ^ Garden JL, Bourgeois O (2016). Nanocalorimetría. En: Bhushan B. (eds) Enciclopedia de nanotecnología . Springer, Dordrecht. doi :10.1007/978-94-017-9780-1_208.
- ^ Schick C, Mukhametzyanov TA, Solomonov BN (septiembre de 2021). "Calorimetría de barrido rápido de materiales orgánicos desde materiales de baja masa molecular hasta polímeros". Reseñas y avances en química . 11 (1–2): 1–72. doi :10.1134/S2079978021010064. S2CID 237539353.
- ^ abcdef Dean JA (1995). Manual de química analítica . Nueva York: McGraw Hill, Inc., págs. 15.1–15.5. ISBN 0-07-016197-6.
- ^ abcdefg Pungor E (1995). Una guía práctica para el análisis instrumental . Florida: Boca Ratón. págs. 181-191.
- ^ abcd Skoog DA, Holler FJ, Nieman T (1998). Principios del análisis instrumental (5.ª ed.). Nueva York. pp. 805–808. ISBN 0-03-002078-6.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Gill, P.; Moghadam, TT; Ranjbar, B. (2010). "Técnicas de calorimetría diferencial de barrido: aplicaciones en biología y nanociencia". Revista de técnicas biomoleculares . 21 (4): 167–193. ISSN 1524-0215. PMC 2977967 . PMID 21119929.
- ^ O'Neill MJ (1964). "El análisis de un calorímetro de barrido controlado por temperatura". Anal. Chem . 36 (7): 1238–1245. doi :10.1021/ac60213a020.
- ^ Schön A, Brown RK, Hutchins BM, Freire E (diciembre de 2013). "Análisis y detección de la unión de ligandos mediante cambio de desnaturalización química". Analytical Biochemistry . 443 (1): 52–7. doi :10.1016/j.ab.2013.08.015. PMC 3809086 . PMID 23994566.
- ^ ab Chiu MH, Prenner EJ (enero de 2011). "Calorimetría diferencial de barrido: una herramienta invaluable para una caracterización termodinámica detallada de macromoléculas y sus interacciones". Journal of Pharmacy & Bioallied Sciences . 3 (1): 39–59. doi : 10.4103/0975-7406.76463 . PMC 3053520 . PMID 21430954.
- ^ Gabbott, Paul (2008). Principios y aplicaciones del análisis térmico . Oxford: Blackwell Pub. ISBN 978-14-051-3171-1.
- ^ Brown, Michael E. (1998). Manual de análisis térmico y calorimetría, volumen 1, primera edición . Elsevier Science. ISBN 978-00-805-3959-1.
- ^ Mortimer, Charles E.; Müller, Ulrich; Beck, Johannes (2015). Chemie: das Basiswissen der Chemie: 410 Abbildungen, 545 Formelbilder (12., korrigierte und aktualisierte Auflage ed.). Stuttgart Nueva York: Georg Thieme Verlag. ISBN 978-31-348-4312-5.
- ^ Wunderlich B (1980). "Capítulo 8, Tabla VIII.6". Física macromolecular . Vol. 3.
Lectura adicional
- Brydson JA (1999). "Capítulo 8: Procesamiento de plásticos térmicos por fusión". Materiales plásticos (7.ª ed.). Butterworth-Heinemann. pág. 161. ISBN 978-0-08-051408-6.
- Ezrin M (1996). Guía de fallas en plásticos: causas y prevención . Hanser-SPE. ISBN 978-1-56990-184-7.
- Wright DC (2001). Agrietamiento por estrés ambiental de plásticos . RAPRA. ISBN 978-1-85957-064-7.
- Lewis PR, Gagg C (2010). Katz E, Halámek J (eds.). Ingeniería forense de polímeros: por qué los productos de polímeros fallan en servicio . Woodhead/CRC Press. ISBN 978-3-527-33894-8.
Enlaces externos
- El resultado de un experimento DSC es una curva de flujo de calor en función de la temperatura o en función del tiempo.



