Factor de ribosilación ADP
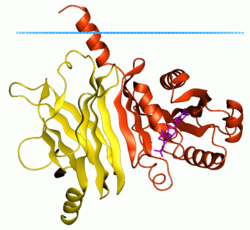 Proteína 2 similar al factor de ribosilación de ADP unida a la membrana ( ratón ARL2 , rojo), complejo con fosfodiesterasa delta (amarillo) ( 1ksg ) Los puntos azules muestran el límite de hidrocarburos de la bicapa lipídica | |||||||||
| Identificadores | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Símbolo | Arf | ||||||||
| Pfam | PF00025 | ||||||||
| Interprofesional | IPR006689 | ||||||||
| ELEGANTE | IRA | ||||||||
| PROSITIO | PDOC01020 | ||||||||
| SCOP2 | 1 hora / ALCANCE / SUPFAM | ||||||||
| Superfamilia OPM | 124 | ||||||||
| Proteína OPM | 1 kgg | ||||||||
| Diligenciamiento de conflictos | cd00878 | ||||||||
| Membranoma | 1103 | ||||||||
| |||||||||

Los factores de ribosilación de ADP ( ARF ) son miembros de la familia ARF de proteínas de unión a GTP de la superfamilia Ras . Las proteínas de la familia ARF son ubicuas en las células eucariotas , y se han identificado seis miembros altamente conservados de la familia en células de mamíferos. Aunque los ARF son solubles, generalmente se asocian con las membranas debido a la miristoilación del extremo N. Funcionan como reguladores del tráfico vesicular y la remodelación de la actina .
Las proteínas pequeñas de unión a GTP, factor de ribosilación de ADP (Arf), son reguladores importantes de la biogénesis de vesículas en el tráfico intracelular. [1] Son los miembros fundadores de una familia en crecimiento que incluye a las proteínas Arl (similares a Arf), Arp (proteínas relacionadas con Arf) y las proteínas Sar (asociadas a la secreción y relacionadas con Ras), remotamente relacionadas. Las proteínas Arf pasan cíclicamente entre formas inactivas unidas a GDP y formas activas unidas a GTP que se unen selectivamente a los efectores. El cambio estructural clásico de GDP/GTP se caracteriza por cambios conformacionales en las denominadas regiones de cambio 1 e cambio 2, que se unen firmemente al fosfato gamma de GTP, pero de manera deficiente o nula al nucleótido GDP. Los estudios estructurales de Arf1 y Arf6 han revelado que, aunque estas proteínas presentan los cambios conformacionales de cambio 1 y 2, se diferencian de otras proteínas pequeñas de unión a GTP en que utilizan un cambio adicional y único para propagar la información estructural de un lado de la proteína al otro.
Los ciclos estructurales GDP/GTP de Arf1 y Arf6 humanos presentan un cambio conformacional único que afecta las cadenas beta2beta3 que conectan el interruptor 1 y el interruptor 2 (interswitch) y también el extremo N helicoidal anfipático. En Arf1 y Arf6 unidos a GDP, el interswitch se retrae y forma un bolsillo al que se une la hélice N-terminal, que actúa como un cerrojo molecular para mantener la conformación inactiva. En la forma unida a GTP de estas proteínas, el interswitch sufre un cambio de registro de dos residuos que eleva el interruptor 1 y el interruptor 2, restaurando una conformación activa que puede unirse a GTP. En esta conformación, el interswitch se proyecta fuera de la proteína y extruye el cerrojo N-terminal ocluyendo su bolsillo de unión.
Proteínas reguladoras
Los ARF se asocian regularmente con dos tipos de proteínas, las que participan en la catálisis del intercambio de GTP/GDP y las que cumplen otras funciones. Los ARF actúan como una subunidad reguladora que controla el ensamblaje de la capa en la proteína de la capa I ( COPI ) y las vesículas recubiertas de clatrina . [ cita requerida ]
Proteínas de intercambio GTP/GDP
El ARF se une a dos formas del nucleótido de guanosina, el trifosfato de guanosina (GTP) y el difosfato de guanosina (GDP). La forma de la molécula de ARF depende de la forma a la que se une, lo que le permite cumplir una función reguladora. El ARF necesita la ayuda de otras proteínas para cambiar entre la unión a GTP y GDP. Las proteínas activadoras de GTPasa (GAP) obligan al ARF a hidrolizar el GTP unido a GDP, y los factores de intercambio de nucleótidos de guanina obligan al ARF a adoptar una nueva molécula de GTP en lugar de un GDP unido.
Otras proteínas
Otras proteínas interactúan con ARF, dependiendo de si está o no unido a GTP o GDP. La forma activa, ARF*GTP, se une a las proteínas de la capa de vesículas y a los adaptadores, incluida la proteína de la capa I (COPI) y varios fosfolípidos. Se sabe que la forma inactiva solo se une a una clase de proteínas transmembrana. Los diferentes tipos de ARF se unen específicamente a diferentes tipos de proteínas efectoras.
Filogenia
Actualmente se conocen 6 proteínas ARF de mamíferos, que se dividen en tres clases de ARF:
- Clase 1: ARF1 , ARF2 , ARF3
- Clase 2: ARF4 , ARF5
- Clase 3: ARF6 . (Véase también ARF6 )
Estructura
Los ARF son proteínas pequeñas de aproximadamente 20 kDa de tamaño. Contienen dos regiones de conmutación, que cambian sus posiciones relativas entre los ciclos de unión de GDP/GTP. Los ARF suelen estar miristoilados en su región N-terminal, lo que contribuye a su asociación con la membrana.
Ejemplos
Los genes humanos que codifican proteínas que contienen este dominio incluyen:
- ARF1 ARF3 ARF4 ARF5 ARF6 ARFRP1
- ARL1 ARL2 ARL2L1 ARL3 ARL4A ARL4C ARL4D ARL5 ARL5A ARL5B
- ARL10 ARL11 ARL13A ARL13B ARL14 ARL15 ARL16 ARL17
- ARL6 ARL7 ARL8A ARL8B ARL9
- MGC57346
- SAR1A SAR1B SAR1P3 SARA1 RECORTE23
Véase también
Referencias
Lectura adicional
- Donaldson JG, Honda A (2005). "Localización y función de las GTPasas de la familia Arf". Biochemical Society Transactions . 33 (4): 639–642. doi :10.1042/BST0330639. PMID 16042562.
- Nie Z, Hirsch DS, Randazzo PA (2003). "Arf y sus numerosos interactores". Current Opinion in Cell Biology . 15 (4): 396–404. doi :10.1016/S0955-0674(03)00071-1. PMID 12892779.
- Amor JC, Harrison DH, Kahn RA, Ringe D (1994). "Estructura del factor 1 de ADP-ribosilación humano en complejo con GDP". Nature . 372 (6507): 704–708. Bibcode :1994Natur.372..704C. doi :10.1038/372704a0. PMID 7990966. S2CID 4362056.
- Moss J, Vaughan M; Vaughan (1995). "Estructura y función de las proteínas ARF: activadores de la toxina del cólera y componentes críticos de los procesos de transporte vesicular intracelular". The Journal of Biological Chemistry . 270 (21): 12327–12330. doi : 10.1074/jbc.270.21.12327 . PMID 7759471.
- Boman AL, Kahn RA; Kahn (1995). "Proteínas Arf: ¿La policía del tráfico de membrana?". Tendencias en Ciencias Bioquímicas . 20 (4): 147–150. doi :10.1016/s0968-0004(00)88991-4. PMID 7770914.
- Kahn RA, Kern FG, Clark J, Gelmann EP, Rulka C (1991). "Factores de ADP-ribosilación humanos. Una familia funcionalmente conservada de proteínas de unión a GTP". The Journal of Biological Chemistry . 266 (4): 2606–2614. doi : 10.1016/S0021-9258(18)52288-2 . PMID 1899243.
Enlaces externos
- Recurso de motivo lineal eucariota de clase TRG_Cilium_Arf4_1