Antitrombina
| SERPINC1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | SERPINC1 , AT3, AT3D, ATIII, THPH7, miembro 1 de la familia C de serpin, ATIII-R2, ATIII-T2, ATIII-T1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 107300; MGI : 88095; HomoloGene : 20139; Tarjetas genéticas : SERPINC1; OMA :SERPINC1 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La antitrombina (AT) es una pequeña glicoproteína que inactiva varias enzimas del sistema de coagulación . Es una proteína de 464 aminoácidos producida por el hígado . Contiene tres enlaces disulfuro y un total de cuatro posibles sitios de glicosilación . La α-antitrombina es la forma dominante de antitrombina que se encuentra en el plasma sanguíneo y tiene un oligosacárido que ocupa cada uno de sus cuatro sitios de glicosilación. Un solo sitio de glicosilación permanece constantemente desocupado en la forma menor de antitrombina, la β-antitrombina. [5] Su actividad aumenta muchas veces por el fármaco anticoagulante heparina , que mejora la unión de la antitrombina al factor IIa (trombina) y al factor Xa . [6]
Estructura
La antitrombina también se denomina antitrombina III (AT III). Las denominaciones antitrombina I a antitrombina IV tienen su origen en los primeros estudios realizados en la década de 1950 por Seegers, Johnson y Fell. [7]
La antitrombina I (AT I) se refiere a la unión de la trombina a la fibrina , después de que la trombina ha activado el fibrinógeno , en un sitio de unión no catalítico de la trombina. La antitrombina II (AT II) se refiere a un cofactor en el plasma, que junto con la heparina interfiere con la interacción de la trombina y el fibrinógeno . La antitrombina III (AT III) se refiere a una sustancia en el plasma que inactiva la trombina. La antitrombina IV (AT IV) se refiere a una antitrombina que se activa durante y poco después de la coagulación sanguínea . [8] Solo la AT III y posiblemente la AT I son médicamente significativas. La AT III generalmente se conoce únicamente como "antitrombina" y es la antitrombina III la que se analiza en este artículo.

La antitrombina tiene una vida media en el plasma sanguíneo de alrededor de 3 días. [9] La concentración normal de antitrombina en el plasma sanguíneo humano es alta, aproximadamente 0,12 mg/ml, lo que equivale a una concentración molar de 2,3 μM. [10] La antitrombina se ha aislado del plasma de una gran cantidad de especies además de los humanos. [11] Como se deduce de la secuenciación de proteínas y ADNc , las antitrombinas de vaca, oveja, conejo y ratón tienen 433 aminoácidos de longitud, que es un aminoácido más largo que la antitrombina humana. Se cree que el aminoácido adicional se encuentra en la posición de aminoácido 6. Las antitrombinas de vaca, oveja, conejo, ratón y humanos comparten entre el 84 y el 89% de identidad de secuencia de aminoácidos. [12] Seis de los aminoácidos forman tres enlaces disulfuro intramoleculares , Cys 8-Cys128, Cys21-Cys95 y Cys248-Cys430. Todos ellos tienen cuatro sitios potenciales de N-glicosilación . Estos se encuentran en los aminoácidos 96, 135, 155 y 192 de la asparagina (Asn) en los seres humanos y en números de aminoácidos similares en otras especies. Todos estos sitios están ocupados por cadenas laterales de oligosacáridos unidas covalentemente en la forma predominante de la antitrombina humana, la α-antitrombina, lo que da como resultado un peso molecular para esta forma de antitrombina de 58.200. [5] El sitio potencial de glicosilación en la asparagina 135 no está ocupado en una forma menor (alrededor del 10 %) de la antitrombina, la β-antitrombina (véase la Figura 1 ). [13]
Se han producido antitrombinas recombinantes con propiedades similares a las de la antitrombina humana normal utilizando células de insectos infectadas con baculovirus y líneas celulares de mamíferos cultivadas en cultivos celulares . [14] [15] [16] [17] Estas antitrombinas recombinantes generalmente tienen patrones de glicosilación diferentes a la antitrombina normal y se utilizan típicamente en estudios estructurales de la antitrombina. Por esta razón, muchas de las estructuras de antitrombina almacenadas en el banco de datos de proteínas y presentadas en este artículo muestran patrones de glicosilación variables.
La antitrombina comienza en su estado nativo, que tiene una energía libre mayor que el estado latente, al que se desintegra en promedio después de 3 días. El estado latente tiene la misma forma que el estado activado, es decir, cuando inhibe a la trombina. Como tal, es un ejemplo clásico de la utilidad del control cinético frente al termodinámico del plegamiento de proteínas.
Función


La antitrombina es una serpina (inhibidor de la serina proteasa) y, por lo tanto, su estructura es similar a la de la mayoría de los demás inhibidores de la proteasa plasmática , como la alfa 1-antiquimotripsina , la alfa 2-antiplasmina y el cofactor II de heparina .
Las proteasas diana fisiológicas de la antitrombina son las de la vía de activación por contacto (antes conocida como vía intrínseca), es decir, las formas activadas del factor X (Xa), factor IX (IXa), factor XI (XIa), factor XII (XIIa) y, en mayor medida, factor II (trombina) (IIa), y también la forma activada del factor VII (VIIa) de la vía del factor tisular (antes conocida como vía extrínseca). [20] El inhibidor también inactiva la calicreína y la plasmina [ cita requerida ] , también implicadas en la coagulación sanguínea. Sin embargo, inactiva otras serina proteasas que no están implicadas en la coagulación, como la tripsina y la subunidad C1s de la enzima C1 implicada en la vía clásica del complemento . [12] [21]
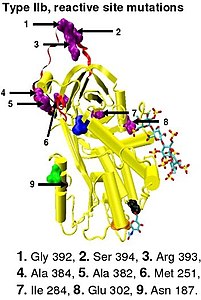
La inactivación de la proteasa se produce como consecuencia de atrapar la proteasa en un complejo equimolar con la antitrombina en el que el sitio activo de la enzima proteasa es inaccesible a su sustrato habitual . [12] La formación de un complejo antitrombina-proteasa implica una interacción entre la proteasa y un enlace peptídico reactivo específico dentro de la antitrombina. En la antitrombina humana, este enlace es entre la arginina (arg) 393 y la serina (ser) 394 (ver Figura 2 y Figura 3 ). [12]
Se cree que las enzimas proteasas quedan atrapadas en complejos antitrombina-proteasa inactivos como consecuencia de su ataque al enlace reactivo. Aunque atacar un enlace similar dentro del sustrato de proteasa normal da como resultado una rápida escisión proteolítica del sustrato, iniciar un ataque al enlace reactivo de la antitrombina hace que la antitrombina se active y atrape la enzima en una etapa intermedia del proceso proteolítico. Con el tiempo, la trombina puede escindir el enlace reactivo dentro de la antitrombina y un complejo antitrombina-trombina inactivo se disociará, sin embargo, el tiempo que tarda en ocurrir esto puede ser mayor a 3 días. [22] Sin embargo, los enlaces P3-P4 y P1'-P2' pueden ser escindidos rápidamente por la elastasa de neutrófilos y la enzima bacteriana termolisina , respectivamente, lo que da como resultado antitrombinas inactivas que ya no pueden inhibir la actividad de la trombina. [23]
La tasa de inhibición de la actividad de la proteasa por parte de la antitrombina aumenta considerablemente mediante su unión adicional a la heparina , al igual que su inactivación por la elastasa de los neutrófilos . [23]
Antitrombina y heparina
La antitrombina inactiva sus enzimas diana fisiológicas, la trombina, el factor Xa y el factor IXa con constantes de velocidad de 7-11 x 10 3 , 2,5 x 10 3 M −1 s −1 y 1 x 10 M −1 s −1 respectivamente. [5] [24] La velocidad de inactivación de antitrombina-trombina aumenta a 1,5 - 4 x 10 7 M −1 s −1 en presencia de heparina, es decir, la reacción se acelera 2000-4000 veces. [25] [26] [27] [28] La inhibición del factor Xa se acelera solo de 500 a 1000 veces en presencia de heparina y la constante de velocidad máxima es 10 veces menor que la de la inhibición de la trombina. [25] [28] La mejora de la tasa de inhibición del factor IXa por antitrombina muestra una mejora aproximada de 1 millón de veces en presencia de heparina y niveles fisiológicos de calcio . [24]
La AT-III se une a una secuencia de sulfatación de pentasacárido específica contenida dentro del polímero de heparina.
GlcNAc/NS(6S)-GlcA-GlcNS(3S,6S)-IdoA(2S)-GlcNS(6S)
Al unirse a esta secuencia de pentasacárido, la inhibición de la actividad de la proteasa aumenta por la heparina como resultado de dos mecanismos distintos. [29] En un mecanismo, la estimulación por heparina de la inhibición del factor IXa y Xa depende de un cambio conformacional dentro de la antitrombina que involucra el bucle del sitio reactivo y, por lo tanto, es alostérico . [30] En otro mecanismo, la estimulación de la inhibición de la trombina depende de la formación de un complejo ternario entre AT-III, trombina y heparina. [30]
Activación alostérica

La mayor inhibición del factor IXa y Xa requiere la mínima secuencia de pentasacáridos de heparina. Los cambios conformacionales que ocurren dentro de la antitrombina en respuesta a la unión de pentasacáridos están bien documentados. [18] [31] [32]
En ausencia de heparina, los aminoácidos P14 y P15 (ver Figura 3 ) del bucle del sitio reactivo se encuentran incrustados dentro del cuerpo principal de la proteína (específicamente en la parte superior de la lámina beta A). Esta característica es común con otras serpinas como el cofactor II de la heparina , la alfa 1-antiquimotripsina y la MENT .
El cambio conformacional más relevante para la inhibición del factor IXa y Xa involucra a los aminoácidos P14 y P15 dentro de la región N-terminal del bucle del sitio reactivo (encerrado en un círculo en la Figura 4 modelo B ). Esta región ha sido denominada región bisagra. El cambio conformacional dentro de la región bisagra en respuesta a la unión de la heparina resulta en la expulsión de P14 y P15 del cuerpo principal de la proteína y se ha demostrado que al prevenir este cambio conformacional, no ocurre una mayor inhibición del factor IXa y Xa. [30] Se piensa que la mayor flexibilidad dada al bucle del sitio reactivo como resultado del cambio conformacional de la región bisagra es un factor clave que influye en la mayor inhibición del factor IXa y Xa. Se ha calculado que en ausencia del pentasacárido solo una de cada 400 moléculas de antitrombina (0,25%) está en una conformación activa con los aminoácidos P14 y P15 expulsados. [30]
Activación no alostérica

Para aumentar la inhibición de la trombina se necesita el pentasacárido de heparina mínimo más al menos 13 unidades monoméricas adicionales. [33] Se cree que esto se debe a que la antitrombina y la trombina deben unirse a la misma cadena de heparina adyacente entre sí. Esto se puede ver en la serie de modelos que se muestran en la Figura 5 .
En las estructuras que se muestran en la Figura 5, la porción C-terminal (lado P') del bucle del sitio reactivo tiene una conformación extendida en comparación con otras estructuras de antitrombina no activadas o activadas con heparina. [34] La región P' de la antitrombina es inusualmente larga en relación con la región P' de otras serpinas y en las estructuras de antitrombina no activadas o activadas con heparina forma un giro β fuertemente unido por enlaces de hidrógeno . La elongación P' ocurre a través de la ruptura de todos los enlaces de hidrógeno involucrados en el giro β . [34]
La región bisagra de la antitrombina en el complejo de la Figura 5 no pudo ser modelada debido a su flexibilidad conformacional, y los aminoácidos P9-P14 no se ven en esta estructura. Esta flexibilidad conformacional indica que puede existir un equilibrio dentro del complejo entre una conformación de antitrombina insertada en bucle con el sitio reactivo P14 P15 y una conformación de antitrombina expulsada en bucle con el sitio reactivo P14 P15. En apoyo de esto, el análisis de la posición de P15 Gly en el complejo de la Figura 5 (marcado en el modelo B) muestra que está insertado en la lámina beta A (ver modelo C). [34]
Efecto de la glicosilación sobre la actividad
La α-antitrombina y la β-antitrombina difieren en su afinidad por la heparina. [35] La diferencia en la constante de disociación entre las dos es tres veces mayor para el pentasacárido que se muestra en la Figura 3 y más de diez veces mayor para la heparina de longitud completa, siendo la β-antitrombina la que tiene una mayor afinidad. [36] Se cree que la mayor afinidad de la β-antitrombina se debe a la mayor velocidad a la que se producen cambios conformacionales posteriores dentro de la proteína tras la unión inicial a la heparina. En el caso de la α-antitrombina, no se cree que la glicosilación adicional en Asn-135 interfiera con la unión inicial a la heparina, sino que inhiba cualquier cambio conformacional resultante. [35]
Aunque su presencia es de tan solo el 5-10% de los niveles de α-antitrombina, debido a su mayor afinidad por la heparina, se cree que la β-antitrombina es más importante que la α-antitrombina en el control de los eventos trombogénicos resultantes de la lesión tisular. De hecho, la inhibición de la trombina después de una lesión de la aorta se ha atribuido únicamente a la β-antitrombina. [37]
Deficiencias
La evidencia del importante papel que desempeña la antitrombina en la regulación de la coagulación sanguínea normal se demuestra por la correlación entre las deficiencias heredadas o adquiridas de antitrombina y un mayor riesgo de que cualquier individuo afectado desarrolle enfermedad trombótica. [38] La deficiencia de antitrombina generalmente sale a la luz cuando un paciente sufre trombosis venosa recurrente y embolia pulmonar .
Deficiencia adquirida de antitrombina
La deficiencia adquirida de antitrombina se produce como resultado de tres mecanismos claramente diferentes. El primer mecanismo es el aumento de la excreción que puede ocurrir con la insuficiencia renal asociada con el síndrome nefrótico con proteinuria . El segundo mecanismo resulta de la disminución de la producción como se observa en la insuficiencia hepática o cirrosis o un hígado inmaduro secundario a un nacimiento prematuro . El tercer mecanismo resulta del consumo acelerado que es más pronunciado como consecuencia de un traumatismo grave , pero también puede verse en menor escala como resultado de intervenciones como una cirugía mayor o una derivación cardiopulmonar . [39]
Deficiencia hereditaria de antitrombina
La incidencia de la deficiencia hereditaria de antitrombina se ha estimado entre 1:2000 y 1:5000 en la población normal, y la primera familia que padeció deficiencia hereditaria de antitrombina se describió en 1965. [40] [41] Posteriormente, se propuso que la clasificación de la deficiencia hereditaria de antitrombina se designara como tipo I o tipo II, basándose en análisis funcionales e inmunoquímicos de antitrombina. [42] El mantenimiento de un nivel adecuado de actividad de antitrombina, que sea al menos el 70% del nivel funcional normal, es esencial para asegurar una inhibición eficaz de las proteasas de coagulación sanguínea. [43] Típicamente, como resultado de la deficiencia de antitrombina tipo I o tipo II, los niveles de antitrombina funcional se reducen a menos del 50% de lo normal. [44]
Deficiencia de antitrombina tipo I
La deficiencia de antitrombina de tipo I se caracteriza por una disminución tanto de la actividad de la antitrombina como de la concentración de antitrombina en la sangre de los individuos afectados. La deficiencia de tipo I se dividió originalmente en dos subgrupos, Ia y Ib, según la afinidad por la heparina. La antitrombina de los individuos del subgrupo Ia mostró una afinidad normal por la heparina, mientras que la antitrombina de los individuos del subgrupo Ib mostró una afinidad reducida por la heparina. [45] El análisis funcional posterior de un grupo de casos 1b reveló que no solo tenían una afinidad reducida por la heparina, sino también anomalías múltiples o "pleiotróficas" que afectaban al sitio reactivo, al sitio de unión de la heparina y a la concentración sanguínea de antitrombina. En un sistema revisado de clasificación adoptado por el Comité Científico y de Normalización de la Sociedad Internacional de Trombosis y Hemostasia, los casos de tipo Ib se designan ahora como EP de tipo II, efecto pleiotrófico. [46]
La mayoría de los casos de deficiencia de tipo I se deben a mutaciones puntuales , deleciones o inserciones menores en el gen de la antitrombina. Estas mutaciones genéticas dan lugar a la deficiencia de tipo I a través de diversos mecanismos:
- Las mutaciones pueden producir antitrombinas inestables que pueden no exportarse correctamente a la sangre una vez completada la biosíntesis o existir en la sangre durante un período de tiempo más corto, por ejemplo, la eliminación de 6 pares de bases en los codones 106-108. [47]
- Las mutaciones pueden afectar el procesamiento del ARNm del gen de la antitrombina.
- Inserciones o deleciones menores pueden provocar mutaciones por cambio de marco y la terminación prematura del gen de la antitrombina.
- Las mutaciones puntuales también pueden dar lugar a la generación prematura de un codón de terminación o de parada , por ejemplo, la mutación del codón 129, CGA → TGA ( UGA después de la transcripción), reemplaza un codón normal para arginina con un codón de terminación. [48]
Deficiencia de antitrombina tipo II
La deficiencia de antitrombina de tipo II se caracteriza por niveles normales de antitrombina pero una actividad reducida de la misma en la sangre de los individuos afectados. Originalmente se propuso que la deficiencia de tipo II se dividiera en tres subgrupos (IIa, IIb y IIc) dependiendo de qué actividad funcional de la antitrombina se reduzca o se conserve. [45]
- Subgrupo IIa: Disminución de la inactivación de la trombina, disminución de la inactivación del factor Xa y disminución de la afinidad por la heparina.
- Subgrupo IIb: Inactivación disminuida de la trombina y afinidad normal por la heparina.
- Subgrupo IIc: Inactivación normal de la trombina, inactivación normal del factor Xa y afinidad disminuida por la heparina.
En el sistema revisado de clasificación adoptado nuevamente por el Comité Científico y de Normalización de la Sociedad Internacional de Trombosis y Hemostasia, la deficiencia de antitrombina tipo II sigue subdividida en tres subgrupos: la ya mencionada EP tipo II, junto con la RS tipo II, donde las mutaciones afectan el sitio reactivo y la HBS tipo II, donde las mutaciones afectan el sitio de unión de la heparina a la antitrombina. [46] Para los fines de una base de datos mutacional de antitrombina compilada por miembros del Subcomité de Inhibidores de la Coagulación Plasmática del Comité Científico y de Normalización de la Sociedad Internacional de Trombosis y Hemostasia, los casos de tipo IIa ahora se clasifican como EP tipo II, los casos de tipo IIb como RS tipo II y los casos de tipo IIc como HBS tipo II. [49]
Topónimos
En la actualidad, es relativamente fácil caracterizar una mutación genética específica de la antitrombina. Sin embargo, antes de que se utilizaran las técnicas de caracterización modernas, los investigadores denominaban a las mutaciones en función de la ciudad en la que residía el individuo que padecía la deficiencia, es decir, la mutación de la antitrombina se designaba como un topónimo . [50] La caracterización mutacional moderna ha demostrado desde entonces que muchos topónimos de la antitrombina son en realidad el resultado de la misma mutación genética; por ejemplo, antitrombina-Toyama es equivalente a antitrombina-Kumamoto, -Amien, -Tours, -París-1, -París-2, -Alger, -Padua-2 y -Barcelona. [49]
Usos médicos
La antitrombina se utiliza como una proteína terapéutica que puede purificarse a partir del plasma humano [51] o producirse de forma recombinante (por ejemplo, Atryn, que se produce en la leche de cabras genéticamente modificadas [52] [53] ).
Está aprobado por la FDA como anticoagulante para la prevención de coágulos antes, durante o después de la cirugía o el parto en pacientes con deficiencia hereditaria de antitrombina. [51] [53]
Se ha estudiado su uso en casos de sepsis para reducir la coagulación intravascular difusa y otros efectos secundarios, pero no se ha demostrado que aporte ningún beneficio en pacientes con sepsis gravemente enfermos. [54]
Antitrombina escindida y latente

La escisión en el sitio reactivo da como resultado el atrapamiento de la proteasa de trombina, con el movimiento del bucle del sitio reactivo escindido junto con la proteasa unida, de modo que el bucle forma una sexta cadena adicional en el medio de la hoja beta A. Este movimiento del bucle del sitio reactivo también se puede inducir sin escisión, con la estructura cristalográfica resultante siendo idéntica a la de la conformación fisiológicamente latente del inhibidor del activador del plasminógeno-1 (PAI-1). [55] Por esta razón, la conformación de la antitrombina en la que el bucle del sitio reactivo se incorpora sin escindir en el cuerpo principal de la proteína se denomina antitrombina latente. A diferencia del PAI-1, la transición de la antitrombina de una conformación normal o nativa a una conformación latente es irreversible.
La antitrombina nativa se puede convertir en antitrombina latente (L-antitrombina) calentándola sola o calentándola en presencia de citrato . [56] [57] Sin embargo, sin un calentamiento extremo y a 37 °C (temperatura corporal), el 10 % de toda la antitrombina que circula en la sangre se convierte en L-antitrombina en un período de 24 horas. [58] [59] La estructura de la L-antitrombina se muestra en la Figura 6 .
La estructura tridimensional de la antitrombina nativa se determinó por primera vez en 1994. [31] [32] Inesperadamente, la proteína cristalizó como un heterodímero compuesto por una molécula de antitrombina nativa y una molécula de antitrombina latente. La antitrombina latente, al formarse, se une inmediatamente a una molécula de antitrombina nativa para formar el heterodímero, y no es hasta que la concentración de antitrombina latente supera el 50% de la antitrombina total que se puede detectar analíticamente. [59] La forma latente de la antitrombina no solo es inactiva contra las proteasas de coagulación que son su objetivo, sino que su dimerización con una molécula de antitrombina nativa que de otro modo estaría activa también da como resultado la inactivación de las moléculas nativas. El impacto fisiológico de la pérdida de la actividad de la antitrombina, ya sea a través de la formación de antitrombina latente o a través de la formación posterior de dímeros, se ve exacerbado por la preferencia por la dimerización que ocurre entre la β-antitrombina activada por heparina y la antitrombina latente en oposición a la α-antitrombina. [59]
También se ha aislado una forma de antitrombina que es un intermediario en la conversión entre las formas nativa y latente de antitrombina y se la ha denominado antitrombina prelatente . [60]
Antitrombina antiangiogénica
La angiogénesis es un proceso fisiológico que implica el crecimiento de nuevos vasos sanguíneos a partir de vasos preexistentes. En condiciones fisiológicas normales, la angiogénesis está estrechamente regulada y controlada por un equilibrio de estimuladores angiogénicos e inhibidores angiogénicos . El crecimiento del tumor depende de la angiogénesis y durante el desarrollo del tumor se requiere una producción sostenida de factores estimuladores angiogénicos junto con una reducción en la cantidad de factores inhibidores angiogénicos que producen las células tumorales. [61] La forma escindida y latente de la antitrombina inhibe potentemente la angiogénesis y el crecimiento del tumor en modelos animales. [62] Se ha demostrado que la forma prelatente de la antitrombina inhibe la angiogénesis in vitro , pero hasta la fecha no se ha probado en modelos animales experimentales.
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000117601 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000026715 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ abc Bjork I, Olson, JE (1997). Antitrombina, una serpina de gran importancia (en Química y biología de las serpinas) . Plenum Press. págs. 17–33. ISBN 978-0-306-45698-5.
- ^ Finley A, Greenberg C (junio de 2013). "Artículo de revisión: sensibilidad y resistencia a la heparina: manejo durante la derivación cardiopulmonar". Anestesia y analgesia . 116 (6): 1210–1222. doi : 10.1213/ANE.0b013e31827e4e62 . PMID 23408671. S2CID 22500786.
- ^ Seegers WH, Johnson JF, Fell C (enero de 1954). "Una reacción de antitrombina a la activación de la protrombina". The American Journal of Physiology . 176 (1): 97–103. doi :10.1152/ajplegacy.1953.176.1.97. PMID 13124503.
- ^ Yin ET, Wessler S, Stoll PJ (junio de 1971). "Identidad del inhibidor del factor X activado por plasma con antitrombina 3 y cofactor de heparina". The Journal of Biological Chemistry . 246 (11): 3712–3719. doi : 10.1016/S0021-9258(18)62185-4 . PMID 4102937.
- ^ Collen D, Schetz J, de Cock F, Holmer E, Verstraete M (febrero de 1977). "Metabolismo de la antitrombina III (cofactor de la heparina) en el hombre: efectos de la trombosis venosa y de la administración de heparina". Revista Europea de Investigación Clínica . 7 (1): 27–35. doi :10.1111/j.1365-2362.1977.tb01566.x. PMID 65284. S2CID 22494710.
- ^ Conard J, Brosstad F, Lie Larsen M, Samama M, Abildgaard U (1983). "Concentración molar de antitrombina en plasma humano normal". Hemostasia . 13 (6): 363–368. doi :10.1159/000214823. PMID 6667903.
- ^ Jordan RE (diciembre de 1983). "Antitrombina en especies de vertebrados: conservación del mecanismo anticoagulante dependiente de la heparina". Archivos de bioquímica y biofísica . 227 (2): 587–595. doi :10.1016/0003-9861(83)90488-5. PMID 6607710.
- ^ abcd Olson ST, Björk I (1994). "Regulación de la actividad de la trombina por la antitrombina y la heparina". Seminarios sobre trombosis y hemostasia . 20 (4): 373–409. doi :10.1055/s-2007-1001928. PMID 7899869. S2CID 28872063.
- ^ Brennan SO, George PM, Jordan RE (julio de 1987). "La variante fisiológica de la antitrombina III carece de cadena lateral de carbohidratos en Asn 135". FEBS Letters . 219 (2): 431–436. Bibcode :1987FEBSL.219..431B. doi :10.1016/0014-5793(87)80266-1. PMID 3609301. S2CID 35438503.
- ^ Stephens AW, Siddiqui A, Hirs CH (junio de 1987). "Expresión de antitrombina humana III funcionalmente activa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 84 (11): 3886–3890. Bibcode :1987PNAS...84.3886S. doi : 10.1073/pnas.84.11.3886 . PMC 304981 . PMID 3473488.
- ^ Zettlmeissl G, Conradt HS, Nimtz M, Karges HE (diciembre de 1989). "Caracterización de la antitrombina III humana recombinante sintetizada en células de ovario de hámster chino". The Journal of Biological Chemistry . 264 (35): 21153–21159. doi : 10.1016/S0021-9258(19)30060-2 . PMID 2592368.
- ^ Gillespie LS, Hillesland KK, Knauer DJ (febrero de 1991). "Expresión de antitrombina humana III biológicamente activa por baculovirus recombinante en células de Spodoptera frugiperda". The Journal of Biological Chemistry . 266 (6): 3995–4001. doi : 10.1016/S0021-9258(19)67892-0 . PMID 1995647.
- ^ Ersdal-Badju E, Lu A, Peng X, Picard V, Zendehrouh P, Turk B, et al. (agosto de 1995). "Eliminación de la heterogeneidad de la glicosilación que afecta la afinidad por la heparina de la antitrombina III humana recombinante mediante la expresión de una variante similar a la beta en células de insectos infectadas con baculovirus". The Biochemical Journal . 310 (Parte 1) (Parte 1): 323–330. doi :10.1042/bj3100323. PMC 1135891 . PMID 7646463.
- ^ ab Whisstock JC, Pike RN, Jin L, Skinner R, Pei XY, Carrell RW, et al. (septiembre de 2000). "Cambios conformacionales en serpinas: II. El mecanismo de activación de la antitrombina por la heparina". Journal of Molecular Biology . 301 (5): 1287–1305. doi :10.1006/jmbi.2000.3982. PMID 10966821.
- ^ Schechter I, Berger A (abril de 1967). "Sobre el tamaño del sitio activo en las proteasas. I. Papaína". Comunicaciones de investigación bioquímica y biofísica . 27 (2): 157–162. doi :10.1016/S0006-291X(67)80055-X. PMID 6035483.
- ^ Persson E, Bak H, Olsen OH (agosto de 2001). "La sustitución de valina por leucina 305 en el factor VIIa aumenta la actividad enzimática intrínseca". The Journal of Biological Chemistry . 276 (31): 29195–29199. doi : 10.1074/jbc.M102187200 . PMID 11389142.
- ^ Ogston D, Murray J, Crawford GP (septiembre de 1976). "Inhibición de la subunidad Cls activada del primer componente del complemento por la antitrombina III en presencia de heparina". Thrombosis Research . 9 (3): 217–222. doi :10.1016/0049-3848(76)90210-3. PMID 982345.
- ^ Danielsson A, Björk I (octubre de 1980). "La disociación lenta y espontánea del complejo antitrombina-trombina produce una forma modificada proteolíticamente del inhibidor". FEBS Letters . 119 (2): 241–244. Bibcode :1980FEBSL.119..241D. doi :10.1016/0014-5793(80)80262-6. PMID 7428936. S2CID 40067251.
- ^ ab Chang WS, Wardell MR, Lomas DA, Carrell RW (marzo de 1996). "Sondeo de conformaciones de bucle reactivo de serpinas mediante escisión proteolítica". The Biochemical Journal . 314 (Parte 2) (Parte 2): 647–653. doi :10.1042/bj3140647. PMC 1217096 . PMID 8670081.
- ^ ab Bedsted T, Swanson R, Chuang YJ, Bock PE, Björk I, Olson ST (julio de 2003). "La heparina y los iones de calcio mejoran drásticamente la reactividad de la antitrombina con el factor IXa al generar nuevos exositios de interacción". Biochemistry . 42 (27): 8143–8152. doi :10.1021/bi034363y. PMID 12846563.
- ^ ab Jordan RE, Oosta GM, Gardner WT, Rosenberg RD (noviembre de 1980). "La cinética de las interacciones enzima hemostática-antitrombina en presencia de heparina de bajo peso molecular". The Journal of Biological Chemistry . 255 (21): 10081–10090. doi : 10.1016/S0021-9258(19)70431-1 . PMID 6448846.
- ^ Griffith MJ (julio de 1982). "Cinética de la reacción antitrombina III/trombina potenciada por heparina. Evidencia de un modelo de plantilla para el mecanismo de acción de la heparina". The Journal of Biological Chemistry . 257 (13): 7360–7365. doi : 10.1016/S0021-9258(18)34385-0 . PMID 7085630.
- ^ Olson ST, Björk I (abril de 1991). "Contribución predominante de la aproximación de la superficie al mecanismo de aceleración de la reacción antitrombina-trombina por la heparina. Elucidación a partir de los efectos de la concentración de sal". The Journal of Biological Chemistry . 266 (10): 6353–6364. doi : 10.1016/S0021-9258(18)38125-0 . PMID 2007588.
- ^ ab Olson ST, Björk I, Sheffer R, Craig PA, Shore JD, Choay J (junio de 1992). "Papel del pentasacárido que se une a la antitrombina en la aceleración de las reacciones de antitrombina-proteinasa por la heparina. Resolución de la contribución del cambio conformacional de la antitrombina a la mejora de la velocidad de la heparina". The Journal of Biological Chemistry . 267 (18): 12528–12538. doi : 10.1016/S0021-9258(18)42309-5 . PMID 1618758.
- ^ Johnson DJ, Langdown J, Li W, Luis SA, Baglin TP, Huntington JA (noviembre de 2006). "La estructura cristalina de la antitrombina nativa monomérica revela una nueva conformación de bucle central reactivo". The Journal of Biological Chemistry . 281 (46): 35478–35486. doi : 10.1074/jbc.M607204200 . PMC 2679979 . PMID 16973611.
- ^ abcd Langdown J, Johnson DJ, Baglin TP, Huntington JA (noviembre de 2004). "La activación alostérica de la antitrombina depende críticamente de la extensión de la región bisagra". The Journal of Biological Chemistry . 279 (45): 47288–47297. doi : 10.1074/jbc.M408961200 . PMID 15326167.
- ^ ab Schreuder HA, de Boer B, Dijkema R, Mulders J, Theunissen HJ, Grootenhuis PD, et al. (Enero de 1994). "El complejo de antitrombina III humana intacto y escindido como modelo para las interacciones serpina-proteinasa". Biología estructural de la naturaleza . 1 (1): 48–54. doi :10.1038/nsb0194-48. PMID 7656006. S2CID 39110624.
- ^ ab Carrell RW, Stein PE, Fermi G, Wardell MR (abril de 1994). "Implicaciones biológicas de una estructura 3 A de la antitrombina dimérica". Structure . 2 (4): 257–270. doi : 10.1016/S0969-2126(00)00028-9 . PMID 8087553.
- ^ Petitou M, Hérault JP, Bernat A, Driguez PA, Duchaussoy P, Lormeau JC, et al. (Abril de 1999). "Síntesis de miméticos de heparina inhibidores de trombina sin efectos secundarios". Naturaleza . 398 (6726): 417–422. Código Bib :1999Natur.398..417P. doi :10.1038/18877. PMID 10201371. S2CID 4339441.
- ^ abc Li W, Johnson DJ, Esmon CT, Huntington JA (septiembre de 2004). "La estructura del complejo ternario antitrombina-trombina-heparina revela el mecanismo antitrombótico de la heparina". Nature Structural & Molecular Biology . 11 (9): 857–862. doi :10.1038/nsmb811. PMID 15311269. S2CID 28790576.
- ^ ab McCoy AJ, Pei XY, Skinner R, Abrahams JP, Carrell RW (febrero de 2003). "Estructura de la beta-antitrombina y el efecto de la glicosilación en la afinidad y actividad de la antitrombina por la heparina". Journal of Molecular Biology . 326 (3): 823–833. doi :10.1016/S0022-2836(02)01382-7. hdl : 1887/3620879 . PMID 12581643.
- ^ Turk B, Brieditis I, Bock SC, Olson ST, Björk I (junio de 1997). "La cadena lateral de oligosacáridos en Asn-135 de la alfa-antitrombina, ausente en la beta-antitrombina, disminuye la afinidad del inhibidor por la heparina al afectar el cambio conformacional inducido por la heparina". Bioquímica . 36 (22): 6682–6691. doi :10.1021/bi9702492. PMID 9184148.
- ^ Frebelius S, Isaksson S, Swedenborg J (octubre de 1996). "La inhibición de la trombina por la antitrombina III en el subendotelio se explica por la isoforma AT beta". Arteriosclerosis, trombosis y biología vascular . 16 (10): 1292–1297. doi :10.1161/01.ATV.16.10.1292. PMID 8857927.
- ^ van Boven HH, Lane DA (julio de 1997). "Antitrombina y sus estados de deficiencia hereditarios". Seminarios en Hematología . 34 (3): 188–204. PMID 9241705.
- ^ Maclean PS, Tait RC (2007). "Deficiencia de antitrombina hereditaria y adquirida: epidemiología, patogénesis y opciones de tratamiento". Drugs . 67 (10): 1429–1440. doi :10.2165/00003495-200767100-00005. PMID 17600391. S2CID 46971091.
- ^ Lane DA, Kunz G, Olds RJ, Thein SL (junio de 1996). "Genética molecular de la deficiencia de antitrombina". Blood Reviews . 10 (2): 59–74. doi :10.1016/S0268-960X(96)90034-X. PMID 8813337.
- ^ Egeberg O (junio de 1965). "Deficiencia hereditaria de antitrombina que causa trombofilia". Thrombosis et Diathesis Haemorrhagica . 13 (2): 516–530. doi :10.1055/s-0038-1656297. PMID 14347873. S2CID 42594050.
- ^ Sas G, Petö I, Bánhegyi D, Blaskó G, Domján G (junio de 1980). "Heterogeneidad de la deficiencia" clásica "de antitrombina III". Trombosis y Hemostasia . 43 (2): 133-136. doi :10.1055/s-0038-1650034. PMID 7455972. S2CID 38459609.
- ^ Lane DA, Olds RJ, Conard J, Boisclair M, Bock SC, Hultin M, et al. (diciembre de 1992). "Efectos pleiotrópicos de las mutaciones de sustitución de la cadena 1C de la antitrombina". The Journal of Clinical Investigation . 90 (6): 2422–2433. doi :10.1172/JCI116133. PMC 443398 . PMID 1469094.
- ^ Lane DA, Olds RJ, Thein SL (septiembre de 1994). "Antitrombina III: resumen de la primera actualización de la base de datos". Nucleic Acids Research . 22 (17): 3556–3559. PMC 308318 . PMID 7937056.
- ^ ab Sas G (1984). "Deficiencia hereditaria de antitrombina III: aspectos bioquímicos". Haematologia . 17 (1): 81–86. PMID 6724355.
- ^ ab Lane DA, Olds RJ, Boisclair M, Chowdhury V, Thein SL, Cooper DN, et al. (agosto de 1993). "Base de datos de mutaciones de la antitrombina III: primera actualización. Para el Subcomité de Trombina y sus Inhibidores del Comité Científico y de Normalización de la Sociedad Internacional de Trombosis y Hemostasia". Trombosis y Hemostasia . 70 (2): 361–369. doi :10.1055/s-0038-1649581. PMID 8236149. S2CID 43884122.
- ^ Olds RJ, Lane DA, Beresford CH, Abildgaard U, Hughes PM, Thein SL (abril de 1993). "Una deleción recurrente en el gen de la antitrombina, AT106-108(-6 pb), identificada mediante la detección de heterodúplex de ADN". Genomics . 16 (1): 298–299. doi :10.1006/geno.1993.1184. PMID 8486379.
- ^ Olds RJ, Lane DA, Ireland H, Finazzi G, Barbui T, Abildgaard U, et al. (diciembre de 1991). "Una mutación puntual común que produce deficiencia de antitrombina III tipo 1A: AT129 CGA a TGA (Arg a Stop)". Thrombosis Research . 64 (5): 621–625. doi :10.1016/S0049-3848(05)80011-8. PMID 1808766.
- ^ ab Imperial College London, Facultad de Medicina, Base de datos de mutaciones de antitrombina. Recuperado el 16 de agosto de 2008.
- ^ Blajchman MA, Austin RC, Fernandez-Rachubinski F, Sheffield WP (noviembre de 1992). "Base molecular de la deficiencia hereditaria de antitrombina humana". Blood . 80 (9): 2159–2171. doi : 10.1182/blood.V80.9.2159.2159 . PMID 1421387.
- ^ ab "Etiqueta de Thrombate III" (PDF) . Archivado desde el original (PDF) el 2012-11-15 . Consultado el 2013-02-23 .
- ^ Sitio web de la FDA para ATryn (BL 125284)
- ^ ab Antitrombina (recombinante) Prospecto de EE. UU. ATryn para inyección 3 de febrero de 2009
- ^ Allingstrup M, Wetterslev J, Ravn FB, Møller AM, Afshari A (abril de 2016). "Antitrombina III para pacientes con enfermedades graves: una revisión sistemática con metanálisis y análisis secuencial de ensayos". Medicina de cuidados intensivos . 42 (4): 505–520. doi :10.1007/s00134-016-4225-7. PMC 2137061 . PMID 26862016.
- ^ Mottonen J, Strand A, Symersky J, Sweet RM, Danley DE, Geoghegan KF, et al. (enero de 1992). "Base estructural de la latencia en el inhibidor del activador del plasminógeno-1". Nature . 355 (6357): 270–273. Bibcode :1992Natur.355..270M. doi :10.1038/355270a0. PMID 1731226. S2CID 4365370.
- ^ Chang WS, Harper PL (febrero de 1997). "El concentrado de antitrombina comercial contiene formas L inactivas de antitrombina". Trombosis y hemostasia . 77 (2): 323–328. doi :10.1055/s-0038-1655962. PMID 9157590. S2CID 21583152.
- ^ Wardell MR, Chang WS, Bruce D, Skinner R, Lesk AM, Carrell RW (octubre de 1997). "Inducción preparativa y caracterización de la L-antitrombina: un homólogo estructural del inhibidor del activador del plasminógeno latente-1". Bioquímica . 36 (42): 13133–13142. doi :10.1021/bi970664u. PMID 9335576.
- ^ Carrell RW, Huntington JA, Mushunje A, Zhou A (julio de 2001). "La base conformacional de la trombosis". Trombosis y hemostasia . 86 (1): 14–22. doi :10.1055/s-0037-1616196. PMID 11487000. S2CID 21452323.
- ^ abc Zhou A, Huntington JA, Carrell RW (noviembre de 1999). "Formación del heterodímero de antitrombina in vivo y aparición de trombosis". Blood . 94 (10): 3388–3396. doi :10.1182/blood.V94.10.3388.422k20_3388_3396. PMID 10552948.
- ^ Larsson H, Akerud P, Nordling K, Raub-Segall E, Claesson-Welsh L, Björk I (abril de 2001). "Una nueva forma antiangiogénica de antitrombina con capacidad de unión a proteinasas y afinidad por la heparina conservadas". The Journal of Biological Chemistry . 276 (15): 11996–12002. doi : 10.1074/jbc.M010170200 . PMID 11278631.
- ^ O'Reilly MS (octubre de 2007). "Antitrombina antiangiogénica". Seminarios sobre trombosis y hemostasia . 33 (7): 660–666. doi :10.1055/s-2007-991533. PMID 18000792. S2CID 260321466.
- ^ O'Reilly MS, Pirie-Shepherd S, Lane WS, Folkman J (septiembre de 1999). "Actividad antiangiogénica de la conformación escindida de la antitrombina serpina". Science . 285 (5435): 1926–1928. doi :10.1126/science.285.5435.1926. PMID 10489375.
Lectura adicional
- Panzer-Heinig, Sabine (2009). Antitrombina (III): establecimiento de valores de referencia pediátricos, relevancia para la CID 1992 versus 2007 (Tesis). Medizinische Fakultät Charité - Universitätsmedizin Berlin.
Enlaces externos
- Base de datos en línea MEROPS para peptidasas y sus inhibidores: I04.018 Archivado el 16 de octubre de 2019 en Wayback Machine
- Antitrombina+III en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Ubicación del genoma humano SERPINC1 y página de detalles del gen SERPINC1 en el navegador de genoma de la UCSC .