Adenocarcinoma de pulmón
| Adenocarcinoma de pulmón | |
|---|---|
| Otros nombres | Adenocarcinoma pulmonar |
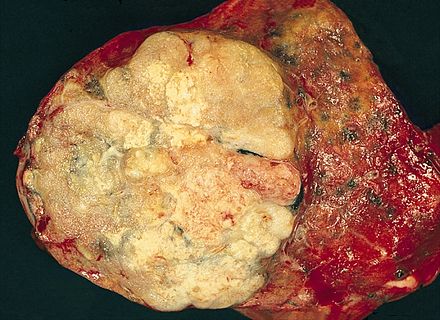 | |
| Muestra patológica macroscópica de un adenocarcinoma pulmonar, extirpado en una lobectomía . | |
| Especialidad | Oncología |
El adenocarcinoma de pulmón es el tipo más común de cáncer de pulmón y, al igual que otras formas de cáncer de pulmón , se caracteriza por características celulares y moleculares distintivas. [1] Se clasifica como uno de varios cánceres de pulmón de células no pequeñas (CPCNP), para distinguirlo del cáncer de pulmón de células pequeñas que tiene un comportamiento y pronóstico diferentes. El adenocarcinoma de pulmón se clasifica además en varios subtipos y variantes. [2] Los signos y síntomas de este tipo específico de cáncer de pulmón son similares a otras formas de cáncer de pulmón, y los pacientes se quejan más comúnmente de tos persistente y dificultad para respirar .
El adenocarcinoma es más común en pacientes con antecedentes de tabaquismo y es la forma más común de cáncer de pulmón en mujeres jóvenes y poblaciones asiáticas. La fisiopatología del adenocarcinoma es complicada, pero generalmente sigue una progresión histológica desde células que se encuentran en pulmones sanos hasta células dismórficas o irregulares. Existen varias vías moleculares y genéticas distintas que contribuyen a esta progresión. Al igual que muchos cánceres de pulmón, el adenocarcinoma de pulmón suele estar avanzado en el momento del diagnóstico. Una vez que se identifica una lesión o un tumor con diversas modalidades de diagnóstico por imágenes, como la tomografía computarizada (TC) o los rayos X , se requiere una biopsia para confirmar el diagnóstico.
El tratamiento de este cáncer de pulmón se basa en el subtipo específico y en el grado de propagación del tumor primario. En función de estos factores, se utilizan la resección quirúrgica , la quimioterapia , la radioterapia , la terapia dirigida y la inmunoterapia para intentar erradicar las células cancerosas. [3]
Signos y síntomas
La mayoría de los pacientes a los que se les diagnostica cáncer de pulmón suelen presentar una enfermedad localmente avanzada o metastásica. Solo alrededor de un tercio de los pacientes tienen la enfermedad en estadio I cuando se les diagnostica. [4] Los síntomas que presenta el paciente suelen reflejar el grado de propagación del cáncer. Los cánceres de pulmón que se detectan en forma temprana pueden causar síntomas localizados en el sistema respiratorio. Sin embargo, el cáncer de pulmón avanzado hará que los pacientes experimenten signos y síntomas adicionales secundarios a la propagación del cáncer a otros sistemas orgánicos. [5] En orden de mayor frecuencia, los signos más comunes del cáncer de pulmón incluyen: [6]
- tos que no desaparece o empeora
- Pérdida de peso
- disnea (dificultad para respirar o falta de aire)
- Dolor en el pecho, que puede agravarse al respirar profundamente, toser o reír.
- hemoptisis (tos con sangre o flema de color óxido) [7]
- Dolor de huesos
- discotecas
- fiebre
- Sentirse generalmente cansado o débil.
- Obstrucción de la vena cava superior: hinchazón de la cara, el cuello y la parte superior del torso. Esto es causado por la compresión de la vasculatura por el tumor pulmonar que restringe el retorno de sangre desde la parte superior del cuerpo. [4]
- disfagia (dificultad para tragar o sensación de que algo está atrapado en la garganta) y ronquera
- Aparición reciente de sibilancias sin antecedentes de asma
Los médicos deben tener un alto nivel de sospecha de cáncer de pulmón, especialmente en pacientes con antecedentes de tabaquismo. Los pacientes con infecciones pulmonares recurrentes o que no se resuelven (por ejemplo, bronquitis y neumonía) que no responden a los antibióticos también deben ser evaluados en busca de cáncer de pulmón. En los no fumadores, las mujeres y los asiáticos orientales tienen más probabilidades de presentar síntomas de un cáncer de pulmón subyacente a edades más tempranas. [5] Es importante destacar que muchos de estos signos se deben comúnmente a otras causas que no son el cáncer. [6]
Manifestaciones extrapulmonares
A continuación se describen los síndromes paraneoplásicos más frecuentes asociados al adenocarcinoma de pulmón:
- La hipercalcemia maligna es más frecuente en el carcinoma de células escamosas del pulmón, pero también puede presentarse en el adenocarcinoma. Las células tumorales producen el péptido relacionado con la hormona paratiroidea (PTHrP) y funciona de manera similar a la hormona paratiroidea (PTH). La producción de este péptido hormonalmente activo por las células cancerosas provoca un aumento de la resorción ósea a través de la regulación positiva de los osteoclastos, una de las células responsables de la remodelación ósea. Cuando el hueso se descompone, se libera calcio en el torrente sanguíneo, lo que produce hipercalcemia. Los signos y síntomas de un nivel elevado de calcio en la sangre incluyen: sed, fatiga, estreñimiento, poliuria (aumento de la micción) y náuseas. Es importante descartar metástasis óseas en pacientes con CPCNP porque también presentan hipercalcemia.
- La osteoartropatía pulmonar hipertrófica (OHP) es bastante rara en el adenocarcinoma. Menos del 1 % de los pacientes con adenocarcinoma de pulmón presentan este hallazgo, pero cuando ocurre, es un factor de mal pronóstico. Se desconoce el mecanismo exacto de la OHP, pero se cree que su etiología es hormonal o neurogénica. La tríada de la OHP incluye hipocratismo distal, artritis y formación perióstica simétrica bilateral. [4]
Causas
Factores de riesgo
Según el Estudio de Salud de Enfermeras , el riesgo de adenocarcinoma pulmonar aumenta sustancialmente después de un largo período de tabaquismo : los fumadores con una duración de tabaquismo previo de 30 a 40 años tienen más del doble de probabilidades de desarrollar adenocarcinoma pulmonar en comparación con los nunca fumadores ( riesgo relativo de aproximadamente 2,4); una duración de más de 40 años aumenta el riesgo relativo a 5. [8]
Este cáncer se observa generalmente en la periferia de los pulmones, a diferencia del cáncer de pulmón de células pequeñas y el cáncer de pulmón de células escamosas , que tienden a estar ubicados más centralmente, [9] [10] aunque también puede ocurrir como lesiones centrales. [10] Por razones desconocidas, a menudo surge en relación con cicatrices pulmonares periféricas. La teoría actual es que la cicatriz probablemente se produjo secundariamente al tumor, en lugar de causar el tumor. [10] El adenocarcinoma tiene una mayor incidencia en fumadores y es el tipo más común de cáncer de pulmón observado en no fumadores y mujeres. [10] La inhalación más profunda del humo del cigarrillo da lugar a lesiones periféricas que a menudo son el caso de los adenocarcinomas del pulmón. Generalmente, el adenocarcinoma crece más lentamente y forma masas más pequeñas que los otros subtipos. [10] Sin embargo, tiende a hacer metástasis en una etapa temprana. [10]
Mecanismo
Patogenesia


Estudios a gran escala como el Atlas del Genoma del Cáncer (TCGA) han caracterizado sistemáticamente las alteraciones somáticas recurrentes que probablemente impulsan la iniciación y el desarrollo del adenocarcinoma de pulmón. [11]
Mutaciones genéticas y alteraciones del número de copias
Dado que el tabaquismo es un fuerte factor mutagénico, el adenocarcinoma de pulmón es uno de los tipos de tumores con mayor número de mutaciones. [12] Las mutaciones somáticas comunes en el adenocarcinoma de pulmón afectan a muchos oncogenes y genes supresores de tumores , incluidos TP53 (mutado en el 46% de los casos), EGFR (27%), KRAS (32%), KEAP1 , STK11 y NF1 . [3] Las mutaciones de EGFR y KRAS tienden a aparecer de manera mutuamente excluyente. Las mutaciones de KRAS están asociadas con el hábito de fumar, mientras que las mutaciones de EGFR ocurren con mayor frecuencia en mujeres, personas de etnia asiática y nunca fumadores. [2]
Se han reportado amplificaciones del número de copias en oncogenes como TERT , Mdm2 , EGFR, MET y Myc , así como también eliminaciones de genes supresores de tumores como CDKN2A . [11]
Se producen alteraciones frecuentes en genes pertenecientes a la vía de la tirosina quinasa del receptor , de la que el EGFR es el ejemplo más destacado. Esta vía está implicada en la proliferación y supervivencia celular y a menudo se encuentra desregulada en el cáncer. Como consecuencia, se han desarrollado terapias dirigidas para inhibir los componentes de la vía mutante. [11] [13]
Reordenamientos cromosómicos
Tres receptores de tirosina quinasa asociados a la membrana participan de forma recurrente en fusiones o reordenamientos en adenocarcinomas : ALK , ROS1 y RET , y también se han informado más de ochenta otras translocaciones en adenocarcinomas de pulmón. [14]
En los reordenamientos de ALK, el gen asociado más común es EML4. [3]
Fisiopatología
El tracto respiratorio se puede dividir en dos componentes principales: las vías respiratorias de conducción y las vías respiratorias de intercambio de gases . Las vías respiratorias de intercambio de gases están formadas por alvéolos , pequeños sacos de aire microscópicos que son responsables del intercambio de oxígeno y dióxido de carbono durante la respiración normal . Los alvéolos están compuestos por dos tipos de células, neumocitos tipo I y tipo II. Los neumocitos tipo I cubren el 95% de las superficies alveolares y no son capaces de regenerarse. Los neumocitos tipo II son más comunes y constituyen el 60% de las células dentro del epitelio alveolar, pero constituyen solo el 3% de la superficie alveolar. [15]
Existen varios factores que contribuyen a la transformación del epitelio alveolar normal en lesiones displásicas o precancerosas. El adenocarcinoma de pulmón se desarrolla en una progresión gradual a medida que los neumocitos tipo II experimentan cambios moleculares consecutivos que alteran la regulación y el recambio celular normales. La hiperplasia adenomatosa atípica (AAH) se considera una lesión precancerosa y se cree que progresa a adenocarcinoma in situ y adenocarcinoma invasivo de pulmón. Las lesiones de AAH miden <5 mm, pueden ser únicas o múltiples y tienen un aspecto de vidrio esmerilado en las imágenes de TC. A medida que se acumulan más mutaciones genéticas y desregulación de las vías de señalización celular normales, la AAH puede progresar a adenocarcinoma in situ (AIS). Las lesiones de AIS se clasifican como tumores pequeños <3 cm con crecimiento anormal de células neumocitarias tipo II que se limita a los espacios alveolares, es decir, sin invasión del estroma, la pleura o la vasculatura. Este tipo de crecimiento se denomina "lepídico" y es característico del adenocarcinoma de pulmón en sus primeras etapas. [15]
Diagnóstico
El diagnóstico de cáncer de pulmón puede sospecharse en función de los síntomas típicos, en particular en una persona con antecedentes de tabaquismo. Los síntomas como toser sangre y pérdida de peso involuntaria pueden dar lugar a investigaciones adicionales, como estudios de diagnóstico por imágenes .
Clasificación
.jpg/440px-Adenocarcinoma_-_CT_scan_(5499628365).jpg)
La mayoría de los cánceres de pulmón se pueden clasificar como cáncer de pulmón de células pequeñas (SCLC) o cáncer de pulmón de células no pequeñas (NSCLC). El adenocarcinoma de pulmón es uno de los tres subtipos principales de NSCLC, que también incluyen el carcinoma escamoso y el carcinoma de células grandes . [15]
Históricamente, ha habido mucho debate sobre cuál es el método más preciso para describir el adenocarcinoma de pulmón y se han publicado varias revisiones de los sistemas de clasificación. Más recientemente, en 2011 se publicó la Clasificación multidisciplinaria internacional del adenocarcinoma de pulmón, que representa el consenso de varias organizaciones para describir con mayor precisión este tipo específico de cáncer de pulmón. [2] El sistema de clasificación actual tiene como objetivo predecir de manera más confiable el pronóstico y determinar el manejo terapéutico. [4]
Para determinar la clasificación, se tienen en cuenta el tamaño del tumor, el patrón de crecimiento celular y la profundidad de la invasión celular en el tejido pulmonar normal. Los siguientes nombres representan una progresión patológica escalonada en el curso natural del desarrollo del adenocarcinoma: adenocarcinoma in situ (AIS), adenocarcinoma mínimamente invasivo (MIA) y adenocarcinoma invasivo. [15] El adenocarcinoma invasivo del pulmón incluye una mezcla heterogénea de subtipos y variantes.
El consenso de 2011 describe cinco subtipos de adenocarcinomas invasivos según el patrón celular predominante. Estos subtipos se describen a continuación:



- Lepídico predominante [18]
- predominante acinar [19]
- predominantemente papilar [20]
- Predominio micropapilar [21]
- Sólido predominante con producción de mucina [22]
Los patrones celulares que identifican los subtipos están asociados con el pronóstico, que varía de favorable (lepídico) a intermedio (acinar y papilar) a malo (micropapilar y sólido). [2]
En la clasificación actual también se incluyen cuatro variantes discretas de adenocarcinomas invasivos que no se pueden asignar a estos cinco subtipos:
- adenocarcinoma mucinoso invasivo [23]
- adenocarcinoma coloide [24]
- adenocarcinoma fetal [25]
- adenocarcinoma pulmonar entérico primario [26] [4]
Imágenes
La tomografía computarizada (TC ) permite evaluar mejor los pulmones, con una mayor sensibilidad y especificidad para el cáncer de pulmón en comparación con la radiografía de tórax (aunque sigue habiendo una tasa significativa de falsos positivos [27] ). La tomografía computarizada (TC) que está específicamente dirigida a evaluar el cáncer de pulmón incluye el tórax y el abdomen superior. Esto permite evaluar otras estructuras anatómicas relevantes, como los ganglios linfáticos cercanos, las glándulas suprarrenales, el hígado y los huesos, que pueden mostrar evidencia de propagación metastásica de la enfermedad. [4] De hecho, el Grupo de Trabajo de Servicios Preventivos de EE. UU. recomienda una detección anual con TC de baja dosis en adultos de 55 a 80 años que tengan un historial de tabaquismo de 30 paquetes-año y que fumen actualmente o hayan dejado de fumar en los últimos 15 años, con ciertas salvedades (consulte Detección del cáncer de pulmón ). [28]
Las imágenes de medicina nuclear, como la PET/CT y la gammagrafía ósea , también pueden ser útiles para diagnosticar y detectar la enfermedad metastásica en otras partes del cuerpo. [7] La PET/CT utiliza un trazador metabólico activo que permite a los médicos identificar áreas del cuerpo que son hipermetabólicas. La mayor captación del trazador ocurre en células malignas y áreas de inflamación o infección. La integración de las imágenes que reflejan la actividad metabólica con las imágenes de TC normales permite una mayor sensibilidad y especificidad en comparación con la PET sola. [4]
La resonancia magnética se reserva para pacientes con enfermedad avanzada en los que es probable que haya afectación intracraneal o cerebral. También es útil para evaluar la extensión de la afectación de la pared torácica, del diafragma, del plexo braquial (como en el caso de tumores del surco superior ) o de la columna vertebral. [4]
Histopatología
Si es posible, se realiza una biopsia de cualquier tumor pulmonar sospechoso para hacer una evaluación microscópica de las células involucradas y, en última instancia, es necesaria para confirmar el diagnóstico. [7] La biopsia debe intentarse primero en lesiones distantes para establecer un diagnóstico histológico y para confirmar simultáneamente la estadificación metastásica. El material de la biopsia también se utiliza para analizar si el tumor expresa alguna mutación específica adecuada para la terapia dirigida (por ejemplo, mutación de EGFR o mutación de ALK). La biopsia se puede realizar mediante broncoscopia, biopsia con aguja transtorácica y cirugía toracoscópica asistida por video (VATS). [4]
Aunque se ha demostrado que la citología del esputo tiene una utilidad limitada, se debe realizar una toracocentesis o aspiración de líquido pleural con una aguja guiada por ecografía cuando hay derrame pleural . Cuando se identifican células malignas en el aspirado pleural de pacientes con alta sospecha de cáncer de pulmón, se establece un diagnóstico definitivo y una estadificación (adenocarcinoma de pulmón en estadio IV). [4]
El adenocarcinoma de pulmón tiende a teñirse positivamente para la mucina , ya que se deriva de las glándulas productoras de moco de los pulmones. Al igual que otros adenocarcinomas, si este tumor está bien diferenciado (grado bajo), se parecerá a la estructura glandular normal. El adenocarcinoma poco diferenciado no se parecerá a las glándulas normales (grado alto) y se detectará al ver que se tiñen positivamente para la mucina (que las glándulas producen). El adenocarcinoma también se puede distinguir mediante la tinción para TTF-1 , un marcador celular del adenocarcinoma. [29]
Como se mencionó anteriormente, la categoría de adenocarcinoma incluye una variedad de subtipos, y cualquier tumor tiende a ser heterogéneo en su composición. Actualmente, la Organización Mundial de la Salud (OMS) [1] y la Asociación Internacional para el Estudio del Cáncer de Pulmón (IASLC) / Sociedad Torácica Americana (ATS) / Sociedad Respiratoria Europea (ERS) reconocen varios subtipos principales: [30] [31] [32] adenocarcinoma predominante lepídico, adenocarcinoma predominante acinar, adenocarcinoma predominante papilar, adenocarcinoma predominante micropapilar, adenocarcinoma predominante sólido y adenocarcinoma predominante sólido con producción de mucina. En hasta el 80% de estos tumores, se reconocerán componentes de más de un subtipo. Los tumores resecados quirúrgicamente deben clasificarse mediante subtipificación histológica integral, que describa los patrones de afectación en incrementos del 5%. Luego, el subtipo histológico predominante se utiliza para clasificar el tumor en general. [2] El subtipo predominante es pronóstico de supervivencia después de la resección completa. [33]
Para revelar el linaje adenocarcinomatoso de la variante sólida, se puede realizar la demostración de la producción intracelular de mucina. Puede haber focos de metaplasia escamosa y displasia en el epitelio proximal a los adenocarcinomas, pero estas no son las lesiones precursoras de este tumor. Más bien, el precursor de los adenocarcinomas periféricos se ha denominado hiperplasia adenomatosa atípica (AAH). [10] Microscópicamente, la AAH es un foco bien delimitado de proliferación epitelial, que contiene células cuboidales a columnares bajas que se asemejan a las células club o a los neumocitos tipo II . [10] Estas muestran varios grados de atipia citológica, que incluyen hipercromasia , pleomorfismo y nucléolos prominentes . [10] Sin embargo, la atipia no es tan grave como la que se observa en los adenocarcinomas francos. [10] Las lesiones de AAH son monoclonales y comparten muchas de las aberraciones moleculares (como las mutaciones de KRAS ) que se asocian con los adenocarcinomas. [10]
El adenocarcinoma en anillo de sello y de células claras ya no son subtipos histológicos, sino más bien características citológicas que pueden ocurrir en células tumorales de múltiples subtipos histológicos, con mayor frecuencia el adenocarcinoma sólido. [30]
Tratamiento
El tratamiento del adenocarcinoma de pulmón depende de varios factores, entre ellos el estadio , la resecabilidad, el estado funcional , la histología y las alteraciones genómicas adquiridas por el tumor individual. [34]
Cirugía
Los adenocarcinomas de pulmón en estadio temprano (I, II y IIIA) generalmente se tratan quirúrgicamente para extirpar el tumor con neumonectomía o lobectomía , si se encuentra que es resecable con estudios de imágenes y biopsias y si se considera que el paciente puede tolerar la cirugía. [10] A menudo se adopta la cirugía toracoscópica asistida por video (VATS), que consiste en la inserción de un torascopio dentro de una pequeña incisión hecha en el tórax; se puede extirpar un lóbulo a través del endoscopio a través de esta pequeña incisión. [34]

Quimioterapia
En el caso de tumores pulmonares avanzados (estadio IV) e irresecables, la terapia de primera línea es la quimioterapia doble basada en platino, que combina cisplatino o carboplatino con otro agente citotóxico. [3] Los regímenes dependen en gran medida del estado funcional y la respuesta de cada paciente, y cuando el riesgo de eventos adversos podría empeorar significativamente la calidad de vida, se recomienda más la atención de apoyo básica. La quimioterapia también se utiliza como terapia adyuvante después de la cirugía para eliminar las células cancerosas restantes en pacientes con CPCNP en estadio IIA, IIB y IIIA. [34]
Radioterapia
El adenocarcinoma es un carcinoma de pulmón de células no pequeñas y no responde a la radioterapia en comparación con el carcinoma de pulmón de células pequeñas . [10] Sin embargo, la radioterapia se puede utilizar como terapia adyuvante para pacientes que se han sometido a una cirugía de resección para reducir el riesgo de recaída del cáncer de pulmón. También puede beneficiar a los tumores inoperables que se localizan en el tórax y ser parte de los cuidados paliativos para mejorar la calidad de vida en pacientes que no responden a la cirugía o la quimioterapia. [34]
Terapia dirigida
Existen terapias dirigidas para los adenocarcinomas de pulmón con ciertas características moleculares. Se han desarrollado inhibidores de la tirosina quinasa (TKI) para atacar componentes mutantes de la vía del receptor de la tirosina quinasa, como EGFR, ALK [36] y ROS1, que muestran alteraciones frecuentes en los adenocarcinomas de pulmón.
Se ha demostrado que los inhibidores de la tirosina quinasa del EGFR de primera generación, incluidos el gefitinib y el erlotinib , son más eficaces en el tratamiento de pacientes con mutación del EGFR con respecto a la quimioterapia citotóxica. Los inhibidores de segunda generación, como el afatinib y el dacomitinib, proporcionaron un ámbito de aplicación más amplio, ya que pueden dirigirse no solo a la proteína EGFR en sí, sino también a otros miembros de la familia EGFR , como HER2 y HER4 (también conocidos como ERBB2 y ERBB4), y han demostrado una mejor supervivencia sin progresión en comparación con el gefitinib. Como la causa más común de resistencia adquirida a los inhibidores de la tirosina quinasa de primera generación es una segunda mutación del EGFR en el codón 790, se ha desarrollado un inhibidor de la tirosina quinasa del EGFR de tercera generación, el osimertinib , para dirigirse también a esta nueva mutación. [3] La amplificación de MET es otro mecanismo conocido de resistencia adquirida. [2]
Los inhibidores de ALK, como el crizotinib, demostraron ser eficaces contra los tumores que albergan fusiones de ALK. La mayoría de los pacientes tratados previamente con crizotinib se beneficiaron de los inhibidores de ALK de segunda generación, incluidos ceritinib , alectinib y brigatinib . La resistencia a los inhibidores de ALK puede ocurrir con nuevas mutaciones o amplificaciones de ALK adquiridas. [3]
Los tumores ROS1 positivos también han mostrado una alta sensibilidad a los inhibidores de ALK debido a la alta homología entre los dominios quinasas de ROS1 y ALK. [3]
Inmunoterapia
Se han aprobado inhibidores de puntos de control inmunitario para el CPCNP, incluidos nivolumab y pembrolizumab anti-PD-1 . Los agentes anti-PD-1 se utilizan para pacientes con CPCNP avanzado cuyos tumores progresan después de la quimioterapia citotóxica de primera línea. Pembrolizumab se estableció como un nuevo estándar de atención para pacientes con CPCNP avanzado o metastásico con altos niveles de expresión de PD-L1, y las respuestas son aún más pronunciadas para tumores con una alta carga mutacional (es decir, que tienen un número elevado de mutaciones). [3]
A partir de 2018, se están realizando ensayos clínicos con enfoques terapéuticos que combinan múltiples inhibidores de puntos de control inmunitario o un inhibidor de puntos de control inmunitario y un agente citotóxico. [3] [37] Sin embargo, el ensayo de fase III KEYNOTE-598 informó en 2021 que agregar ipilimumab a pembrolizumab para pacientes con CPNM con una puntuación de proporción tumoral PD-L1 ≥50% no confiere ningún beneficio de eficacia, pero puede introducir una mayor toxicidad. [38] También se está investigando el papel potencial de los agentes anti-PD-1 como terapia neoadyuvante en CPNM resecables. [39]
Epidemiología
Al igual que otros subtipos de cáncer de pulmón, la incidencia de adenocarcinoma de pulmón está fuertemente asociada con el tabaquismo.
La incidencia del adenocarcinoma pulmonar ha aumentado en muchas naciones occidentales desarrolladas en las últimas décadas, con una proporción que alcanzó el 43,3% de todos los cánceres de pulmón en los EE. UU. en 2012, [40] reemplazando así al carcinoma de células escamosas de pulmón como el tipo más común de cáncer de pulmón. Esto se puede atribuir en gran medida a la disminución de las tasas de tabaquismo, que favorece la histología del adenocarcinoma. De hecho, aunque el tabaquismo sigue siendo su factor de riesgo más importante, el adenocarcinoma de pulmón es, con diferencia, el más común entre los no fumadores de toda la vida (<100 cigarrillos en la vida). [41]
Referencias
- ^ ab Travis WD, Brambilla E, Müller-Hermelink HK, Harris CC, eds. (2004). Patología y genética de los tumores de pulmón, pleura, timo y corazón (PDF) . Clasificación de tumores de la Organización Mundial de la Salud. Lyon: IARC Press. ISBN 978-92-832-2418-1Archivado desde el original (PDF) el 23 de agosto de 2009. Consultado el 27 de marzo de 2010 .
- ^ abcdef Travis WD, Brambilla E, Noguchi M, Nicholson AG, Geisinger KR, Yatabe Y, et al. (febrero de 2011). "Clasificación multidisciplinaria internacional del adenocarcinoma de pulmón de la Asociación internacional para el estudio del cáncer de pulmón/Sociedad torácica americana/Sociedad respiratoria europea". Journal of Thoracic Oncology . 6 (2): 244–285. doi :10.1097/JTO.0b013e318206a221. PMC 4513953 . PMID 21252716.
- ^ abcdefghi Herbst RS, Morgensztern D, Boshoff C (enero de 2018). "Biología y tratamiento del cáncer de pulmón de células no pequeñas". Nature . 553 (7689): 446–454. Bibcode :2018Natur.553..446H. doi :10.1038/nature25183. PMID 29364287. S2CID 4463109.
- ^ abcdefghij Fishman JA, Kotloff R, Grippi MA, Pack AI, Senior RM, Elias JA (14 de abril de 2015). Grippi MA (ed.). Enfermedades y trastornos pulmonares de Fishman . McGraw-Hill Education. ISBN 9780071807289.OCLC 898053564 .
- ^ ab Horn L, Pao W, Johnson DH (2012). "Capítulo 89". En Longo DL, Kasper DL, Jameson JL, Fauci AS, Hauser SL, Loscalzo J (eds.). Principios de medicina interna de Harrison (18.ª ed.). McGraw-Hill. ISBN 978-0-07-174889-6.
- ^ ab "Signos y síntomas del cáncer de pulmón de células no pequeñas". Cancer.org . Sociedad Estadounidense del Cáncer. 16 de mayo de 2016 . Consultado el 11 de marzo de 2018 .
- ^ abc "Pruebas para el cáncer de pulmón de células no pequeñas". Sociedad Estadounidense del Cáncer. 23 de junio de 2017. Consultado el 11 de marzo de 2018 .
- ^ Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (junio de 2008). "Comparación de aspectos del tabaquismo entre los cuatro tipos histológicos de cáncer de pulmón". Tobacco Control . 17 (3): 198–204. doi :10.1136/tc.2007.022582. PMC 3044470 . PMID 18390646.
- ^ Travis WD, Travis LB, Devesa SS (enero de 1995). "Cáncer de pulmón". Cancer . 75 (1 Suppl): 191–202. doi :10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y. PMID 8000996. S2CID 221577784.
- ^ abcdefghijklm Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). "Capítulo 13, recuadro sobre la morfología del adenocarcinoma". Robbins Basic Pathology (8.ª ed.). Filadelfia: Saunders. ISBN 978-1-4160-2973-1.
- ^ abc Cancer Genome Atlas Research Network; et al. (julio de 2014). "Perfil molecular integral del adenocarcinoma de pulmón". Nature . 511 (7511): 543–550. Bibcode :2014Natur.511..543T. doi :10.1038/nature13385. PMC 4231481 . PMID 25079552.
- ^ Ellrott K, Bailey MH, Saksena G, Covington KR, Kandoth C, Stewart C, et al. (marzo de 2018). "Enfoque científico abierto escalable para la detección de mutaciones en exomas tumorales mediante múltiples canales genómicos". Cell Systems . 6 (3): 271–281.e7. doi :10.1016/j.cels.2018.03.002. PMC 6075717 . PMID 29596782.
- ^ "Cáncer de pulmón". Genetics Home Reference . Consultado el 6 de mayo de 2019 .
- ^ "Pulmón: translocaciones en el adenocarcinoma". Atlas de Genética y Citogenética en Oncología y Hematología .
- ^ abcd Brunicardi (2014). Principios de cirugía de Schwartz (10. a ed.). McGraw-Hill. OCLC 941117341.
- ^ Chen CL, Chen CC, Yu WH, Chen SH, Chang YC, Hsu TI; et al. (2021). "Un enfoque de entrenamiento de diapositivas completas sin anotaciones para la clasificación patológica de los tipos de cáncer de pulmón mediante aprendizaje profundo". Nat Commun . 12 (1): 1193. doi :10.1038/s41467-021-21467-y. PMC 7896045 . PMID 33608558.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )
- "Este artículo está licenciado bajo una Licencia Creative Commons Atribución 4.0 Internacional" - ^ Li, Meng; Wu, Ning; Zhang, Li; Sun, Wei; Wang, Jianwei; Lv, Lv; Ren, Jiansong; Lin, Dongmei (2017). "El estado patológico N0 en el adenocarcinoma de pulmón clínico T1N0M0 es predecible por la proporción de componentes sólidos con análisis cuantitativo del número de TC". Scientific Reports . 7 (1). doi : 10.1038/s41598-017-16701-x . ISSN 2045-2322. PMC 5711838 .
- Licencia Creative Commons Atribución 4.0 Internacional - ^ Weerakkody, Yuranga. "Adenocarcinoma de pulmón con predominio lepídico | Artículo de referencia sobre radiología | Radiopaedia.org". Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. "Adenocarcinoma de pulmón con predominio acinar | Artículo de referencia sobre radiología | Radiopaedia.org". Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. «Adenocarcinoma de pulmón con predominio papilar | Artículo de referencia sobre radiología | Radiopaedia.org». Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Muzio, Bruno Di. "Adenocarcinoma de pulmón con predominio micropapilar | Artículo de referencia sobre radiología | Radiopaedia.org". Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Muzio, Bruno Di. "Adenocarcinoma de pulmón con predominio sólido y producción de mucina | Artículo de referencia sobre radiología | Radiopaedia.org". Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. «Adenocarcinoma mucinoso invasivo de pulmón | Artículo de referencia sobre radiología | Radiopaedia.org». Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. «Adenocarcinoma coloide de pulmón | Artículo de referencia sobre radiología | Radiopaedia.org». Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. «Adenocarcinoma fetal de pulmón | Artículo de referencia sobre radiología | Radiopaedia.org». Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Weerakkody, Yuranga. «Adenocarcinoma pulmonar entérico primario | Artículo de referencia sobre radiología | Radiopaedia.org». Radiopaedia . Consultado el 21 de enero de 2022 .
- ^ Gossner J (abril de 2014). "Detección del cáncer de pulmón: no olvide la radiografía de tórax". Revista mundial de radiología . 6 (4): 116–118. doi : 10.4329/wjr.v6.i4.116 . PMC 4000607 . PMID 24778773.
- ^ Grupo de trabajo de servicios preventivos de Estados Unidos (diciembre de 2016). «Declaración de recomendación final: cáncer de pulmón: detección» . Consultado el 10 de marzo de 2018 .
- ^ Informe mundial sobre el cáncer 2014. Organización Mundial de la Salud. 2014. pp. Capítulo 5.1. ISBN 978-9283204299.
- ^ ab Van Schil PE, Asamura H, Rusch VW, Mitsudomi T, Tsuboi M, Brambilla E, Travis WD (febrero de 2012). "Implicaciones quirúrgicas de la nueva clasificación de adenocarcinoma de la IASLC/ATS/ERS". The European Respiratory Journal . 39 (2): 478–486. doi : 10.1183/09031936.00027511 . PMID 21828029.
- ^ Travis WD, Brambilla E, Van Schil P, Scagliotti GV, Huber RM, Sculier JP, et al. (agosto de 2011). "Cambios de paradigma en el cáncer de pulmón según se define en la nueva clasificación de adenocarcinoma de pulmón de la IASLC/ATS/ERS". The European Respiratory Journal . 38 (2): 239–243. doi : 10.1183/09031936.00026711 . PMID 21804158.
- ^ Vazquez M, Carter D, Brambilla E, Gazdar A, Noguchi M, Travis WD, et al. (Investigadores del Programa de Acción Internacional para el Cáncer de Pulmón Temprano) (mayo de 2009). "Adenocarcinomas solitarios y múltiples resecados después de la detección por TC para el cáncer de pulmón: características histopatológicas y sus implicaciones pronósticas". Cáncer de pulmón . 64 (2): 148–154. doi :10.1016/j.lungcan.2008.08.009. PMC 2849638 . PMID 18951650.
- ^ Russell PA, Wainer Z, Wright GM, Daniels M, Conron M, Williams RA (septiembre de 2011). "¿El subtipo de adenocarcinoma de pulmón predice la supervivencia del paciente?: Un estudio clinicopatológico basado en la nueva clasificación multidisciplinaria internacional de adenocarcinoma de pulmón de la Asociación Internacional para el Estudio del Cáncer de Pulmón/Sociedad Torácica Americana/Sociedad Respiratoria Europea". Journal of Thoracic Oncology . 6 (9): 1496–1504. doi : 10.1097/JTO.0b013e318221f701 . PMID 21642859. S2CID 26574271.
- ^ abcd Zappa C, Mousa SA (junio de 2016). "Cáncer de pulmón de células no pequeñas: tratamiento actual y avances futuros". Investigación sobre cáncer de pulmón traslacional . 5 (3): 288–300. doi : 10.21037/tlcr.2016.06.07 . PMC 4931124. PMID 27413711 .
- ^ Se define a los fumadores como fumadores actuales o ex fumadores con más de un año de duración del hábito. Consulte la página de imágenes en Commons para ver los porcentajes en números. Referencia:
- ^ Arbour KC, Riely GJ (febrero de 2017). "Diagnóstico y tratamiento del cáncer de pulmón de células no pequeñas con cinasa positiva para linfoma anaplásico". Clínicas de hematología y oncología de Norteamérica . 31 (1): 101–111. doi :10.1016/j.hoc.2016.08.012. PMC 5154547. PMID 27912826 .
- ^ Hellmann MD, Ciuleanu TE, Pluzanski A, Lee JS, Otterson GA, Audigier-Valette C, et al. (mayo de 2018). "Nivolumab más ipilimumab en cáncer de pulmón con una alta carga mutacional tumoral". The New England Journal of Medicine . 378 (22): 2093–2104. doi : 10.1056/NEJMoa1801946 . PMC 7193684 . PMID 29658845.
- ^ Boyer M, Şendur M, Rodríguez-Abreu D, Park K, Lee DH, Çiçin I, Yumuk PF, Orlandi FJ, Leal TA, Molinier O, Soparattanapaisarn N, Langleben A, Califano R, Medgyasszay B, Hsia TC, Otterson GA, Xu L, Piperdi B, Samkari A, Reck M (julio de 2021). "Pembrolizumab más ipilimumab o placebo para el cáncer de pulmón de células no pequeñas metastásico con una puntuación de proporción de tumores PD-L1 ≥ 50 %: estudio de fase III aleatorizado y doble ciego KEYNOTE-598". J Clin Oncol . 39 (20): 2327–2338. doi : 10.1200/jco.20.03579 . hdl : 11424/243853 . PMID: 33513313. S2CID : 231754357.
- ^ Forde PM, Chaft JE, Smith KN, Anagnostou V, Cottrell TR, Hellmann MD, et al. (mayo de 2018). "Bloqueo neoadyuvante de PD-1 en cáncer de pulmón resecable". The New England Journal of Medicine . 378 (21): 1976–1986. doi :10.1056/NEJMoa1716078. PMC 6223617 . PMID 29658848.
- ^ "Explorar las tablas y figuras: Revisión de estadísticas de cáncer de SEER (CSR) 1975-2012". SEER . Consultado el 22 de febrero de 2019 .
- ^ Gandara DR, Hammerman PS, Sos ML, Lara PN, Hirsch FR (mayo de 2015). "Cáncer de pulmón de células escamosas: de la genómica tumoral a la terapéutica del cáncer". Clinical Cancer Research . 21 (10): 2236–2243. doi :10.1158/1078-0432.CCR-14-3039. PMC 4862209 . PMID 25979930.