Reacción sigmatrópica
En química orgánica , una reacción sigmatrópica (del griego τρόπος (trópos) 'giro') es una reacción pericíclica en la que el resultado neto es un enlace sigma (enlace σ) que se cambia a otro enlace σ en una reacción intramolecular . [1] En este tipo de reacción de reordenamiento , un sustituyente se mueve de una parte de un sistema π a otra parte con reordenamiento simultáneo del sistema π. [2] Las verdaderas reacciones sigmatrópicas normalmente no están catalizadas , aunque es posible la catálisis con ácidos de Lewis . Las reacciones sigmatrópicas a menudo tienen catalizadores de metales de transición que forman intermediarios en reacciones análogas. Los reordenamientos sigmatrópicos más conocidos son el reordenamiento de Cope [3,3] , el reordenamiento de Claisen , el reordenamiento de Carroll y la síntesis de indol de Fischer .
Descripción general de los cambios sigmatrópicos
Nomenclatura del desplazamiento sigmatrópico de Woodward-Hoffman
Los reordenamientos sigmatrópicos se describen de forma concisa mediante un término de orden [i,j] , que se define como la migración de un enlace σ adyacente a uno o más sistemas π a una nueva posición (i−1) y (j−1) átomos eliminados de la ubicación original del enlace σ. [3] Cuando la suma de i y j es un número par, esto es una indicación de la participación de una cadena neutra de átomos de C. Un número impar es una indicación de la participación de un átomo de C cargado o de un par solitario de heteroátomos que reemplaza un doble enlace CC. Por lo tanto, los desplazamientos [1,5] y [3,3] se convierten en desplazamientos [1,4] y [2,3] con heteroátomos, al tiempo que se conservan las consideraciones de simetría. Los hidrógenos se omiten en el tercer ejemplo para mayor claridad.
Un medio conveniente para determinar el orden de una determinada reorganización sigmatrópica es numerar los átomos del enlace que se está rompiendo como átomo 1 y luego contar los átomos en cada dirección desde el enlace roto hasta los átomos que forman el nuevo enlace σ en el producto, numerando consecutivamente. Los números que corresponden a los átomos que forman el nuevo enlace se separan luego con una coma y se colocan entre corchetes para crear el descriptor del orden de reacción sigmatrópica. [4]
En el caso de las migraciones de átomos de hidrógeno, se puede aplicar una técnica similar. Al determinar el orden de un desplazamiento sigmatrópico que implica una migración de átomos de hidrógeno, es fundamental contar todos los átomos involucrados en la reacción en lugar de solo los átomos más cercanos. Por ejemplo, la siguiente migración de átomos de hidrógeno es de orden [1,5], que se obtiene contando en sentido antihorario a través del sistema π, en lugar de la designación de orden [1,3] a través del grupo CH 2 del anillo que resultaría erróneamente si se contara en el sentido de las agujas del reloj.
Como enfoque general, se puede dibujar simplemente el estado de transición de la reacción. En el caso de una reacción sigmatrópica, el estado de transición constará de dos fragmentos, unidos por los enlaces σ que se forman y se rompen. La reacción sigmatrópica se denomina reordenamiento sigmatrópico [ i , j ] ( i ≤ j ) si estos dos fragmentos constan de átomos i y j . Esto se ilustra a continuación, con los fragmentos relevantes mostrados en color.
Desplazamientos suprafaciales y antarafaciales.
En principio, todos los cambios sigmatrópicos pueden ocurrir con una retención o inversión de la geometría del grupo migratorio, dependiendo de si se utiliza el lóbulo de enlace original del átomo migratorio o su otro lóbulo para formar el nuevo enlace. [4]
En los casos de retención estereoquímica , el grupo migratorio se traslada sin rotación a la posición de enlace, mientras que en el caso de inversión estereoquímica, el grupo migratorio gira y se traslada para alcanzar su conformación enlazada.
Sin embargo, otro efecto de transición estereoquímica igualmente capaz de producir productos de inversión o retención es si el grupo migratorio permanece en la cara original del sistema π después de la reunificación o en cambio se transfiere a la cara opuesta del sistema π. Si el grupo migratorio permanece en la misma cara del sistema π, el desplazamiento se conoce como suprafacial , mientras que si el grupo migratorio se transfiere a la cara opuesta se denomina desplazamiento antarafacial, [3] que son imposibles para las transformaciones que ocurren dentro de anillos de tamaño pequeño o mediano.
Clases de reordenamientos sigmatrópicos
[1,3] turnos
Desplazamientos térmicos de hidruros
En un desplazamiento térmico de hidruro [1,3] , un hidruro mueve tres átomos. Las reglas de Woodward-Hoffmann dictan que se produciría en un desplazamiento antarafacial. Aunque tal desplazamiento está permitido por la simetría, la topología de Möbius requerida en el estado de transición prohíbe tal desplazamiento porque es geométricamente imposible, lo que explica el hecho de que los enoles no se isomerizan sin un catalizador ácido o básico . [4]
Desplazamientos térmicos de alquilo
Los desplazamientos térmicos de alquilo [1,3], similares a los desplazamientos de hidruro [1,3], deben realizarse de manera antarafacial. Aquí la geometría del estado de transición es prohibitiva, pero un grupo alquilo , debido a la naturaleza de sus orbitales, puede invertir su geometría, formar un nuevo enlace con el lóbulo posterior de su orbital sp 3 y, por lo tanto, proceder a través de un desplazamiento suprafacial. Estas reacciones aún no son comunes en compuestos de cadena abierta debido a la naturaleza altamente ordenada del estado de transición, que se logra más fácilmente en moléculas cíclicas . [4]
Desplazamientos fotoquímicos [1,3]
Los cambios fotoquímicos [1,3] deberían ocurrir a través de cambios suprafaciales; sin embargo, la mayoría no son concertados porque ocurren a través de un estado triplete (es decir, tienen un mecanismo dirradical , al cual no se aplican las reglas de Woodward-Hoffmann). [4]
[1,5] turnos
Un desplazamiento [1,5] implica el desplazamiento de un sustituyente (hidruro, alquilo o arilo ) 5 átomos hacia abajo en un sistema π. Se ha demostrado que el hidrógeno se desplaza tanto en compuestos cíclicos como de cadena abierta a temperaturas de 200 ˚C o superiores. [4] Se predice que estas reacciones se desarrollan de forma suprafacial, a través de un estado de transición de topología de Hückel.
La fotoirradiación requeriría un desplazamiento antarafacial del hidrógeno. Aunque es poco frecuente, existen ejemplos en los que se favorecen los desplazamientos antarafaciales: [5]
A diferencia de los desplazamientos de hidrógeno [1,5], nunca se han observado desplazamientos de alquilo [1,5] en un compuesto de cadena abierta. [4] Sin embargo, se han realizado varios estudios para determinar las preferencias de velocidad para los desplazamientos de alquilo [1,5] en sistemas cíclicos: carbonilo y carboxilo > hidruro > fenilo y vinilo >> alquilo. [6] [7]
Los grupos alquilo sufren muy poco desplazamientos [1,5], por lo que normalmente se necesitan temperaturas altas; sin embargo, en el caso del ciclohexadieno , la temperatura para los desplazamientos de alquilo no es mucho mayor que la de los carbonilos, el mejor grupo migratorio. Un estudio demostró que esto se debe a que los desplazamientos de alquilo en los ciclohexadienos se producen a través de un mecanismo diferente. Primero se abre el anillo, seguido de un desplazamiento [1,7] y, a continuación, el anillo se reforma electrocíclicamente : [8]
Este mismo proceso mecanístico se ve a continuación, sin la reacción final de cierre del anillo electrocíclico, en la interconversión de lumisterol en vitamina D 2 .
[1,7] turnos
[1,7] Las reglas de Woodward-Hoffmann predicen que los cambios sigmatrópicos se producen de manera antarafacial, a través de un estado de transición de topología de Möbius. Se observa un cambio antarafacial [1,7] en la conversión de lumisterol en vitamina D 2 , donde después de la apertura de un anillo electrocíclico a previtamina D 2 , se produce un desplazamiento de un hidrógeno de metilo . [9]
Los nonatrienos bicíclicos también experimentan desplazamientos [1,7] en un llamado reordenamiento de caminata, [10] que es el desplazamiento del grupo divalente , como parte de un anillo de tres miembros, en una molécula bicíclica .
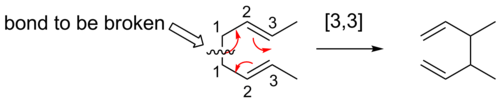
[3,3] turnos
[3,3] Los desplazamientos sigmatrópicos son reordenamientos sigmatrópicos bien estudiados. Las reglas de Woodward-Hoffman predicen que estas reacciones de seis electrones se producirían de forma suprafacial, a través de un estado de transición de topología de Hückel.
Reordenamiento de Claisen
Descubierto en 1912 por Rainer Ludwig Claisen , el reordenamiento de Claisen es el primer ejemplo registrado de un reordenamiento [3,3]-sigmatrópico. [11] [12] [13] Este reordenamiento es una reacción útil de formación de enlaces carbono - carbono . Un ejemplo de reordenamiento de Claisen es el reordenamiento [3,3] de un éter de vinilo alílico , que al calentarse produce un carbonilo γ,δ-insaturado. La formación de un grupo carbonilo hace que esta reacción, a diferencia de otros reordenamientos sigmatrópicos, sea inherentemente irreversible.
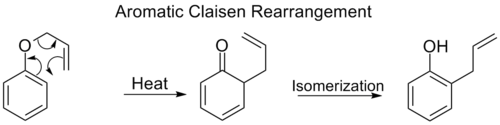
Reordenamiento de Claisen aromático
El reordenamiento orto-Claisen implica el desplazamiento [3,3] de un éter fenilalílico a un intermedio que rápidamente se tautomeriza a un fenol orto-sustituido .
Cuando ambas posiciones orto del anillo de benceno están bloqueadas, se produce un segundo reordenamiento [3,3]. Este reordenamiento para-Claisen finaliza con la tautomerización a un fenol trisustituido.
Reordenamiento de la cara
El reordenamiento de Cope es una reacción orgánica ampliamente estudiada que implica el reordenamiento sigmatrópico [3,3] de 1,5-dienos. [14] [15] [16] Fue desarrollado por Arthur C. Cope . Por ejemplo, el 3,4-dimetil-1,5-hexadieno calentado a 300 °C produce 2,6-octadieno.
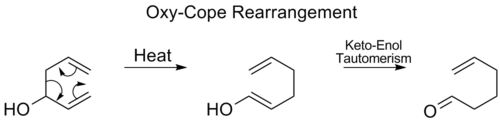
Reordenamiento de Oxy-Cope
En el reordenamiento oxi-Cope , se añade un grupo hidroxilo en C3 formando un enal o enona después del tautomerismo ceto-enólico del enol intermedio: [17]
Reordenamiento de Carroll
El reordenamiento de Carroll es una reacción de reordenamiento en química orgánica e implica la transformación de un éster alílico β -ceto en un ácido α-alil-β-cetocarboxílico. [18] Esta reacción orgánica va acompañada de descarboxilación y el producto final es una γ,δ-alilcetona. El reordenamiento de Carroll es una adaptación del reordenamiento de Claisen y efectivamente una alilación descarboxilativa .
Síntesis de indol de Fischer
La síntesis de indol de Fischer es una reacción química que produce el heterociclo aromático indol a partir de una fenilhidrazina (sustituida) y un aldehído o cetona en condiciones ácidas . [19] [20] La reacción fue descubierta en 1883 por Hermann Emil Fischer .
La elección del catalizador ácido es muy importante. Se han utilizado con éxito ácidos de Brønsted como HCl, H2SO4, ácido polifosfórico y ácido p-toluenosulfónico. Los ácidos de Lewis como el trifluoruro de boro , el cloruro de cinc , el cloruro de hierro(III) y el cloruro de aluminio también son catalizadores útiles.
Se han publicado varias revisiones. [21] [22] [23]
[5,5] Cambios
De manera similar a los desplazamientos [3,3], las reglas de Woodward-Hoffman predicen que los desplazamientos sigmatrópicos [5,5] ocurrirían suprafacialmente, en el estado de transición de la topología de Hückel. Estas reacciones son más raras que los desplazamientos sigmatrópicos [3,3], pero esto se debe principalmente al hecho de que las moléculas que pueden sufrir desplazamientos [5,5] son más raras que las moléculas que pueden sufrir desplazamientos [3,3]. [4]
[2,3] turnos
Un ejemplo de un reordenamiento 2,3-sigmatrópico es el reordenamiento 2,3-Wittig :
Reordenamientos de la marcha
La migración de un grupo divalente, como O , S , N –R o C–R 2 , que forma parte de un anillo de tres miembros en una molécula bicíclica, se conoce comúnmente como reordenamiento de caminata. Esto se puede caracterizar formalmente de acuerdo con las reglas de Woodward-Hofmann como un desplazamiento sigmatrópico (1, n). [24] Un ejemplo de dicho reordenamiento es el desplazamiento de sustituyentes en tropilidenos (1,3,5-cicloheptatrienos). Cuando se calienta, el sistema pi pasa por un cierre de anillo electrocíclico para formar biciclo[4,1,0]heptadieno (norcaradieno). A continuación sigue un desplazamiento de alquilo [1,5] y una apertura de anillo electrocíclico.
Se espera que el reordenamiento de los norcaradienos se realice a través de un desplazamiento [1,5] de manera suprafacial con una retención de la estereoquímica. Sin embargo, las observaciones experimentales muestran que los desplazamientos 1,5 de los norcaradienos se realizan de manera antarafacial. [25] Los cálculos teóricos determinaron que el desplazamiento [1,5] es un proceso dirradical , pero sin involucrar ningún mínimo dirradical en la superficie de energía potencial . [26]
Véase también
Referencias
- ^ Carey, FA y RJ Sundberg. Química orgánica avanzada, parte A ISBN 0-306-41198-9
- ^ "Reordenamientos sigmatrópicos". Chemistry LibreTexts . 11 de noviembre de 2013.
- ^ ab Woodward, RB ; Hoffmann, R. La conservación de la simetría orbital. Verlag Chemie Academic Press. 2004. ISBN 0-89573-109-6 .
- ^ abcdefgh Miller, Bernard. Química orgánica avanzada . 2.ª edición. Upper Saddle River: Pearson Prentice Hall. 2004. ISBN 0-13-065588-0
- ^ Kiefer, EF; Tana, CH J. Am. Química. Soc. , 1969 , 91 , 4478. doi : 10.1021/ja01044a027
- ^ Campos, DJ; Jones, DW; Kneen, G. Comunicaciones químicas 1976 . 873 – 874. doi :10.1039/C39760000873
- ^ Miller, LL; Greisinger, R.; Boyer, RFJ Am. Chem. Soc. 1969 . 91 . 1578. doi :10.1021/ja01034a076
- ^ Schiess, P.; Dinkel, R. Tetrahedron Letters , 1975 , 16 , 29, 2503. doi :10.1016/0040-4039(75)80050-5
- ^ Carey, Francis A; Sundberg, Richard J (2000). Química orgánica avanzada. Parte A: Estructura y mecanismos (4.ª ed.). Nueva York: Kluwer Academic/Plenum. pág. 625. ISBN 0-306-46242-7.
- ^ Klaerner, FG Agnew. Química. Internacional Ed. Ing. , 1972 , 11 , 832. doi :10.1002/anie.197208321
- ^ Claisen, L .; Ber. 1912 , 45 , 3157. doi : 10.1002/cber.19120450348
- ^ Claisen, L.; Tietze, E.; Chemische Berichte 1925 , 58 , 275. doi :10.1002/cber.19250580207
- ^ Claisen, L.; Tietze, E.; Chemische Berichte 1926 , 59 , 2344. doi :10.1002/cber.19260590927
- ^ Cope, AC ; et al . J. Am. Chem. Soc. 1940 , 62 , 441. doi :10.1021/ja01859a055
- ^ Hoffmann, R.; Stohrer, WD J. Am. Chem. Soc. 1971, 93 , 25, 6941–6948. doi :10.1021/ja00754a042
- ^ Dupuis, M.; Murray, C.; Davidson, ERJ Am. Química. Soc. 1991, 113 , 26, 9756–9759. doi :10.1021/ja00026a007
- ^ Berson, Jerome A.; Jones, Maitland. J. Am. Química. Soc. 1964, 86 , 22, 5019–5020. doi :10.1021/ja01076a067
- ^ Carrol, MF Revista de la Sociedad Química 1940, 704–706. doi :10.1039/JR9400000704.
- ^ Fischer, E.; Jourdan, F. Chemische Berichte 1883 , 16 , 2241. doi :10.1002/cber.188301602141
- ^ Fischer, E.; Hess, O. Chemische Berichte 1884 , 17 , 559. doi :10.1002/cber.188401701155
- ^ van Orden, RB; Lindwell, HG Chem. Rev. 1942 , 30 , 69–96. doi :10.1021/cr60095a004
- ^ Robinson, B. Chem. Rev. 1963 , 63 , 373–401. doi :10.1021/cr60224a003
- ^ Robinson, B. Chem. Rev. 1969 , 69 , 227–250. doi :10.1021/cr60262a003
- ^ Jensen, F. J. Am. Chem. Soc. , 1989, 111 , 13, 4643-4647. doi :10.1021/ja00195a018
- ^ Klarner, FG Temas de estereoquímica , 1984 , 15 , 1–42. ISSN 0082-500X
- ^ Kless, A.; Nendel, M.; Wilsey, S.; Houk, KN J. Am. Química. Soc. , 1999 , 121 , 4524. doi : 10.1021/ja9840192






![[1,3] Desplazamientos de alquilo](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/1%2C3alkylfixed.png/550px-1%2C3alkylfixed.png)
![[1,5] desplazamiento de hidruro en un sistema cíclico](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/1%2C5hydridecyclicfixed.png/300px-1%2C5hydridecyclicfixed.png)
![Desplazamiento del hidruro antarafacial [1,5]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/1%2C5hantarafacialfixed.png/600px-1%2C5hantarafacialfixed.png)








![[5,5] desplazamiento del fenil pentadienil éter](http://upload.wikimedia.org/wikipedia/commons/thumb/2/25/5%2C5shiftfixeds.png/800px-5%2C5shiftfixeds.png)

